

湖北省市级示范高中智学联盟2024-2025学年高二上学期12月联考化学试卷(含答案)
展开
这是一份湖北省市级示范高中智学联盟2024-2025学年高二上学期12月联考化学试卷(含答案),共22页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.下列一些诗句、成语、谚语等包含的反应过程为反应物总键能比生成物总键能高的是( )
A.千锤万凿出深山,烈火焚烧若等闲
B.滴水能把石穿透,万事功到自然成
C.爆竹声中一岁除,春风送暖入屠苏
D.野火烧不尽,春风吹又生
2.下列说法正确的是( )
A.活化分子间的碰撞不一定能发生化学反应
B.普通分子间的碰撞可能发生化学反应
C.有气体参加的化学反应,若增大压强(即缩小容器体积),可使活化分子数目增多
D.升高温度可降低反应的活化能,使得活化分子百分数增大,加快化学反应速率
3.下列各组物质中,前者属于强电解质,后者属于弱电解质的一组是( )
A.B.
C.D.
4.常温下,将的溶液加水稀释100倍的过程中,下列说法不正确的是( )
A.保持不变B.溶液中增大
C.溶液中减小D.
5.某红色溶液HM,在水溶液中存在以下平衡:,现把下列物质溶于水配成0.1ml/L的水溶液,其中能使溶液显黄色的是(已知:的,)( )
A.B.C.D.
6.设为阿伏加德罗常数的值,下列说法正确的是( )
A.的溶液中和的数目之和等于
B.电解精炼铜时转移了个电子,阳极溶解了64g铜
C.的溶液的数目为
D.常温下,的NaClO溶液中,由水电离的离子数目为
7.下列描述正确且能用勒夏特列原理解释的是( )
A.配制溶液时加入适量稀硫酸抑制铜离子的水解
B.在饱和食盐水中加入浓盐酸会析出氯化钠晶体
C.工业上催化氧化成的反应,选用常压条件而不选用高压
D.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.溶液中:
B.澄清透明的溶液:
C.水电离的的溶液中:
D.能使甲基橙变红的溶液中:
9.下列离子方程式正确的是( )
A.的水解:
B.硫酸铜溶液中加入:
C.溶液组成的原电池中负极反应式为:
D.溶液中滴加少量NaOH溶液:
10.下列说法正确的是( )
A.工业合成氨过程中,将氨液化分离,使的平衡正向移动,原料的转化率提高,反应速率加快
B.恒容绝热容器中发生反应,当压强不变时反应达到平衡状态
C.冰在室温下自动熔化成水,是熵减的过程
D.恒温、恒容条件下发生反应,加入CO,反应速率加快,活化分子百分数增大
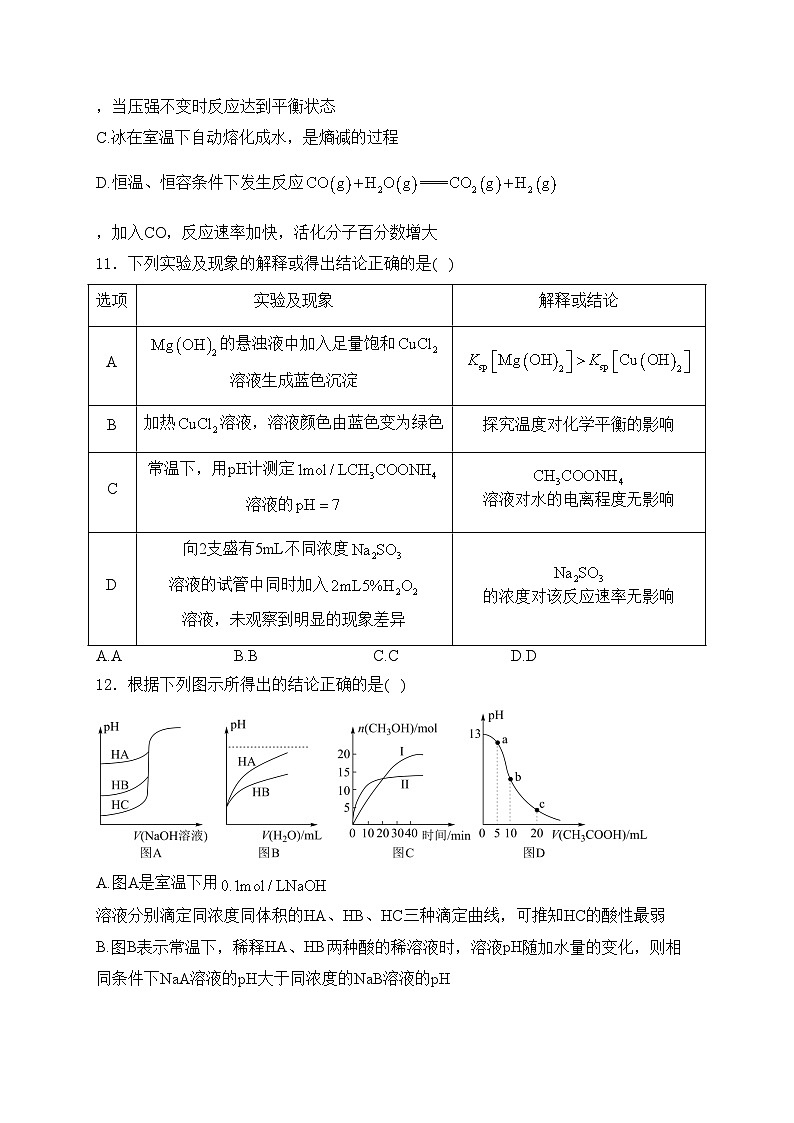
11.下列实验及现象的解释或得出结论正确的是( )
A.AB.BC.CD.D
12.根据下列图示所得出的结论正确的是( )
A.图A是室温下用溶液分别滴定同浓度同体积的HA、HB、HC三种滴定曲线,可推知HC的酸性最弱
B.图B表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
C.图C表示恒容密闭容器中发生时,其他条件相同时改变温度,时间变化的曲线,说明反应平衡常数,
D.图D表示常温下向体积为的NaOH溶液中逐滴加入溶液后溶液的pH变化曲线,则c点处有:
13.下列操作或表述正确的是( )
A.AB.BC.CD.D
14.在下图所示装置中,试管A、B中的电极为多孔的惰性电极,C、D为两个铂夹,夹在被溶液浸湿的滤纸条上,滤纸条的中部滴有液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,断开,闭合,通直流电,实验现象如图所示。下列说法不正确的是( )
A.电源中a为负极,b为正极
B.断开,闭合,滤纸条上紫红色向C处移动
C.断开,闭合,通直流电较长一段时间后,KOH溶液pH变大
D.电解一段时间后,断开,闭合,电流计的指针会发生偏转
15.某温度下,与不同pH的体系反应可生成不同的沉淀。下面图1表示体系中各含碳粒子的物质的量分数与pH的关系。图2表示与不同pH的体系反应生成沉淀的情况,其中曲线I的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合[注:起始,不同pH下由图1得到]。下列说法正确的是( )
A.起始时,平衡后溶液中存在
B.时可发生反应:
C.上述体系呈中性时,一定是
D.符合的pH范围:
二、填空题
16.I.回答下列问题
(1)能源短缺是全球面临的问题,用来生产燃料甲醇的反应原理为。已知某些化学键的键能数据如下表所示。则该反应的为___________。
(2)已知:在25℃、101kPa下,
①
②
③
25℃、101kPa下,CO与水蒸气反应转化为和的热化学方程式为___________。
(3)下列事实能说明第(2)问所求反应达到化学平衡状态的是___________(填字母)。
a.体系内浓度不再发生变化
b.体系压强不再发生变化
c.体系内
d.体系内CO的物质的量分数不再发生变化
Ⅱ.研究表明和在催化剂存在下可发生反应制得合成气,该反应的热化学方程式:。
(4)将原料按充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时体积分数与温度的关系(图中黑线)如图所示。
①、100kPa下,平衡时容器体积与初始容器体积之比为___________;该温度下,此反应的平衡常数___________(保留1位小数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②若a、B、C三点表示该反应在恒容密闭容器中,起始投料不变,不同温度和压强下已达平衡时的体积分数,___________(填字母,下同)点对应的平衡常数最大,___________点对应的压强最大。
17.常温下,几种酸或碱的电离常数如表所示。
回答下列问题:
(1)下列酸的酸性最弱的是___________(填字母)。
A.HCNB.C.D.HF
(2)甲胺是一元弱碱,在水中电离方程式为,乙胺的第一步电离方程式为___________。
(3)已知:
①增大溶液的浓度,HF的电离程度___________(填“增大”“减小”或“不变”),向HF溶液中滴加烧碱溶液,当时,___________。
②如果用HF溶液替代盐酸测定中和反应热,测得会___________(填字母)。
A.偏高B.偏低C.无影响
(4)向溶液中逐滴加入NaOH溶液至时,发生的反应的离子方程式为___________。
(5)某酸性工业废水中含有一定量的硫酸铜,其物质的量的浓度为,向该溶液中加入氢氧化钠稀溶液除去,常温下要使沉淀完全,溶液的pH应调至___________。
18.Ⅰ.和都是锂离子电池的电极材料,可利用钛铁矿(主要成分为,还有少量等杂质)来制备,工艺流程如下:
(1)“酸浸”时产生的滤渣成分是___________(写化学式);
(2)“滤液①”中若钛主要以形式存在,则“酸浸”过程中主要发生的反应离子方程式是___________;
(3)由水解产生的离子方程式是___________;
(4)沉淀与双氧水、氨水反应40min,的转化率随着温度的变化如下表所示,试分析产生这种变化可能的原因___________;
(5)“高温煅烧②”中由制备的化学方程式为___________;
Ⅱ.最近研发的可充电电池的工作示意图,锂离子导体膜只允许通过,放电时电池反应为。
(6)放电时,电池正极的电极反应式是___________;
(7)充电时,当外电路中转移1ml电子时,左室中电解质的质量减轻___________g。
三、实验题
19.氯碱工业是最基本的化学工业之一。
Ⅰ.电解饱和氯化钠溶液的装置如下图。
(1)高浓度食盐水的投料口为___________(填“a”或“b”),制取的浓氢氧化钠溶液应从___________(填“c”或“d”)口输出。
(2)上述装置中总反应的离子方程式为___________。
Ⅱ.实验室预测定氯碱工业所得NaOH溶液浓度,量取10.00mL氯碱工业所得NaOH溶液,加水稀释并最终配制成1000mL溶液;量取20.00mL所配溶液于锥形瓶,加入少量酚酞备用;实验室用0.1000ml/LHCl溶液滴定至终点后记录数据并计算。
某学生的实验步骤如下:
A.用标准溶液润洗滴定管2~3次。
B.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
C.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数。
F.用标准溶液滴定至终点,记下滴定管液面的刻度。
(3)请写出操作步骤的正确顺序___________→C→F。
滴定过程中读数如下图。
(4)滴定消耗HCl溶液的体积为___________mL。
(5)滴定至终点的判断方法为___________。
(6)氯碱工业所得NaOH溶液浓度为___________(结果保留四位有效数字);
(7)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
A.锥形瓶用待测液润洗
B.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现有气泡
D.滴定到达终点时俯视滴定管内液面读数
参考答案
1.答案:A
解析:若反应物总键能比生成物总键能高,说明物质变化过程中吸收能量,据此分析判断。
A.千锤万凿出深山,烈火焚烧若等闲,是高温煅烧分解产生CaO和,该反应为吸热反应,A正确;
B.滴水能把石穿透,万事功到自然成涉及的是,是放热反应,B错误;
C.爆竹声中一岁除,春风送暖入屠苏涉及炸药的爆炸反应,是剧烈氧化还原反应,放出大量热量,反应为放热反应,C错误;
D.野火烧不尽,春风吹又生是说物质燃烧反应,物质燃烧放出热量,是放热反应,D错误;
故选A。
2.答案:A
解析:A.碰撞不一定为有效碰撞,则活化分子间的碰撞不一定能发生化学反应,还与其分子取向有关,故A正确;
B.普通分子不具有反应所需的能量,则普通分子不能发生有效碰撞,故B错误;
C.有气体参加的反应,增大压强,单位体积内活化分子数目增多,但活化分子的数目不变,故C错误;
D.升高温度不能降低反应的活化能;使用催化剂可降低反应的活化能,使得活化分子百分数增大,加快化学反应速率,D错误;
故选A。
3.答案:D
解析:A.弱酸,部分电离,是弱电解质,NaCl在水溶液中能完全电离,在水溶液中能完全电离,是强电解质,A不符合题意;
B.在水溶液中和熔融状态下都完全电离,是强电解质,在水溶液和熔融状态下都不能导电,是非电解质,B不符合题意;
C.在水溶液中和熔融状态下都完全电离,是强电解质,在水溶液中是生成的一水合氨能电离导电而不是自身导电,在熔融状态下也不能导电,是非电解质,C不符合题意;
D.AgCl在熔融状态下能完全电离,是强电解质,HF是弱酸,部分电离,是弱电解质,D符合题意;
故选D。
4.答案:C
解析:在水中完全电离为铵离子和硫酸根,为强酸弱碱盐,少量会发生水解使得溶液呈酸性,溶液加水稀释过程中,水解程度增大但酸性有所降低;
A.稀释过程中硫酸根数目守恒,即保持不变,故A正确;
B.稀释过程中,硫酸铵溶液始终呈酸性,浓度减小,但温度没变则不变,增大,故B正确;
C.溶液加水稀释过程中,水解程度增大,水解产生的增多,故C错误;
D.硫酸铵固体中铵离子的数目是硫酸根的2倍,溶液中水解程度很小,所以,故D正确;
故选C。
5.答案:D
解析:A.通入气体,与水反应产生,电离产生,使溶液中增大,电离平衡逆向移动,导致增大,溶液显红色,A不符合题意;
B.加入发生水解产生使溶液呈酸性,溶液中增大,电离平衡逆向移动,导致增大,减小,溶液显红色,B不符合题意;
C.电离方程式为:电离大于水解,使溶液中增大,指示剂的电离平衡逆向移动,增大,减小,溶液显红色,C不符合题意;
D.溶液显碱性,消耗HM电离产生的,使溶液中减小,电离平衡正向移动,导致增大,溶液显黄色,D符合题意;
故选D。
6.答案:C
解析:A.碳元素在溶液存在形式有,根据物料守恒得出,则和的数目之和小于,A错误;
B.阳极是粗铜,含有比铜活泼的金属,活泼金属先放电,所以当转移了个电子,阳极溶解的铜小于64g,B错误;
C.在的溶液中,的数目为,C正确;
D.的NaClO溶液中,由水电离的离子数目等于溶液中的数目,即为,D错误;
故选C。
7.答案:B
解析:A.配制的溶液中引入了杂质,A错误;
B.在饱和食盐水中加入浓盐酸增大氯离子浓度,溶解平衡逆向移动,可以用勒夏特列原理解释,B正确;
C.常压下的转化率已经很大,增大压强对提高转化率无显著影响,反而会增加成本,所以采用常压条件,不能用勒夏特列原理解释,C错误;
D.高锰酸钾溶液与草酸反应是放热反应,随着反应的进行,温度升高,且生成的锰离子对反应有催化作用,所以反应迅速加快,不能用勒夏特列原理解释,D错误;
故选B。
8.答案:A
解析:A.溶液呈强碱性,各离子间不发生反应,A正确;
B.能发生氧化还原反应不能共存,B错误;
C.水电离的的溶液中,溶液可能呈酸性也可能呈碱性,当呈酸性时与不能共存,C错误;
D.甲基橙变红的溶液呈强酸性与HS-不能大量共存,D错误;
故选A。
9.答案:D
解析:A.是强碱弱酸盐,在溶液中会发生水解反应产生,水解反应的离子方程式为:,A错误;
B.FeS难溶于水,硫酸铜溶液中加入发生沉淀的转化,反应的离子方程式为,B错误;
C.溶液组成的原电池中负极反应式为:,C错误;
D.难溶,微溶,溶液与NaOH反应生成更难溶的,且NaOH少,未反应完,则总反应的离子方程式为,D正确;
故选D。
10.答案:B
解析:A.将氨液化分离,的平衡正向移动,原料的转化率提高,但氨的浓度减小,反应速率减慢,A错误;
B.恒容绝热容器中发生反应,随着反应的进行,温度发生变化,根据,压强是个变量,所以当压强不变时反应达到平衡,B正确;
C.冰在室温下自动熔化成水且,所以,C错误;
D.恒温、恒容条件下加入CO,反应物浓度增大,反应速率加快,但活化分子百分数不变,D错误;
故选B。
11.答案:B
解析:A.饱和溶液中较大,加入足量饱和溶液满足时,即有沉淀产生,则不能比较和的大小,A错误;
B.溶液中存在平衡,升高温度,平衡正向移动,黄色的增多,溶液呈现绿色,B正确;
C.溶液中相互促进水解,水的电离程度增大,但二者促进水电离程度相等,所以醋酸溶液呈中性,C错误;
D.与反应的方程式为:,反应无明显现象,故该实验不能说明的浓度对该反应速率无影响,D错误;
答案选B。
12.答案:C
解析:A.同浓度同体积的HA、HB、HC三种酸,起始时HC的pH值最小,氢离子浓度最大,故HC酸性最强,A错误;
B.图B开始的pH相同,稀释相同倍数时,酸性强的pH变化大,则HA的酸性强,相同条件下NaA溶液的pH小于同浓度的NaB溶液的pH,B错误;
C.曲线Ⅱ条件下反应速率更快,则温度更高,但平衡时甲醇的物质的量更低,说明升高温度平衡逆向移动,正反应放热,所以反应平衡常数,C正确;
D.由c点为物质的量浓度相等的和的混合溶液,电荷守恒为:,物质守恒为,消去,得质子守恒为:,D错误;
故选C。
13.答案:D
解析:A.要在铁钥匙上镀铜,应该使铁钥匙连接电源负极作阴极,Cu连接电源正极作阳极,图示连接刚好顺序相反,A错误;
B.NaOH溶液显碱性,应盛放在碱式滴定管中,不能盛放在图中酸式滴定管中,且滴定过程中眼睛应注视锥形瓶中溶液颜色变化,不应看滴定管,B错误;
C.放入热水中的气体颜色变深,说明升高温度,平衡向逆反应方向移动,该反应为放热反应,C错误;
D.水分子中氧原子带负电荷,氢原子带正电荷,水分子与NaCl中的形成水合离子时,靠近水分子中带正电的氢原子,靠近带负电的氧原子,D正确;
故选D。
14.答案:B
解析:断开,闭合,通直流电,A、B和C、D分别构成两个电解池,A、B电解池为电解KOH溶液,阳极氢氧根放电生成氧气,阴极水电离出的氢离子放电生成氢气,氢气和氧气的体积比应为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得氢气,A极上得到氧气,所以B极是阴极,A极是阳极,故a是负极,b是正极。
A.根据分析可知a为负极,b为正极,故A正确;
B.高锰酸根在水溶液中显紫红色,C与a相连,即与电源负极相连,所以C为阴极,D为阳极,高锰酸根应向阳极D移动,故B错误;
C.切断,闭合,电解较长一段时间,A、B中均有气体包围电极,电解KOH溶液,实质上是电解,不断电解消耗,使得KOH的浓度逐渐增大,则溶液中增大,因此一段时间后溶液的pH会变大,故C正确;
D.电解一段时间后,断开,闭合,则A、B试管再加水盛有KOH溶液的水槽形成碱性氢氧燃料电池,所以电流计指针发生偏转,故D正确;
故选B。
15.答案:B
解析:A.从图2可以看出时,该点位于曲线Ⅱ的上方,会生成碳酸镁沉淀,根据物料守恒,溶液中,A错误;
B.分析图1和图2,时,溶液中主要含碳离子为浓度为时,只产生沉淀,因此可以发生,B正确;
C.温度不一定是常温,因此中性体系pH不一定是7,也就不确定,故C错误;
D.由图1可知,。若,则满足下列两个关系:①,②。将①代入表达式,可得,即;将②代入表达式,可得,即。因此,符合条件的pH范围是,D错误;
答案选B。
16.答案:(1)-181.6kJ/ml
(2)
(3)ad
(4)5:4;177.8;C;C
解析:(1)反应物总键能-生成物总键能
。
(2)根据盖斯定律该反应=①-②+③,可得CO与水蒸气反应转化为和的热化学方程式为
(3)A.体系内不再发生变化,说明达到反应平衡,a正确;
B.由于方程左右两端化学计量数之和相等,则体系压强不再发生变化不能说明反应达到平衡,b错误;
C.体系内不能说明反应达到平衡,这与起始投入量有关,c错误;
D.体系内CO的物质的量分数不再发生变化,说明体系内各物质的量不再变化,说明达到反应平衡,d正确;
故选ad;
(4)①设起始时,甲烷和的物质的量均为1ml,甲烷转化的量为xml,则有三段式:
,平衡时,,则,解得:,恒压密闭容器时,体积之比等于物质的量之比,则平衡时容器体积与初始容器体积之比为,此时甲烷和的物质的量的分数均为和的物质的量的分数均为,故
②温度越高,体积分数越小,反应为吸热反应,温度升高,平衡正向移动,平衡常数K增大,故三点中,C点温度最高,平衡常数最大。该反应为气体体积增大的反应,从C点对应温度看,若压强为100kPa,平衡时,的体积分数约为,现在的体积分数近,压强应高于100kPa,同理分析出两点的压强分别小于100kPa,所以C点压强最大。
17.答案:(1)A
(2)
(3)减小;;B
(4)
(5)6.8
解析:(1)电离常数越大,弱电解质电离程度越大,酸的酸性越强。从表中数据可知电离常数:,酸性:,故答案为:A;
(2)由甲胺是一元弱碱,在水中电离方程式为,可迁移到乙胺的第一步电离方程式:,故答案为:;
(3)①增大HF浓度,电离平衡正向移动,但HF电离程度减小。已知,当时,故答案为:减小;;
②HF的电离放热,如果用HF溶液替代盐酸测定中和反应热,会使反应放出的热量增加。因为,放出的热量越多,越小。如果用溶液替代盐酸测定中和反应热,测得会偏低,故答案为:B;
(4)向溶液中逐滴加入NaOH溶液至时,发生的反应的离子方程式为,故答案为:;
(5)由溶度积可知,溶液中铜离子沉淀完全即浓度为时,溶液中氢氧根离子浓度为,则溶液的,故答案为:6.8。
18.答案:(1)
(2)
(3)
(4)40℃以前,随着温度的升高,反应速率加快,转化率增大;超过40℃双氧水分解和氨气逸出导致转化率下降
(5)
(6)
(7)13g
解析:利用钢铁矿(主要成分为,还含有少量等杂质)来制备和,由制备流程可知,加盐酸过滤后的滤渣为,滤液①中含,水解后过滤,沉淀为,与双氧水和氨水反应Ti元素的化合价升高,生成,与应后过滤得到,再与碳酸锂高温反应生成;水解后的滤液②中含,双氧水可氧化亚铁离子,在磷酸条件下过滤分离出,高温煅烧②中发生制备,据此解答。
(1)由分析可知,“酸浸”后,滤渣的主要成分为;
(2)钛主要以形式存在,即用盐酸溶解生成,相应反应的离子方程式为;
(3)滤液①中水解生成,离子方程式为:;
(4)温度越高,反应速率越快,另外温度较高时,过氧化氢会分解,故答案为:40℃以前,随着温度的升高,反应速率加快,转化率增大;超过40℃双氧水分解和氨气逸出导致转化率下降;
(5)高温下与和混合加热可得,根据电子守恒和原子守恒可得此反应的化学方程式为;
(6)放电时为正极,放电时得到电子发生还原反应生成,正极反应为:;
(7)充电时,左侧钙离子得到电子发生还原反应生成钙,,每转移1ml电子左室中0.5ml钙离子转化为钙,同时1ml锂离子迁移到左侧,故左室电解质的质量减轻0.5ml×40g/ml-1ml×7g/ml=13g。
19.答案:(1)a;c
(2)
(3)或ADBE
(4)22.00
(5)当滴入最后半滴HCl溶液后,溶液由粉红色褪为无色,且半分钟内溶液不恢复原来颜色
(6)11.00ml/L
(7)AB
解析:电解饱和氯化钠溶液的方法来制取氢氧化钠、氯气和氢气,由装置图可知左池为阳极室,与电源的正极相连;右池为阴极室,与电源的负极相连;离子方程式为:。
(1)由装置图可知左池为阳极室,故高浓度食盐水的投料口为a,故答案为:a;
装置中用的是阳离子交换膜,故制取的浓氢氧化钠溶液应从c口输出,故答案为:c;
(2)氯碱工业反应的离子方程式为,故答案为:;
(3)中和滴定有检漏、洗涤、润洗、装液、调零、取待测液加指示剂、滴定等操作,所以正确的操作顺序为:,故答案为:;
(4)由图可知步骤3中消耗HCl溶液的体积为故答案为:22.00;
(5)滴定至终点时的实验现象为当滴入最后半滴HCl溶液后,溶液由粉红色褪为无色,且半分钟内溶液不恢复原来颜色,故答案为:当滴入最后半滴HCl溶液后,溶液由粉红色褪为无色,且半分钟内溶液不恢复原来颜色;
(6)滴定所得NaOH溶液的浓度为,所以氯碱工业所得NaOH溶液的浓度为,故答案为:11.00ml/L;
(7)A.锥形瓶用待测液润洗,消耗的标准体积偏大,从而导致最终所测氢氧化钠浓度偏高,故A符合题意;
B.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定,没有润洗,标准液浓度被稀释,则消耗的标准体积偏大,从而导致最终所测氢氧化钠浓度偏高,故B符合题意;
C.滴定前尖嘴处无气泡,滴定后尖嘴处有气泡,消耗标准液的体积减小,即所测待测液浓度偏低,故C不符合题意;
D.中和滴定到达终点时俯视滴定管内液面读数,会使所测标准液的体积差偏小,从而导致最终所测氢氧化钠浓度偏低,故D不符合题意;
故选AB。
选项
实验及现象
解释或结论
A
的悬浊液中加入足量饱和溶液生成蓝色沉淀
B
加热溶液,溶液颜色由蓝色变为绿色
探究温度对化学平衡的影响
C
常温下,用pH计测定溶液的
溶液对水的电离程度无影响
D
向2支盛有5mL不同浓度溶液的试管中同时加入溶液,未观察到明显的现象差异
的浓度对该反应速率无影响
A铁钥匙上镀铜
B用标准NaOH溶液滴定盐酸
C说明正反应为吸热反应
DNaCl溶液中的水合离子
化学键
C—H
H—H
C—O
C=O
H—O
键能/
413.4
436.0
351.0
745.0
462.8
酸或碱
HCN
(次磷酸)
HF
(甲胺)
或
、
温度/℃
30
35
40
45
50
转化率/%
92
95
97
93
88
相关试卷
这是一份湖北省市级示范高中智学联盟2024-2025学年高二上学期12月联考化学试卷(Word版附解析),文件包含湖北省市级示范高中智学联盟2024-2025学年高二上学期12月联考化学试题Word版含解析docx、湖北省市级示范高中智学联盟2024-2025学年高二上学期12月联考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份2024~2025学年湖北省市级示范高中智学联盟高三(上)12月月考化学试卷(含答案),共15页。
这是一份湖北省市级示范高中智学联盟2024-2025学年高三上学期12月月考化学试卷(含答案),共24页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。









