









2025届高中化学二轮复习 板块Ⅲ 物质结构与性质 热点突破练3 元素“位、构、性”关系(课件 练习)(共2份打...
展开
这是一份2025届高中化学二轮复习 板块Ⅲ 物质结构与性质 热点突破练3 元素“位、构、性”关系(课件 练习)(共2份打...,文件包含热点突破练3元素“位构性”关系pptx、热点突破练3元素“位构性”关系练习含解析docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
1.下列说法中正确的是( )
A.基态原子的核外电子填充在5个轨道中的元素有2种B.依据能量最低原理,电子先排满L层再排M层,排满M层再排N层C.原子发射光谱是由于原子释放能量,核外电子由高能级向低能级跃迁而形成的D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
解析 基态原子的核外电子填充在5个轨道中的电子排布式为1s22s22p3~6,即N、O、F、Ne四种元素,故A错误;依据能量最低原理,电子先排满L层再排M层,不一定排满M层再排N层,比如钾的M层没有排满就排了N层,故B错误;原子释放能量,核外电子由高能级向低能级跃迁而形成的光谱为原子发射光谱,故C正确;杂化轨道可用于形成σ键或用于容纳未参与成键的孤电子对,不能形成π键,故D错误。
2.下列说法不正确的是( )
A.基态原子核外N电子层上有三个电子的元素一定是第ⅢA族元素B.基态原子核外价层电子排布式为(n-1)d6~8ns2的元素一定是第Ⅷ族元素C.基态原子的p能级上半充满的元素一定位于第ⅤA族D.基态原子核外价层电子排布式为nsxnpy的元素的族序数一定为x+y
解析 基态原子核外N电子层上有三个电子的元素,价层电子排布式是4s24p1,其最外层有3个电子,则一定是第ⅢA族元素,A正确;基态原子核外价层电子排布式为(n-1)d6~8ns2的元素一定是第Ⅷ族元素,B正确;基态原子的p能级上半充满的元素最外层电子数是5,该元素位于第ⅤA族,C正确;当x=2,y=6时,该元素是0族元素,族序数不是x+y=8,D错误。
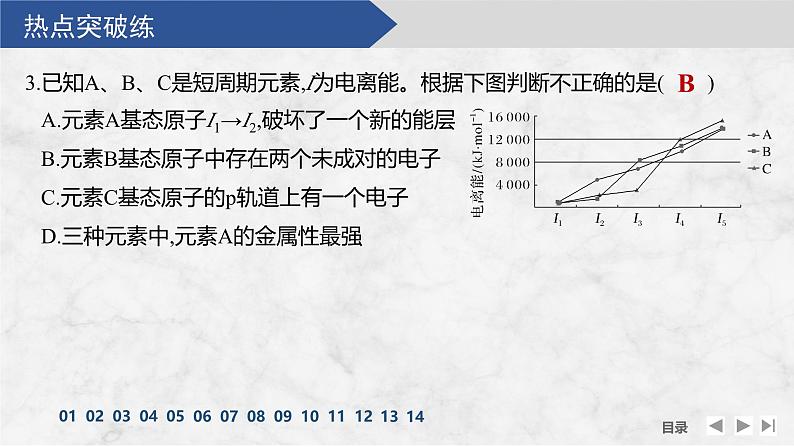
3.已知A、B、C是短周期元素,I为电离能。根据下图判断不正确的是( )
A.元素A基态原子I1→I2,破坏了一个新的能层B.元素B基态原子中存在两个未成对的电子C.元素C基态原子的p轨道上有一个电子D.三种元素中,元素A的金属性最强
解析 A的第一、二两电离能差距较大,元素A基态原子I1→I2,破坏了一个新的能层,故A正确;B的第二、三两电离能差距较大,说明B最外层有2个电子,这两个电子在s轨道中,元素B基态原子中不存在未成对的电子,故B错误;C的第三、四两电离能差距较大,说明C最外层有3个电子,其中两个电子在s轨道中,p轨道上有一个电子,故C正确;三种元素中,元素A最外层只有1个电子,A的金属性最强,故D正确。
4.嫦娥石属于陨磷钠镁钙石族,其纯晶体成分为Ca8YFe(PO4)4。下列说法正确的是( )
A.第一电离能:Na>MgB.碱性:Ca(OH)2>Mg(OH)2C.离子半径:Ca2+>P3-D.电负性:P>O解析 镁元素的原子3s轨道电子处于全充满稳定状态,第一电离能大于相邻元素,则第一电离能:Na镁,则碱性:Ca(OH)2>Mg(OH)2,B正确;核外电子排布相同时,离子半径随原子序数的增大而减小,则离子半径:Ca2+Z
解析 X有5个原子轨道填充有电子,有3个未成对电子,可知X的核外电子排布式为1s22s22p3,X为N;Y有8个不同运动状态的电子,则Y有8个核外电子,Y为O;Z的核外电子排布式为1s22s22p2,则Z为C;Q的价层电子排布式为3d104s1,则Q为Cu。同周期元素从左到右电负性依次增大,则电负性O>N,A项正确;N的2p轨道为半充满状态,比较稳定,第一电离能大于O的,B项正确;C有多种同素异形体,如金刚石、石墨等,石墨的硬度小于Cu,而金刚石的硬度大于Cu,C项不一定正确;N的最高价含氧酸为HNO3,C的最高价含氧酸为H2CO3酸性HNO3>H2CO3,D项正确。
6.叠氮化铅[Pb(N3)2]用作水下引爆剂,可由以下方法制得
解析 A.一氧化二氮和二氧化碳的原子个数都为3、价电子数都为16,互为等电子体,等电子体具有相同的空间结构,二氧化碳为直线形,则一氧化二氮的空间构型为直线形,结构式为N==N==O,所以一氧化二氮为结构不对称的极性分子,故A错误;B.由方程式可知,反应Ⅰ中氮元素和钠元素的化合价升高被氧化,钠和氨气是反应的还原剂,则反应Ⅰ每消耗23 g钠,转移电子的物质的量大于1 ml,故B错误;C.氮三离子和二氧化碳的原子个数都为3、价电子数都为16,互为等电子体,等电子体的中心原子具有相同的杂化方式和相同的空间结构,二氧化碳中碳原子为sp杂化,分子的空间构型直线形,则氮三离子中氮原子为sp杂化,分子的空间构型直线形,故C错误;D.钠易与水反应生成氢氧化钠和氢气,所以反应Ⅰ需在非水条件下进行,故D正确。
7.胆矾CuSO4·5H2O的结构示意图如图。下列有关胆矾的说法正确的是( )
A.氧原子参与形成配位键和氢键两种化学键B.上述结构中所有氧原子都采取sp3杂化C.Cu2+配位后形成的空间结构是正八面体D.胆矾中的水在不同温度下可能会分步失去
解析 A.氢键不属于化学键,故A错误;B.该结构中的氧原子部分饱和,部分不饱和,杂化方式不同,故B错误;C.由结构可知Cu2+分别与四个水分子中的O和两个硫酸根离子中的O配位,但因顶部不同,形成的空间结构为八面体,不是正八面体,故C错误;D.胆矾中的水分两类,一类是形成配体的水分子,一类是形成氢键的水分子,结构不同,因此加热过程中胆矾中的水会分步失去,故D正确。
8.X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大,X、Y同主族,Z位于周期表第13列,M是地壳中含量最多的元素,Q基态原子p轨道上有4个电子。下列说法不正确的是( )
A.原子半径大小:Q>M>XB.分子X2、M3均为非极性分子C.气态QM3分子构型为平面正三角形D.金属Y在空气中燃烧生成Y2O
9.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。下列说法正确的是( )
A.BeCl2属于电解质,但熔融态不导电B.Be位于元素周期表的p区C.BeCl2熔点比BeBr2高D.BeCl2不与NaOH溶液反应
解析 A.BeCl2熔点较低,易升华,其化学性质与AlCl3相似,符合分子晶体的性质,故BeCl2为共价化合物,熔融状态破坏不了共价键,故熔融状态不导电,A正确;B.Be位于元素周期表的s区,B错误;C.分子晶体的熔点与相对分子质量有关,通常相对分子质量越大的分子间作用力越强,熔点越高,故BeCl2熔点比BeBr2低,C错误;D.氯化铝能与氢氧化钠反应,BeCl2化学性质与AlCl3相似,故推测可以与NaOH溶液反应,D错误。
10.原子序数依次增大的4种短周期主族元素X、Y、Z、M,已知基态X原子含3个未成对电子,Y在同周期元素中的原子半径最小,Z的价层电子只有一种自旋方向,基态M原子s能级上电子总数比p能级少1。下列说法正确的是( )
A.元素最高正价:Y>X>M>ZB.简单离子半径:M>Z>X>YC.第一电离能:X>Y>Z>MD.最简单氢化物的稳定性:Y>X
解析 X原子含3个未成对电子,则其价层电子排布式为:ns2np3,且在这四种元素中其原子序数最小,则X为N,Y的原子半径最小,则Y为F元素;Z的价层电子只有一种自旋方向,则Z为Na元素,基态M原子s能级上电子总数比p能级少1,则M为Al,以此解题。A.F不能失去电子,没有正价,所以最高正价:N>Al>Na>F,A错误;B.X、Y、Z、W的简单离子分别为N3-、F-、Na+、Al3+,它们的电子层结构相同,核电荷数越大,离子半径越小,则简单离子半径:N3->F->Na+>Al3+,B错误;C.一般来说,同周期越靠右,其第一电离能越大,故第一电离能F>N>Al>Na,C错误;D.非金属性越强,则其最简单氢化物越稳定,非金属性F>N,故稳定性为HF>NH3,D正确。
11.(2024·浙江高考模拟)三聚SO3的结构如图所示,下列关于三聚SO3的推测合理的是( )
A.S原子的杂化方式与SO3分子中S原子的杂化方式相同B.S原子与O原子间的键长均相同C.SO3自发转变为三聚SO3的过程放热D.在水中的溶解度较小
解析 A.SO3分子中S原子的杂化方式为sp2,三聚三氧化硫的S原子杂化方式为sp3,A错误;B.S原子与O原子间存在双键和单键,单键和双键键长不相同,B错误;C.SO3自发转变为三聚SO3的过程是成键的过程,为放热,C正确;D.由三聚SO3的结构可知,其为极性分子,根据相似相溶原理,在水中的溶解度较大,D错误。
12.加热煮沸的浓NaOH溶液和白磷反应可制PH3,该过程同时可获得P2H4。其中一个反应为P4+3NaOH+3H2O===3NaH2PO2+PH3↑。下列说法不正确的是( )
A.稳定性:P2H4大于N2H4B.反应过程中有极性键、非极性键的断裂,也有极性键、离子键的形成C.P4、PH3与P2H4的晶体类型相同D.PH3分子中键角∠HPH小于NH3分子中∠HNH
13.化合物Z2X2W2Y7可用作食品添加剂,其阴离子结构如图所示,其组成元素X、Y、Z、W是原子序数依次增大的短周期主族元素,其中基态Y原子的s能级电子总数与p能级电子总数相等。
下列说法正确的是( )A.Y的单质一定不含极性键B.该化合物中Y、W、Z原子均为8电子结构C.简单氢化物沸点:YPH3即Y>W,C错误;D.X为H,Y为O,Z为Na,X元素分别与Z、Y元素组成的简单化合物即NaH和H2O能发生反应生成NaOH和H2,方程式为NaH+H2O===NaOH+H2↑,D正确。
14.氯化二乙基铝(CH3CH2)2AlCl既能形成稳定的二聚体,也能形成三聚体。(CH3CH2)2AlCl三聚体所有原子最外层电子均达到稳定结构,结构如图所示,下列推测不合理的是( )
A.(CH3CH2)2AlCl三聚体分子中含有3个配位键,每个Al的配位数是4B.(CH3CH2)2AlCl的三聚体为非极性分子C.(CH3CH2)2AlCl与O2完全反应生成二氧化碳、水、氧化铝和氯化氢D.(CH3CH2)2AlCl比(CH3CH2)2AlBr更易水解
相关课件
这是一份2025届高考化学一轮总复习第6章物质结构与性质元素周期律微专题9突破元素“位_构_性”综合推断题课件,共19页。
这是一份2025版高考化学一轮复习真题精练第五章物质结构与性质元素周期律第12练元素“位_构_性”关系的综合应用课件,共35页。PPT课件主要包含了元素辨析,新考法等内容,欢迎下载使用。
这是一份专题二 物质结构与性质 选择题专攻 2.元素“位—构—性”关系的分析应用课件-2024年高考化学二轮复习,共42页。PPT课件主要包含了核心精讲,元素的推断,BeAl,F无正价,W是OX是S,CSi,NaHCO3,Na或Li,微粒结构的特性,真题演练等内容,欢迎下载使用。








