





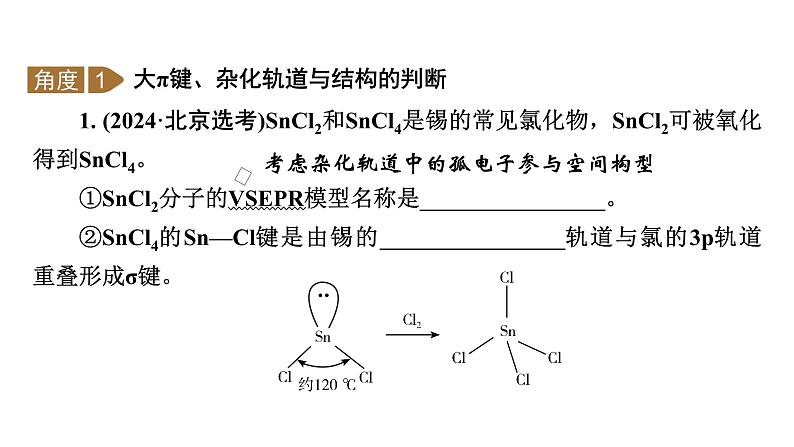








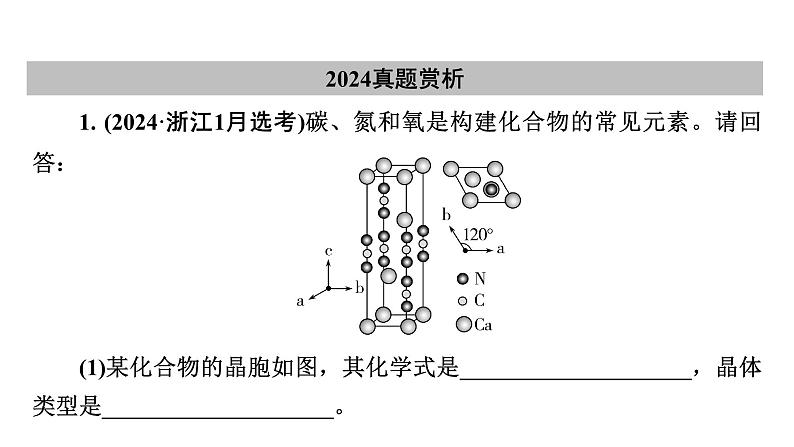






2024-2025学年高考二轮总复习课件 化学 板块1 题型突破4物质结构与性质综合(课件 练习)(共4份打包)
展开
这是一份2024-2025学年高考二轮总复习课件 化学 板块1 题型突破4物质结构与性质综合(课件 练习)(共4份打包),文件包含板块1题型突破4物质结构与性质综合突破点3晶体分析与计算pptx、板块1题型突破4物质结构与性质综合突破点2分子结构与性质pptx、板块1题型突破4物质结构与性质综合突破点1电子排布与元素性质pptx、板块1题型突破4物质结构与性质综合题型突破特训doc等4份课件配套教学资源,其中PPT共115页, 欢迎下载使用。
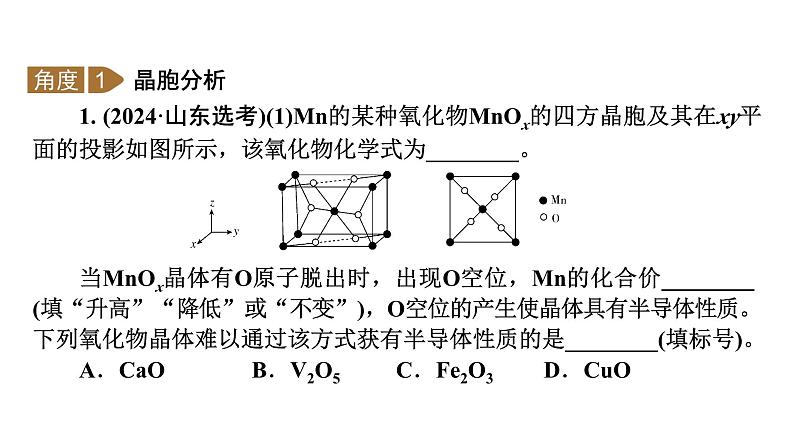
1. (2024·山东选考)(1)Mn的某种氧化物MnOx的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为________。
当MnOx晶体有O原子脱出时,出现O空位,Mn的化合价________(填“升高”“降低”或“不变”),O空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是________(填标号)。A.CaO B.V2O5C.Fe2O3 D.CuO
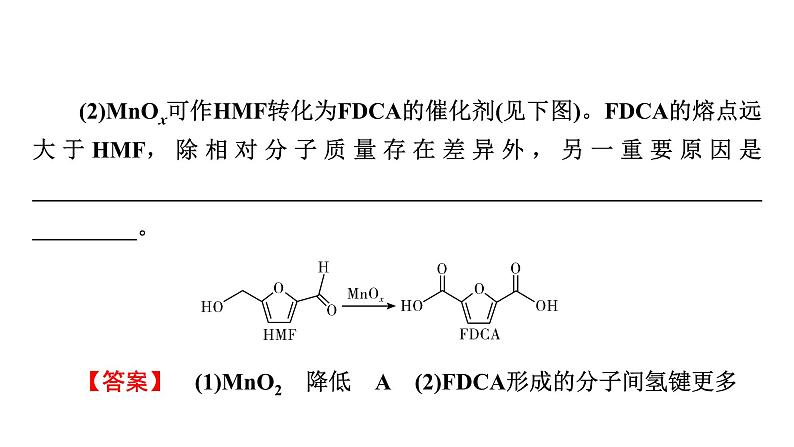
(2)MnOx可作HMF转化为FDCA的催化剂(见下图)。FDCA的熔点远大于HMF,除相对分子质量存在差异外,另一重要原因是________________________________________________________________________。
【答案】 (1)MnO2 降低 A (2)FDCA形成的分子间氢键更多
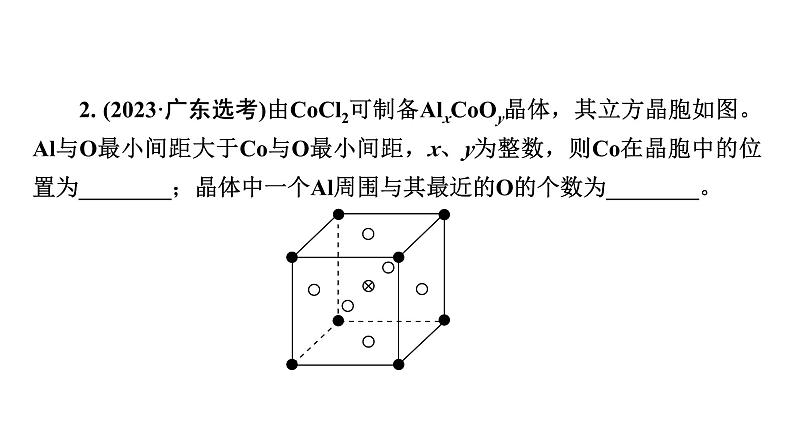
2. (2023·广东选考)由CCl2可制备AlxCOy晶体,其立方晶胞如图。Al与O最小间距大于C与O最小间距,x、y为整数,则C在晶胞中的位置为________;晶体中一个Al周围与其最近的O的个数为________。
【答案】 体心 12【解析】 由CCl2可制备AlxCOy晶体,其立方晶胞如图。x、y为整数,根据图中信息C、Al都只有一个原子,而氧(白色)原子有3个,Al与O最小间距大于C与O最小间距,则Al在顶点,因此C在晶胞中的位置为体心;晶体中一个Al周围与其最近的O原子,以顶点Al分析,面心的氧原子一个横截面有4个,三个横截面共12个,因此晶体中一个Al周围与其最近的O的个数为12。
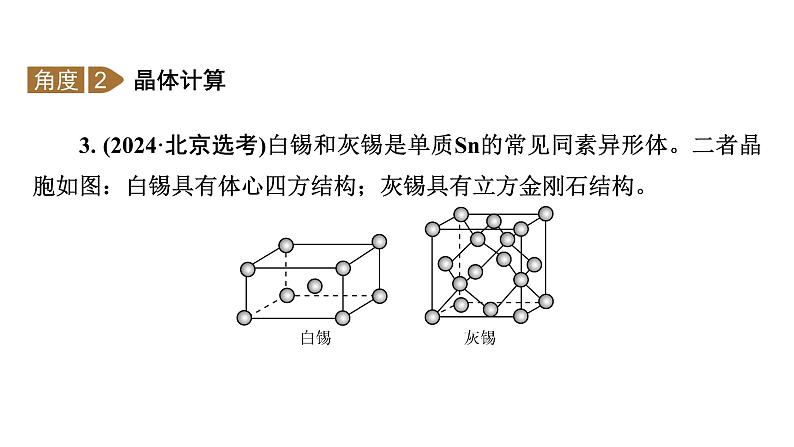
3. (2024·北京选考)白锡和灰锡是单质Sn的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
(1)① 灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有________个。②若白锡和灰锡的晶胞体积分别为V1 nm3和V2 nm3,则白锡和灰锡晶体的密度之比是________。(2)单质Sn的制备:将SnO2与焦炭充分混合后,于惰性气氛中加热至800 ℃,由于固体之间反应慢,未明显发生反应。若通入空气在 800 ℃下,SnO2能迅速被还原为单质Sn,通入空气的作用是________。
可通过原子坐标计算最近的Sn原子个数
4. (2023·山东选考)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为____________________。若阿伏加德罗常数的值为NA,化合物X的密度ρ=________g·cm-3(用含NA的代数式表示)。
晶体类型的判断方法1.判断晶体类型:(1)用类比法,如氮化铝晶体与金刚石类似,即可推出氮化铝晶体的立体结构与晶体类型。(2)熔、沸点法:共价晶体的熔、沸点及硬度很高,分子晶体的熔、沸点及硬度低。(3)从组成分析:如金属单质属于金属晶体。
2.判断物质熔、沸点:(1)分子晶体还要注意氢键,氢键分为分子内氢键和分子间氢键,分子内氢键对熔、沸点几乎没有影响。(2)离子晶体熔、沸点与晶格能有关,离子半径越小和离子所带电荷越多,晶格能越大,则熔、沸点越高。(3)共价晶体之间熔、沸点比较一般看共价键键长(原子半径大小)。3.判断硬度:一般情况下,硬度:原子晶体>离子晶体>分子晶体。金属晶体多数硬度大,但也有较小的,且具有延展性。
非长方体晶胞中微粒数目的计算方法——均摊法
熟记几种常见的晶胞结构及晶胞含有的粒子数目
【思维模型】 “向量法”确定A、B两点间距离的方法
1. (2024·湖南怀化二模)某种铁镍合金的立方晶胞如图所示,镍原子的配位数为________;该合金的化学式为________。
【答案】 4 FeNi2
2. (2024·福建龙岩市二模)镧镍合金LaNix可作储氢材料,能快速可逆地存储和释放H2,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6,晶胞结构如下图所示,晶胞参数为a nm。若A的分数坐标为(0,0.5,0.5),B的分数坐标(0.75,0.75,0),则C的分数坐标为________。
【答案】 (1,0.5,1)【解析】 若A的分数坐标为(0,0.5,0.5),B的分数坐标(0.75,0.75,0),由晶胞结构可知,C的分数坐标为(1,0.5,1)。
3. (2024·福建莆田市二模)碳酸钙的某种晶胞结构如右图所示。
(1)每个晶胞中含有________个“CaCO3”单元。(2)每个阴离子团的配位数(紧邻的阳离子数)为________。
【答案】 (1)6 (2)6
4. (2024·辽宁鞍山市二模)通过对X-射线衍射结果分析,得到12-钨磷酸根离子结构如下图,请回答:
(1)W原子的配位数为________。(2)12-钨磷酸根离子中存在________种处于不同化学环境的氧原子。
对称的氧原子属于同种环境
【答案】 (1)6 (2)4【解析】 (1)由12-钨磷酸根离子结构可知,W原子的配位数为6;(2)12-钨磷酸根离子是对称的结构,存在4种处于不同化学环境的氧原子。
5. (2024·山东威海二模)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。
该硫化物的化学式为________,晶胞中Sn的配位数与Cu的配位数之比为________。
【答案】 Cu2FeSnS4 1∶1【解析】 根据题意分析该晶胞是一个面心立方晶胞,S原子位于晶胞的顶点和面心,Cu、Fe、Sn分别位于体对角线上,因此用均摊法算出:S:4,Cu:2,Fe:1,Sn:1,因此该硫化物的化学式为Cu2FeSnS4;晶胞中Sn和Cu最近的是位于顶点的S都是一个,因此二者配位数之比为1∶1。
6. (2024·河北保定二模)铍晶胞为六方堆积结构,如图所示,铍晶体密度为________g·cm-3(用含a、NA的代数式表示)。已知:NA为阿伏加德罗常数的值,晶胞底边边长为a nm,高为2a nm。
7. (2024·河北承德部分高中二模)“高压出奇迹”,最近科学工作者发现了半导体材料立方砷化硼(BAs)中的高压热输运,并观察到热导率的反常压力依赖性,BAs的晶胞结构如图所示。则晶胞中As原子到B原子的最近距离为________pm。
8. (2024·广东广州市二模)Na2CrO4的一种晶胞如图1,沿z轴方向的投影如图2,其中氧原子不在图中标注,Cr位于晶胞面上及晶胞内。
(1)每个晶胞中含有Na+的个数为________。(2)晶胞中位于晶胞顶角及体心的Na+的距离为______________nm (用含a、b、c的式子表示)。
9. (2024·山东淄博二模)某镧镍氧化物的晶胞在xz、yz和xy平面投影分别如图所示:
晶胞中1个Ni2+周围距离相等且最近的O2-形成的空间结构为__________,La3+离子A、B间距离d=________________pm,若阿伏加德罗常数的值为NA,该晶体的密度ρ=____________g·cm-3 (用含NA的代数式表示)。
1. (2024·安徽省鼎尖联盟三模)各物质沸点如下:(1)CrCl3沸点远高于FeCl3的原因可能是__________________。(2)已知氧化锆和氧化钙形成某种亮紫色晶体,其晶胞如图所示,其中Ca位于面心位置。
①晶胞中每个Zr周围最近的O原子个数为________。②该晶胞为立方晶胞,晶胞中O和Zr最小距离为a pm,设NA为阿伏加德罗常数的值,Zr的相对原子质量为M,该晶体密度是________g/cm3 (列出计算式即可)。
【答案】 (1)CrCl3是离子晶体而FeCl3是分子晶体,破坏范德华力所需能量小于离子键
2. (2024·广东惠州市三模)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为________。若该晶胞的密度为ρ g/cm3,且用NA表示阿伏加德罗常数,则该晶胞的边长为________nm。
相关课件
这是一份2024-2025学年高考二轮总复习课件 化学 板块1 题型突破5有机化学基础综合(课件 练习)(共4份打包),文件包含板块1题型突破5有机化学基础综合突破点1命名官能团反应类型结构简式与方程式书写pptx、板块1题型突破5有机化学基础综合突破点3有机合成路线设计pptx、板块1题型突破5有机化学基础综合突破点2限定条件下同分异构体数目的判断及书写pptx、板块1题型突破5有机化学基础综合题型突破特训doc等4份课件配套教学资源,其中PPT共139页, 欢迎下载使用。
这是一份2024-2025学年高考二轮总复习课件 化学 板块1 题型突破3化学反应原理综合(课件 练习)(共4份打包),文件包含板块1题型突破3化学反应原理综合突破点1反应中的能量变化pptx、板块1题型突破3化学反应原理综合突破点2平衡中的各种计算pptx、板块1题型突破3化学反应原理综合突破点3原理中的图像分析pptx、板块1题型突破3化学反应原理综合题型突破特训doc等4份课件配套教学资源,其中PPT共153页, 欢迎下载使用。
这是一份2024-2025学年高考二轮总复习课件 化学 板块1 专题9 微专题3 晶体结构与计算(课件 练习)(共2份打包),文件包含2025年高考二轮总复习课件化学板块1专题9微专题3晶体结构与计算pptx、2025年高考二轮总复习学案化学板块1专题9微专题3晶体结构与计算练习Word版含解析doc等2份课件配套教学资源,其中PPT共55页, 欢迎下载使用。









