
广东省高州市第一中学2024-2025学年高一上学期12月月考化学试卷
展开
这是一份广东省高州市第一中学2024-2025学年高一上学期12月月考化学试卷,共12页。试卷主要包含了5 Fe 56,化学来源于生活,也服务于生活,下列鉴别方法可行的是等内容,欢迎下载使用。
一、选择题:本题共 16小题,共44分。第1~10小题,每小题2分;第11~16 小题,每小题4分。每小题给出的四个选项中,只有一项是符合题目要求的。
1.五千年中华文化不仅能彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法错误的是
A. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B. “火树银花合,星桥铁锁开”中“火树银花”与金属的“焰色试验”相关
C. “司南之杓(勺),投之于地,其柢(勺柄)指南”,司南的“杓”中含有Fe2O3
D.战国时期的“长方形铁炉”标志着我国当时已经初步掌握冶铁技术
2.化学来源于生活,也服务于生活。下列有关生活中的化学知识叙述错误的是
A.通常状况下,干燥的氯气和 Fe不反应,可以用钢瓶运输液氯
B.苏打、小苏打的水溶液均显碱性,可用作食用碱
C.水果罐头中添加维生素C作抗氧化剂,是因为维生素C易被氧化
D.漂白粉在空气中久置变质,是因为其中的CaCl₂与空气中的CO₂反应生成CaCO₃
3.表中对于相关物质的分类全部正确的是
4.常温下,下列各组离子在溶液中一定能大量共存的是
A. Mg2+、SO42-、Cl-、K+ B. Na+、OH-、NO3-、HCO3-
C. Ca²⁺、ClO⁻、H⁺、Fe²⁺ D. Na⁺、Fe³⁺、SCN⁻,Cl⁻
5.劳动开创未来。下列劳动项目与所述的化学知识没有关联的是
6.在生产、生活中铁盐与亚铁盐有重要应用。下列有关离子方程式正确的是
A.铁粉与 FeCl₃溶液反应制备 FeCl₂:Fe+Fe³⁺=2Fe²⁺
B.FeCl₃溶液与铜片反应制作印刷电路板: 2Fe³⁺+3Cu=2Fe+3Cu²⁺
C.FeCl₃溶液与氨水反应制备 FeOH₃:Fe³⁺+3OH⁻=FeOH₃↓
D.双氧水与酸性的 FeCl₂溶液反应: 2Fe²⁺+H₂O₂+2H⁺=2Fe³⁺+2H₂O
7.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S 和空气的混合气体通入 FeCl₃、FeCl₂和 CuCl₂的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法正确的是
A.①反应的离子方程式为: S²⁻+Cu²⁺= CuS↓
B.过程③中,溶液的pH减小
C.回收32g S时,理论上需要消耗标准状况下 O₂11.2L
D.根据图中信息可知氧化性: O₂>Cu²⁺>S
8.下列鉴别方法可行的是
A.用澄清石灰水鉴别Na2CO₃溶液和 NaHCO₃溶液
B.用酸性 KMnO₄溶液鉴别 FeSO₄溶液和Fe2(SO4)3 溶液
C.用 AgNO₃溶液鉴别 NaCl溶液和Na2CO₃溶液
D.用淀粉溶液鉴别 NaCl溶液和 NaI溶液
9.除去下列混合物中杂质所选的除杂试剂错误的是
10.下列各组物质中,物质之间通过一步反应能实现如图所示转化的是
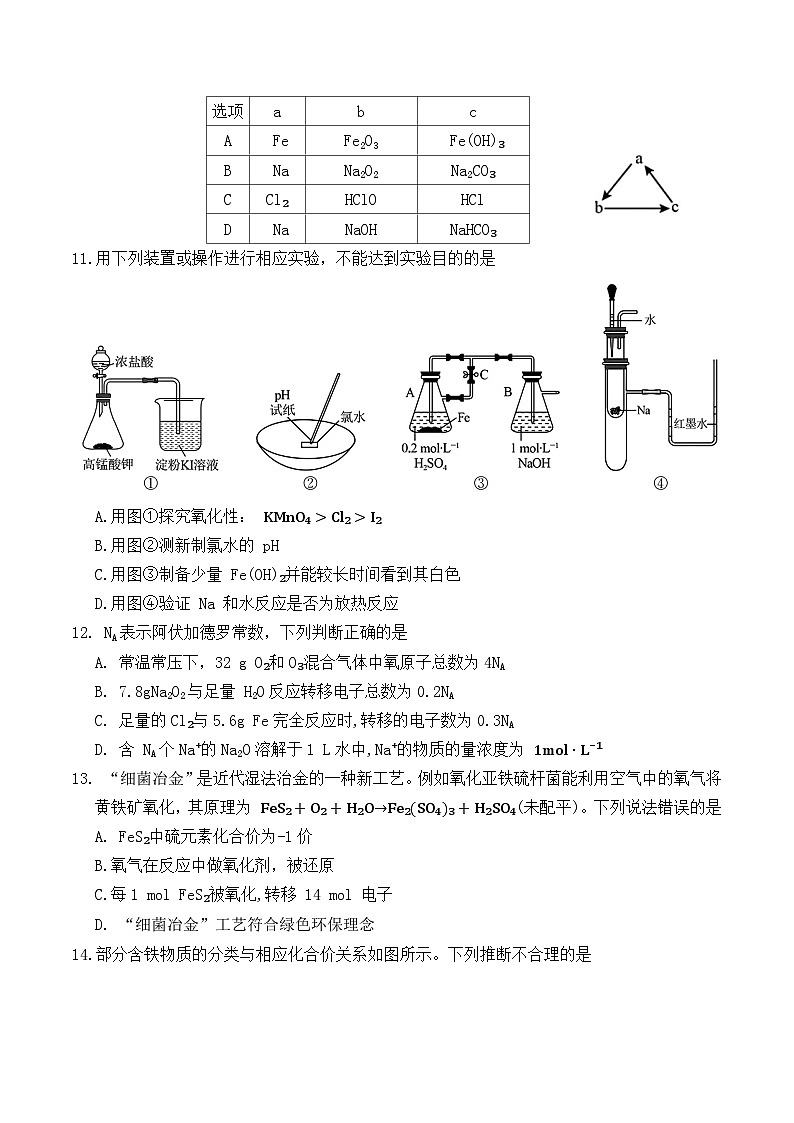
11.用下列装置或操作进行相应实验,不能达到实验目的的是
A.用图①探究氧化性: KMnO₄>Cl₂>I₂
B.用图②测新制氯水的 pH
C.用图③制备少量 Fe(OH)₂并能较长时间看到其白色
D.用图④验证 Na 和水反应是否为放热反应
12. NA表示阿伏加德罗常数,下列判断正确的是
A. 常温常压下,32 g O₂和O₃混合气体中氧原子总数为4NA
B. 7.8gNa2O2与足量 H2O反应转移电子总数为0.2NA
C. 足量的Cl₂与5.6g Fe完全反应时,转移的电子数为0.3NA
D. 含 NA个Na⁺的Na2O溶解于1 L水中,Na⁺的物质的量浓度为 1ml⋅L⁻¹
13. “细菌冶金”是近代湿法治金的一种新工艺。例如氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿氧化,其原理为 FeS₂+O₂+H₂O→Fe₂SO₄₃+H₂SO₄(未配平)。下列说法错误的是
A. FeS₂中硫元素化合价为-1价
B.氧气在反应中做氧化剂,被还原
C.每1 ml FeS₂被氧化,转移 14 ml 电子
D. “细菌冶金”工艺符合绿色环保理念
14.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.通过化合反应和复分解反应均能直接得到 d
B.a→f→g→d的每步转化均可一步实现
C.h具有强氧化性,在日常生活中可用于生活用水的消毒与净化
D.可将g加入浓碱液中制得 d的胶体
15.某同学结合所学知识探究 Na₂O₂与 H₂能否反应,设计装置如图,下列说法正确的是
A.装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变,说明气密性良好
B.为达到实验目的需在装置B中盛放无水CaCl₂
C.装置A也可直接用于碳酸钠与稀硫酸反应制取CO₂
D.反应结束后,将玻璃管C处固体加水溶解,滴加酚酞变红,不能证明C中生成了NaOH
16.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
A.原子半径:
B.Y的最高价氧化物对应的水化物的酸性比X的强
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第二周期ⅥA族
二、非选择题:本题共4小题,共56分。
17.(11分)“84”消毒液是家居常用品,某小组同学查看包装说明,得到如下信息:
该小组同学进行了如下实验,回答下列问题:
(1)稀释:将“84”消毒液原液稀释配制成480 mL c(NaClO)=0.10 ml·L⁻¹的溶液。
①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、 、 。
②稀释时,需要取用 mL“84”消毒液原液。
③下列操作会使溶液中 NaClO浓度偏低的是 (填标号)。
A.取用久置的“84”消毒液原液进行稀释
B.定容时,俯视刻度线
C.量取“84”消毒液原液时,俯视读数
D.转移溶液前容量瓶内有少量蒸馏水
(2)利用图示装置探究“84”消毒液与洁厕灵不能混用的原因(洁厕灵的主要化学成分是盐酸)。
①将注射器中的洁厕灵注入试管中,可观察到试管内产生
色气体,pH试纸 ,淀粉KI试纸上发生反应的离子方程式为 。
②棉花团蘸有的溶液 A 是 。
(3)设计实验探究“84”消毒液的漂白性。
资料:①“84”消毒液中含氯微粒主要有 ClO⁻、Cl⁻、HClO;
②ORP 表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
Ⅰ.将2mL“84”消毒液中加2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将 2 mL“84”消毒液中加入2 mL 白醋(主要成分为醋酸CH₃COOH)后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得“84”消毒液在不同温度时ORP 随时间的变化曲线如下图。
①实验Ⅱ中白醋与“84”消毒液发生反应的离子方程式为 。
②实验Ⅰ、Ⅱ现象不同的原因是为 。
③实验Ⅲ中,随时间的变化ORP值不同的原因可能是 。
18.(15分)下表为元素周期表的一部分,请回答有关问题:
(1)⑧的原子结构示意图为 。
(2)气态氢化物的稳定性:④ ⑦,与水反应的剧烈程度⑤ ⑨填(填“>”或“S;过程③中 O₂ 氧化 Fe²⁺生成 Fe³⁺和水,则氧化性: O₂>Fe³⁺, Cu元素反应整个过程不变价,无法由图中信息得知氧化性: O₂>Cu²⁺>S,故D错误。
8. B 【解释】Na₂CO₃溶液和NaHCO₃溶液均与澄清石灰水反应生成碳酸钙沉淀,现象相同不能鉴别,即 Na₂CO₃+ Ca OH₂=CaCO₃↓+2NaOH,2NaHCO₃+CaOH₂=CaCO₃↓+Na₂CO₃+2H₂O,故 A不符合题意;酸性高锰酸钾溶液能氧化亚铁离子,不能氧化铁离子, KMnO₄溶液不褪色,所以用酸性高锰酸钾溶液可以鉴别 FeSO₄溶液和 Fe₂SO₄₃溶液,故B符合题意;NaCl溶液和 Na₂CO₃溶液均与 AgNO₃溶液发生反应,都生成白色沉淀,现象相同不能鉴别,故C不符合题意;淀粉溶液加入到NaCl溶液和NaI溶液,均无现象,不能鉴别,故D不符合题意。
9. C【解释】 铁把氯化铁还原为氯化亚铁,除去 FeCl₂溶液中混有 FeCl₃的方法为加入足量铁粉,故A 正确;碳酸钠、二氧化碳、水反应生成碳酸氢钠,除去 NaHCO₃溶液中混有的 Na₂CO₃的方法为通入过量 CO₂,故B正确;碱石灰显碱性,能吸收 Cl₂,,应该用浓硫酸,故C错误;饱和 NaHCO₃溶液可以除去 HCl,故D正确。
10. C【解释】 Fe在空气中缓慢氧化生成 Fe₂O₃,但 Fe₂O₃不能一步转化为 FeOH₃,FeOH₃不能一步转化为 Fe,A不合题意; Na在空气或氧气中燃烧生成 Na₂O₂,Na₂O₂与 CO₂反应生成 Na₂CO₃,但 Na₂CO₃不能一步转化为 Na,B不合题意;Cl₂与水反应生成HClO和HCl,HClO见光分解生成HCl和( O₂,浓盐酸和 MnO₂加热反应生成 Cl₂,或者 KMnO₄与浓盐酸反应生成 Cl₂,C符合题意; Na与水反应生成NaOH 和 H₂,NaOH与过量的CO₂反应生成 NaHCO₃,,但 NaHCO₃不能一步转化为 Na,D不合题意。
11. B【解释】 2KMnO₄+16HCl浓=2KCl+2MnCl₂+5Cl₂↑+8H₂O,2KI+Cl₂=2KCl+I₂,前者氧化性: KMnO₄>Cl₂,后者氧化性 Cl₂>I₂,所以氧化性 KMnO₄>Cl₂>I₂,A正确;氯水中含有的 HClO具有强氧化性,会将pH试纸氧化变为无色,因此不能使用pH试纸测新制氯水的pH,B错误;硫酸与铁反应生成氢气,氢气能把装置A中生成的硫酸亚铁压入装置B,且氢气能排净装置内的空气,可防止氢氧化亚铁被氧化,则用图③制备少量 FeOH₂并能较长时间看到其白色,C正确; Na和水反应若放热,大试管内气体体积膨胀,U型管内红墨水的液面将出现左低右高,D正确。
12. C 【解释】32gO₂和O₃混合气体中氧原子的总质量为32g,2m l氧原子,故 A 错误; 7.8gNa₂O₂为0.1ml, Na₂O₂既做氧化剂又做还原剂,转移0.1ml的电子,故 B 错误;( Cl₂与5.6g Fe完全反应时生成 FeCl₃,0.1m l Fe转移的电子数为( 0.3NA,,故C正确;所得 NaOH溶液的体积将不是1 L,Na⁺的物质的量浓度不是 1ml⋅L⁻¹,故D错误。
13. C 【解释】FeS₂中 Fe的化合价为+2价,化合物的化合价的代数和为零,则硫元素化合价为-1价,A说法正确;氧气在反应中化合价降低,做氧化剂,被还原,B说法正确;每 1mlFeS₂被氧化,Fe的化合价由 +2变为 +3价,S的化合价由-1价变为+6价,转移电子15 ml,C说法错误;“细菌冶金”工艺不产生有毒有害的气体,符合绿色环保理念,D说法正确。
14. D 【解释】得到 Fe(OH)₃的方法有 Fe₂SO₄₃+6NaOH=2FeOH₃↓+3Na₂SO₄或 4FeOH₂+O₂+2H₂O==4Fe(OH)₃,即通过化合反应和复分解反应均能直接得到氢氧化铁,故A 正确;a→ f:2H⁺+Fe=Fe²⁺+ H₂↑,f→g;Cl₂+2Fe²⁺=2Fe³⁺+2Cl⁻,g→d;Fe³⁺+3OH⁻=FeOH₃ ,故能实现a→f→g→d的转化关系,故B正确;高铁酸盐具有强氧化性,在日常生活中可用于生活用水的消毒与净化,故C正确; Fe(Ⅲ)的盐类物质与浓碱液反应生成 FeOH₃沉淀,制备 FeOH₃胶体操作为:向沸水中滴加饱和 FeCl₃溶液,继续煮沸至溶液呈红褐色,停止加热,故D错误。
15. D 【解释】装置A气密性的检查方法,关闭K₁,然后向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好,A不正确;装置B除去 A中挥发出来的少量水蒸气和氯化氢等,应盛放碱石灰,B不正确;碳酸钠为粉末且溶于水,应选大理石与稀盐酸反应制取( CO₂,,C不正确;反应结束后,将玻璃管C处固体加水溶解,滴加酚酞变红,不能证明C中生成了 NaOH,因为 Na₂O₂与水反应也生成NaOH,D正确。
16.A 【详解】A.同一周期随着原子序数的递增,原子半径逐渐减小,同一主族随着原子序数的递增,原子半径逐渐增大,所以原子半径,A项错误;B.Y的最高价氧化物对应的水化物是,X的最高价氧化物对应的水化物是,酸性更强,B项正确;
C.Si的非金属性比O弱,所以Si的气态氢化物的热稳定性比O的小,C项正确;
D.Z是氧元素,位于元素周期表中第二周期ⅥA族,D项正确;
17.(11分,每空1分)(1)①胶头滴管、500 mL容量瓶 ②12.5 ③AC
(2)①黄绿 先变红后褪色 Cl₂+2I⁻=2Cl⁻+I₂ ②NaOH溶液
3①CH₃COOH+ClO⁻=CH₃COO⁻+HClO
②醋酸和ClO⁻反应生成 HClO,实验Ⅱ中HClO浓度大于实验Ⅰ中 HClO浓度
③温度升高次氯酸分解加快,溶液中次氯酸浓度减小,氧化性减弱
18.(15分,方程式2分,其他1分)【答案】(1) (2) >
相关试卷
这是一份广东省高州市第四中学2024-2025学年高一上学期12月月考化学试卷(图片版,含解析),共10页。
这是一份广东省深圳市观澜中学2024-2025学年高一上学期12月月考 化学试卷,共8页。
这是一份广东省茂名市高州市五校联考2024-2025学年高一上学期12月月考化学试题,共15页。试卷主要包含了考查范围,考生必须保持答题卡的整洁,为探究溶液的性质,进行如下实验,已知等内容,欢迎下载使用。









