
2025届高三化学一轮复习专项强化训练————化学反应速率定义及计算
展开
这是一份2025届高三化学一轮复习专项强化训练————化学反应速率定义及计算,共9页。试卷主要包含了异山梨醇是一种由生物质制,一定温度下等内容,欢迎下载使用。
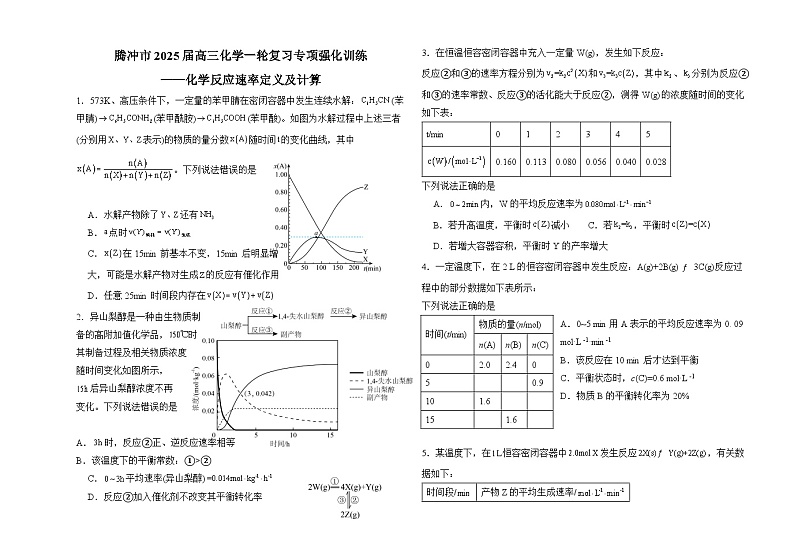
1.573K、高压条件下,一定量的苯甲腈在密闭容器中发生连续水解:(苯甲腈)(苯甲酰胺)(苯甲酸)。如图为水解过程中上述三者(分别用表示)的物质的量分数随时间的变化曲线,其中。下列说法错误的是
A.水解产物除了还有
B.点时
C.在15min前基本不变,15min后明显增
大,可能是水解产物对生成的反应有催化作用
D.任意25min时间段内存在
2.异山梨醇是一种由生物质制
备的高附加值化学品,时
其制备过程及相关物质浓度
随时间变化如图所示,
后异山梨醇浓度不再
变化。下列说法错误的是
A.时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.平均速率(异山梨醇)
D.反应②加入催化剂不改变其平衡转化率
3.在恒温恒容密闭容器中充入一定量W(g),发生如下反应:
反应②和③的速率方程分别为和,其中、分别为反应②和③的速率常数、反应③的活化能大于反应②,测得W(g)的浓度随时间的变化如下表:
下列说法正确的是
A.内,W的平均反应速率为
B.若升高温度,平衡时减小 C.若,平衡时
D.若增大容器容积,平衡时Y的产率增大
4.一定温度下,在2 L的恒容密闭容器中发生反应:A(g)+2B(g)3C(g)反应过程中的部分数据如下表所示:
下列说法正确的是
A.0~5 min用A表示的平均反应速率为0. 09 ml·L-1·min-1
B.该反应在10 min后才达到平衡
C.平衡状态时,c(C)=0.6 ml·L-1
D.物质B的平衡转化率为20%
5.某温度下,在恒容密闭容器中发生反应,有关数据如下:
下列说法错误的是
A.时,Z的浓度大于
B.时,加入,此时
C.时,Y的体积分数约为33.3%
D.时,X的物质的量为
6.恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
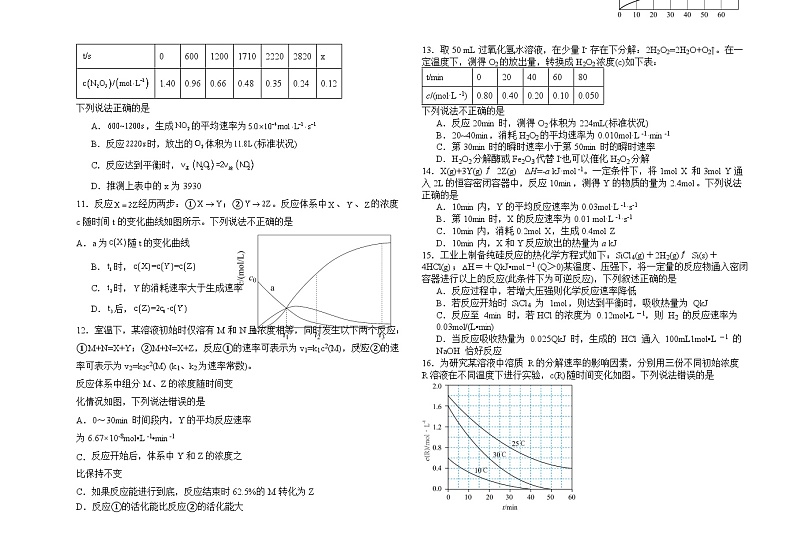
7.在相同条件下研究催化剂I、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,内,
8.在恒温恒容条件下,发生反应A(s)+2B(g)3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是
A.从a、c两点坐标可求得从a到c时间间隔内该化
学反应的平均速率
从b点切线的斜率可求得该化学反应在反应开始时
的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示
9.某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是
A.其他条件相同时,催化剂浓度越大,反应速率越大
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.条件①,反应速率为
D.条件②,降冰片烯起始浓度为时,半衰期为
10.一定温度下:在的四氯化碳溶液()中发生分解反应:。在不同时刻测量放出的体积,换算成浓度如下表:
下列说法正确的是
A.,生成的平均速率为
B.反应时,放出的体积为(标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
11.反应经历两步:①;②。反应体系中、、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为随t的变化曲线
B.时,
C.时,的消耗速率大于生成速率
D.后,
12.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。
反应体系中组分M、Z的浓度随时间变
化情况如图,下列说法错误的是
A.0~30min时间段内,Y的平均反应速率
为6.67×10-8ml•L-1•min-1
反应开始后,体系中Y和Z的浓度之
比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
13.取50 mL过氧化氢水溶液,在少量I- 存在下分解:2H2O2=2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
下列说法不正确的是
A.反应20min时,测得O2体积为224mL(标准状况)
B.20~40min,消耗H2O2的平均速率为0.010ml·L-1·min-1
C.第30min时的瞬时速率小于第50min时的瞬时速率
D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解
14.X(g)+3Y(g)2Z(g) ΔH=-a kJ·ml-1。一定条件下,将1ml X 和3ml Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4ml。下列说法正确的是
A.10min内,Y的平均反应速率为0.03ml·L-1·s-1
B.第10min时,X的反应速率为0.01 ml·L-1·s-1
C.10min内,消耗0.2ml X,生成0.4ml Z
D.10min内,X和Y反应放出的热量为a kJ
15.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g);△H=+QkJ•ml-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强则化学反应速率降低
B.若反应开始时 SiCl4 为 1ml,则达到平衡时,吸收热量为 QkJ
C.反应至 4min 时,若HCl的浓度为 0.12ml•L-1,则 H2 的反应速率为 0.03ml/(L•min)
D.当反应吸收热量为 0.025QkJ 时,生成的 HCl 通入 100mL1ml•L-1 的 NaOH 恰好反应
16.为研究某溶液中溶质 R的分解速率的影响因素,分别用三份不同初始浓度 R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法错误的是
A.25℃时,10~30min 内,R 的分解平均速率为 0.030 ml·L-1·min-1
B.对比 30℃和 10℃曲线,在同一时刻,能说明 R的分解速率随温度升高而增大
C.对比 30℃和 25℃曲线,在 0~50min 内,能说明R 的分解平均速率随温度升高而增大
D.对比 30℃和 10℃曲线,在 50min 时,R 的分解率相等
17.在一定温度下,将气体X和气体Y各0.16ml充入10L恒容密闭容器中,发生反应
X(g)+Y(g)2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3ml·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2mlZ,平衡时X的体积分数增大
18.在一定温度下,10mL0.40ml/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)ml/(L·min)
B.6~10min的平均反应速率:v(H2O2)<ml/(L·min)
C.反应至6min时,c(H2O2)=0.3ml/L
D.反应至6min时,H2O2分解了50%
19.2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为
20.在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=ml/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
参考答案:
1.D
【详解】A.苯甲腈在溶液中发生连续水解:,,有NH3生成,A正确;
B.a点之前x(Y)逐渐增大,;a点之后,x(Y)逐渐减小,a点是Y物质的最大值,则生成和消耗的速率相等。即,B正确;
C.在15min前基本不变,15min后明显增大,在没有另加物质、没有改变反应条件的情况下,可能是水解产物对生成的反应有催化作用,C正确;
D.根据图像所示,反应的前期应该有,a点之后,由于明显减小,显著增大,三者的速率关系不再满足,D错误;
故选D。
2.A
【详解】A.由图可知,3小时后异山梨醇浓度继续增大,后异山梨醇浓度才不再变化,所以时,反应②未达到平衡状态,即正、逆反应速率不相等,故A错误;
B.图像显示该温度下,后所有物质浓度都不再变化,且此时山梨醇转化完全,即反应充分,而1,4-失水山梨醇仍有剩余,即反应②正向进行程度小于反应①、反应限度小于反应①,所以该温度下的平衡常数:①>②,故B正确;
C.由图可知,在内异山梨醇的浓度变化量为0.042ml/kg,所以平均速率(异山梨醇)=,故C正确;
D.催化剂只能改变化学反应速率,不能改变物质平衡转化率,所以反应②加入催化剂不改变其平衡转化率,故D正确;
故答案为:A。
3.B
【详解】A.由表格数据可知,2min时W的浓度为0.080ml/L,则0∼2min内,W的反应速率为=0.040 ml/(L·min),故A错误;
B.反应③的活化能大于反应②说明X转化为Z的反应为放热反应,升高温度,反应②平衡向逆反应方向移动,Z的浓度减小,故B正确;
C.由反应达到平衡时,正逆反应速率相等可得:=,若,则X和Z的浓度关系为,故C错误;
D.由转化关系可知,反应①为W完全分解生成X和Y,Y只参与反应①,所以增大容器容积,平衡时Y的物质的量不变、产率不变,故D错误;
故选B。
4.C
【详解】A.0~5 min内C的物质的量增加了0.9 ml,由于容器的容积是2 L,则用C物质浓度变化表示的反应速率v(C)=,A错误;
B.反应进行到10 min时,A物质的物质的量减少0.4 ml,根据物质反应转化关系可知B物质的物质的量减少0.8 ml,B的物质的量为2.4 ml-0.8 ml=1.6 ml,B的物质的量等于15 min时B的物质的量,说明该反应在10 min时已经达到平衡状态,而不是在10 min后才达到平衡,B错误;
C.根据选项B分析可知:反应在进行到10 min时,A物质的物质的量减少0.4 ml,根据物质反应转化关系可知B物质的物质的量减少0.8 ml,则此时B的物质的量为2.4 ml-0.8 ml=1.6 ml,B的物质的量等于15 min时B的物质的量,说明该反应在10 min时已经达到平衡状态,此时反应产生C的物质的量是1.2 ml,由于容器的容积是2 L,则 平衡状态时,c(C)==0.6 ml·L-1,C正确;
D.反应开始时n(B)=2.4 ml,反应达到平衡时△n(B)=0.8 ml,则B物质的平衡转化率为:,D错误;
故合理选项是C。
5.B
【详解】A.反应开始一段时间,随着时间的延长,产物Z的平均生成速率逐渐减小,则内Z的平均生成速率大于内的,故时,Z的浓度大于,A正确;
B.时生成的Z的物质的量为,时生成的Z的物质的量为,故反应在时已达到平衡,设达到平衡时生了,列三段式:
根据,得,则Y的平衡浓度为,Z的平衡浓度为,平衡常数,时Y的浓度为,Z的浓度为,加入后Z的浓度变为,,反应正向进行,故,B错误;
C.反应生成的Y与Z的物质的量之比恒等于1∶2,反应体系中只有Y和Z为气体,相同条件下,体积之比等于物质的量之比,,故Y的体积分数始终约为33.3%,C正确;
D.由B项分析可知时反应处于平衡状态,此时生成Z为,则X的转化量为,初始X的物质的量为,剩余X的物质的量为,D正确;
故答案选B。
6.C
【详解】A.实验①中,0~20min,氨气浓度变化量为2.4010-3ml/L-2.0010-3ml/L=4.0010-4ml/L,v(NH3)==2.0010-5ml/(L·min),反应速率之比等于化学计量数之比,v(N2)=v(NH3)=1.0010-5ml/(L·min),A正确;
B.催化剂表面积大小只影响反应速率,不影响平衡,实验③中氨气初始浓度与实验①中一样,实验③达到平衡时氨气浓度为4.0010-4ml/L,则实验①达平衡时氨气浓度也为4.0010-4ml/L,而恒温恒容条件下,实验②相对于实验①为减小压强,平衡正向移动,氨气浓度减小,因此实验②60min时处于平衡状态,根据等效平衡可以判断xv(逆),B项错误;
C、 X(g)+Y(g)2Z(g) △H < 0
起始 0.16 0.16 0
变化 0.06 0.06 0.12
平衡 0.10 0.10 0.12
K==1.44,C项正确;
D、由于该反应是气体体积不变的反应,则达平衡时与原平衡等效,平衡时X的体积分数不变,D项错误;
答案选C。
18.C
【详解】A.0~6min时间内,△c(H2O2)=0.002ml÷0.01L=0.2ml/L,所以v(H2O2)=0.2ml/L÷6minml/(L·min), A正确;
B.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,B正确;
C.6min时,c(H2O2)=0.002ml÷0.01L=0.2ml/L, C错误;
D.6min时,H2O2分解率为:=50%, D正确。
答案选C。
19.D
【详解】A.加入催化剂同时改变正、逆反应速率,A项错误;
B.若是恒容条件,增加不参与反应的气体而使反应体系的压强增大,由于浓度不变,反应速度就不变,B项错误;
C.降低温度使反应速率降低,将增大反应达到平衡的时间,C项错误;
D.根据计算平均速率的定义公式可得,D项正确。
故选D。
20.C
【详解】A、根据图象可知W点消耗的X的物质的量大于M点消耗X的物质的量,因此根据热化学方程式可知W点放出的热量多,A不正确;B、T2下,在0~t1时间内X的浓度减少了(a-b)ml/L,则根据方程式可知Y的浓度增加了ml。反应速率通常用单位时间内浓度的变化量来表示,所以Y表示的反应速率为ml/(L·min),B不正确;C、根据图象可知,温度为T1时反应首先达到平衡状态。温度高反应速率快,到达平衡的时间少,则温度是T1>T2。M点温度高于N点温度,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率,C正确;D、由于反应前后均是一种物质,因此M点时再加入一定量的X,则相当于是增大压强,正反应是体积减小的可逆反应,因此平衡向正反应方向移动,所以X的转化率升高,D不正确.t/min
0
1
2
3
4
5
0.160
0.113
0.080
0.056
0.040
0.028
时间(t/min)
物质的量(n/ml)
n(A)
n(B)
n(C)
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
时间段/
产物Z的平均生成速率/
0~2
0.20
0~4
0.15
0~6
0.10
0
600
1200
1710
2220
2820
x
1.40
0.96
0.66
0.48
0.35
0.24
0.12
t/min
0
20
40
60
80
c/(ml·L-1)
0.80
0.40
0.20
0.10
0.050
t/min
2
4
7
9
n(Y)/ml
0.12
0.11
0.10
0.10
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
题号
1
2
3
4
5
6
7
8
9
10
答案
D
A
B
C
B
C
D
C
B
D
题号
11
12
13
14
15
16
17
18
19
20
答案
D
A
C
C
D
B
C
C
D
C
相关试卷
这是一份2025届高三化学一轮复习专项强化训练————影响化学反应速率的因素,共9页。试卷主要包含了下列措施能降低化学反应速率的是,下列实验能达到目的的是等内容,欢迎下载使用。
这是一份2025届高三化学一轮复习 专项强化训练——化学用语,共6页。试卷主要包含了下列叙述正确的是,下列表示不正确的是,下列化学用语表述错误的是,下列化学用语或图示正确的是等内容,欢迎下载使用。
这是一份备考2024届高考化学一轮复习强化训练第七章化学反应速率和化学平衡第1讲化学反应速率专项训练_反应历程图示,共3页。试卷主要包含了36 eV等内容,欢迎下载使用。









