






2025版高考化学全程一轮复习第3讲离子共存离子检验与推断课件
展开
这是一份2025版高考化学全程一轮复习第3讲离子共存离子检验与推断课件,共46页。PPT课件主要包含了考点一,考点二,①②③⑥,FeSCN3,答案B,不溶解,蓝色沉淀,蓝色钴玻璃,常见阴离子的检验,BaCl2溶液等内容,欢迎下载使用。
1. 了解离子反应发生条件,正确判断常见离子在溶液中能否大量共存。2.掌握常见离子的检验,能根据实验现象推断溶液中的离子。
1.离子共存的本质离子在同一溶液中能大量共存,就是指离子之间不发生反应;若离子间发生反应,则不能大量共存。
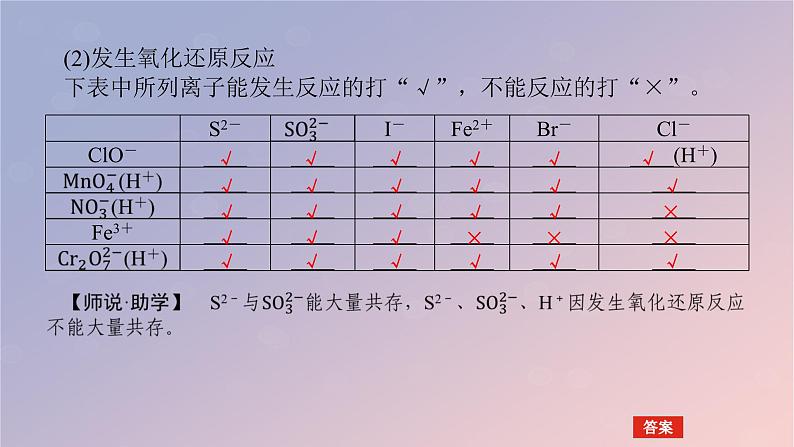
(2)发生氧化还原反应下表中所列离子能发生反应的打“√”,不能反应的打“×”。
[Ag(NH3)2]+
[Cu(NH3)4]2+
【教考衔接】典例 [2021·湖南卷,12]对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
(6)、(9)、(11)
2.Cl-与ClO-在碱性条件下能否大量共存:________(填“能”或“不能”)。写出在酸性条件下反应的离子方程式:_____________________________。
Cl-+ClO-+2H+===Cl2↑+H2O
3.下列有关粒子大量共存的分析正确的是( )
1.常见阳离子的检验(1)依据生成的沉淀检验
(2)依据生成的气体检验 产生使湿润的红色石蕊试纸变蓝的气体。
(3)依据显示特殊颜色检验
先无明显变化,后变红色
四氯化碳层(下层)呈紫红色
【师说·助学】 举例强调“离子检验中排除干扰的措施”
3.离子推断的“四项基本原则”(1)肯定原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子。(2)互斥原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在。(3)电中性原则:溶液呈电中性,溶液中有阳离子,必有阴离子,且溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等。(4)进出原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
错误。溶液中可能存在Ag+。
【教考衔接】典例1 [2023·辽宁卷,4]下列鉴别或检验不能达到实验目的的是( )A.用石灰水鉴别Na2CO3与NaHCO3B.用KSCN溶液检验FeSO4是否变质C.用盐酸酸化的BaCl2溶液检验Na2SO3是否被氧化D.加热条件下用银氨溶液检验乙醇中是否混有乙醛
解析:石灰水的主要成分为Ca(OH)2能与碳酸钠和碳酸氢钠反应生成碳酸钙,二者均生成白色沉淀,不能达到鉴别的目的,A错误;Fe2+变质后会生成Fe3+,可以利用KSCN溶液鉴别,现象为溶液变成血红色,可以达到检验的目的,B正确;Na2SO3被氧化后会变成Na2SO4,加入盐酸酸化的BaCl2后可以产生白色沉淀,可以用来检验Na2SO3是否被氧化,C正确;含有醛基的物质可以与银氨溶液反应生成银单质,可以用来检验乙醇中混有的乙醛,D正确;故答案选A。
典例2 [2022·全国乙卷,9]某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:①溶于水,得到无色透明溶液;②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离;③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。该样品中确定存在的是( )A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
【对点演练】考向一 高考热点题型——操作、现象、结论的判断1.[2024·九省联考贵州卷,10]下列实验操作、现象和结论均正确的是( )
3.下列离子在未知溶液中的检验方法正确的是( )
请完成下列问题:(1)根据步骤①可知,一定不存在的离子是________。(2)步骤②发生反应的离子方程式为________________________________、________________________。(3)综合上述四步操作,无法确定是否存在的离子有____________。
Cl2+2Br-===Br2+2Cl-
答题规范① 离子检验操作现象描述【模型构建】
【模型认知】(NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。【查阅资料】 (NH4)2SO4在260 ℃和400 ℃时分解产物不同。【实验探究】 该小组拟选用下图所示装置进行实验(夹持和加热装置略)。
取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀,加入足量稀盐酸后,沉淀完全溶解,放出无色有刺激性气味的气体
解题思路 (1)叙述操作:取液体(水层少量液体)、加试剂(如加BaCl2溶液、加盐酸酸化等)。(2)描述现象:观察产生沉淀及沉淀如何变化,要明确具体。(3)得出结论:由什么现象得出对应结论,如“若……说明……,若……说明……”。
【规范精练】1.为了探究AgNO3的氧化性,某化学兴趣小组设计了如下实验:将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。请完成下表:
【实验结论】 Fe的氧化产物为Fe2+和Fe3+
K3[Fe(CN)6]溶液
解析:Fe3+遇KSCN溶液,溶液变血红色。由于氯水与Fe2+反应,现象不明显,应直接用K3[Fe(CN)6]溶液检验,若有蓝色沉淀出现,则证明Fe2+存在,否则不存在。
相关课件
这是一份新高考化学一轮复习课件第1章 第3讲 离子共存、离子检验与推断(含解析),共60页。PPT课件主要包含了离子共存的判断,离子的检验与推断,离子检验操作现象描述,典例剖析,规范精练,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份2025届高中化学全程复习构想课件全套03离子共存、离子检验与推断,共47页。PPT课件主要包含了考点一,考点二,①②③⑥,FeSCN3,答案B,不溶解,蓝色沉淀,蓝色钴玻璃,常见阴离子的检验,BaCl2溶液等内容,欢迎下载使用。
这是一份新高考化学一轮复习精品课件 第1章 第3讲 离子共存、离子检验与推断 (含解析),共60页。PPT课件主要包含了离子共存的判断,必备知识,关键能力,离子的检验与推断,离子检验操作现象描述,典例剖析,规范精练,真题演练明确考向,课时精练等内容,欢迎下载使用。









