






2025版高考化学全程一轮复习第26讲元素周期表元素的性质课件
展开
这是一份2025版高考化学全程一轮复习第26讲元素周期表元素的性质课件,共46页。PPT课件主要包含了考点一,考点二,ns1,ns2,ns2np1,ns2np2,ns2np3,ns2np4,ns2np5,ns2np6等内容,欢迎下载使用。
1.掌握元素周期表的编排原则和整体结构。2.掌握元素周期律的内容和本质。3.掌握元素的原子半径、金属性、非金属性、第一电离能、电负性等的变化规律。
1.元素周期表的编排原则(1)周期:把电子层数目相同的元素,按原子序数递增的顺序从左到右排成的横行。(2)族:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序从上而下排成的纵列。
2.原子结构与元素周期表的关系(1)原子结构与周期的关系原子的最大能层数=周期序数。(2)原子结构与族的关系①主族元素的价层电子排布特点②0族元素的价层电子排布:He为1s2;其他为________。③过渡元素(镧系、锕系元素除外)的价层电子排布:(n-1)d1~10ns1~2。
【师说·助学】 对元素周期表结构的两点说明①所含元素种类最多的族为ⅢB族(含有锕系、镧系),共有32种元素。②最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
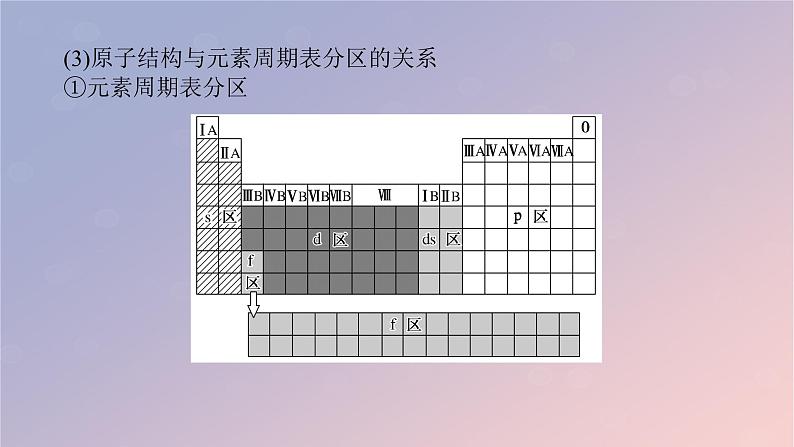
(3)原子结构与元素周期表分区的关系①元素周期表分区
②各区价层电子排布特点
(n-1)d1~9ns1~2
(4)金属与非金属的分界线①分界线:沿着元素周期表中铝、锗、锑、钋、钅立与硼、硅、砷、碲、砹、石田的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。③分界线附近元素的性质:既能表现出一定的金属性,又能表现出一定的非金属性。
3.元素周期表应用(1)科学预测:为新元素的发现及预测它们的原子结构和性质提供了线索。(2)寻找新材料
【易错诊断】 判断正误,错误的说明理由。1.价层电子排布式为4s24p3的元素位于第四周期第ⅤA族,是p区元素:___________________________________________________________。2.价层电子排布式为5s25p1的元素位于第五周期第ⅠA族,是s区元素:___________________________________________________________。3.所有非金属元素都分布在p区:___________________________________________________________。4.最外层有2个未成对电子的可能是ns2np2或ns2np4,短周期元素中分别为C、Si和O、S:___________________________________________________________。
错误。5s25p1的元素位于第五周期第ⅢA族,是p区元素。
错误。非金属元素氢元素分布在s区。
【教考衔接】典例 请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题:(1)标出族序数、周期序数。(2)将主族元素前六周期的元素符号补充完整。(3)画出金属与非金属的分界线,并用阴影表示出过渡元素的位置。(4)标出镧系、锕系的位置。(5)写出各周期元素的种类。(6)写出稀有气体元素的原子序数,标出113号~117号元素的位置。
【对点演练】1.某元素+3价离子的核外电子排布式为1s22s22p63s23p63d5,则该元素在元素周期表中的位置是( )A.第三周期第ⅧA族,p区B.第三周期第ⅤB族,ds区C.第四周期第Ⅷ族,d区D.第四周期第ⅤB族,f区
解析:该+3价离子的核外有23个电子,则基态原子核外有26个电子,26号元素是铁,其位于第4周期第Ⅷ族,电子排布式为1s22s22p63s23p63d64s2,位于d区。
2.根据元素周期表判断,下列叙述不正确的是( )A.周期表中第七周期最多容纳32种元素B.周期表中共有18个列,其中形成化合物种类最多的在第14列C.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等D.除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
解析:周期表中第七周期最多容纳32种元素,故A正确;C元素形成有机物的种类繁多,C位于第14列,周期表中共有18个列,故B正确;L层电子为奇数的所有元素,位于第二周期,最外层电子数等于族序数,则L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等,故C正确;He最外层电子数为2,第ⅡA族元素的最外层电子数为2,不在同一族中,故D错误。
3.确定下列指定元素的原子序数(1)甲、乙是元素周期表中同一周期的第ⅡA族和第ⅦA族元素,原子序数分别为m、n,则m、n的关系为___________________________________________________________。(2)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是___________________________________________________________。(3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为________________。
n=m+5、n=m+15、n=m+29
x+2、x+8、x+18、x+32
y=x+m或y=x+n
(4)下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是________(填字母)。
归纳总结同主族、邻周期元素原子序数差的关系(1)第ⅠA族元素,随电子层数的增加,原子序数依次相差2、8、8、18、18、32。(2)第ⅡA族元素,随电子层数的增加,原子序数依次相差8、8、18、18、32。(3)第ⅢA~ⅦA族元素,随电子层数的增加,原子序数依次相差8、18、18、32、32。(4)0族元素,随电子层数的增加,原子序数依次相差8、8、18、18、32、32。
1.电离能(1)含义:第一电离能:气态基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号:I1,单位:kJ·ml-1。(2)应用①判断元素金属性的强弱:电离能越小,金属越容易失去电子,金属性越强;反之金属性越弱。②判断元素的化合价:如果某元素的In+1≫In,则该元素的常见化合价为+n,如钠元素的I2≫I1,所以钠元素的化合价为+1。③判断核外电子的分层排布情况:多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
2.电负性(1)含义:不同元素的原子对键合电子吸引力的标度。元素的电负性越大,表示其原子对键合电子的吸引力越大。(2)标准:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,计算得出其他元素的电负性(稀有气体元素未计)。(3)判断元素的金属性、非金属性:金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
4.主族元素周期性变化规律
【易错诊断】 判断正误,错误的说明理由。1.元素的原子得电子越多,非金属性越强,失电子越多,金属性越强:___________________________________________________________。2.元素的氧化物对应的水化物酸性越强,非金属性越强,碱性越强,金属性越强:___________________________________________________________。3.元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱:___________________________________________________________。
错误。元素的非金属、金属性强弱与其对应原子得失电子数目多少无直接关系。
错误。应将“氧化物”改为“最高价氧化物”。
错误。元素气态氢化物的稳定性与其气态氢化物水溶液的酸性强弱无直接关系。
【教考衔接】典例1 [2022·江苏卷,3]工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是( )A.半径大小:r(Al3+)Wc.Z、W原子形成稀有气体电子构型的简单离子的半径:WY>X,故a错误;根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则电负性:Z>Y>X>W,故b正确;根据同电子层结构核多径小,则Z、W原子形成稀有气体电子构型的简单离子的半径:WF->Na+>Mg2+>Al3+。可归纳为电子层排布相同的离子,(表中位置)阴离子在阳离子前一周期,原子序数大的半径小,概括为“阴前阳下,序大径小”。
【对点演练】考向一 微粒半径大小比较1.比较下列微粒半径的大小(用“>”或“<”填空):(1)Si________N________F。(2)Li________Na________K。(3)Na+________Mg2+________Al3+。(4)F-________Cl-________Br-。(5)Cl-________O2-________Na+。(6)H-________Li+________H+。
2.A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-具有相同的电子层结构,下列叙述不正确的是( )A.原子序数:A>B>CB.原子半径:C>B>AC.离子半径:A2->C->B2+D.原子最外层电子数:C>A>B
解析:由题意可推出A为S、B为Mg、C为F。原子序数:S>Mg>F,故A项正确;不同周期元素,电子层数越多,原子半径越大,同一周期元素,核电荷数越大,原子半径越小,因此原子半径:Mg>S>F,故B项错误;S2-的电子层数为3,离子半径最大,Mg2+与F-的电子层数为2,且具有相同的核外电子数,核电荷数越大,离子半径越小,因此离子半径:S2->F->Mg2+,故C项正确;F原子最外层电子数为7,S原子最外层电子数为6,Mg原子最外层电子数为2,因此原子最外层电子数:F>S>Mg,故D项正确。
考向二 元素及其有关化合物的性质比较3.根据元素周期律比较下列各组性质(用“>”或“
相关课件
这是一份新高考化学一轮复习课件第6章 第31讲 元素周期表、元素的性质(含解析),共60页。PPT课件主要包含了等电子微粒的判断方法,规范精练,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份(人教版)高考化学一轮复习讲义课件第7章第32讲 元素周期表 元素的性质(含解析),共60页。PPT课件主要包含了电离能大小比较,练真题明考向,课时精练等内容,欢迎下载使用。
这是一份2025届高中化学全程复习构想课件全套26元素周期表、元素的性质,共47页。PPT课件主要包含了考点一,考点二,ns1,ns2,ns2np1,ns2np2,ns2np3,ns2np4,ns2np5,ns2np6等内容,欢迎下载使用。









