

所属成套资源:2025年高考化学 热点 重点 难点 专练(上海专用)
重难点13 化学工艺流程-2025年高考化学 热点 重点 难点 专练(上海专用)
展开
这是一份重难点13 化学工艺流程-2025年高考化学 热点 重点 难点 专练(上海专用),文件包含重难点13化学工艺流程-2025年高考化学热点重点难点专练上海专用原卷版docx、重难点13化学工艺流程-2025年高考化学热点重点难点专练上海专用解析版docx等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。
化学工艺流程题是将化工生产中的生产流程用框图形式表示出来,并根据生产流程中有关的化学知识步步设问,是无机框图的拓展创新。它以现代工业生产为基础,与化工生产成本、产品提纯、环境保护等相融合,考综合考查元素化合物知识、氧化还原反应(或复分解反应、电离、水解)方程式的书写、通过化工原理的分析判断流程中残渣或废液的成分、反应条件的控制与选择、物质分离提纯的方法、产率的计算、Ksp的应用、绿色化学思想的体现等,要求考生依据流程图分析原理,紧扣信息,抓住关键、准确答题。化工工艺流程题能有效考查考生的“变化观念与平衡思想、科学探究与创新意识及科学态度与社会责任”等化学学科核心素养。近五年来作为高考题的固定题型,此类题目往往取材于国际国内的化学期刊杂志,没有固定的物质制备或分离类型,情境新颖,在题干问题设置上注重逻辑,往往还有关联提问。重点考查化学基础知识和基本能力,特别是对物质制备方法、物质间的转化途径、混合物分离和除杂方法、化学实验基本操作方法、陌生情景中化学方程式或离子方程式的书写及简单计算能力的综合考查。预测在20253年的高考试题中会继续延续这种出题方式,更贴近工业生产(例如:会出现更多的工业术语和设备名称等),考查点会更加综合,可能会以陌生的新物质为背景,突出考查学生的能力,更加关注原料的选择、循环利用、绿色化学、环境保护、物质的分离提纯、产率的计算等。考查考生接受、吸收、整合化学信息的能力;分析问题和解决(解答)化学问题的能力。在解决化学问题的过程中,运用化学原理和科学方法,能设计合理方案,初步实践科学探究。
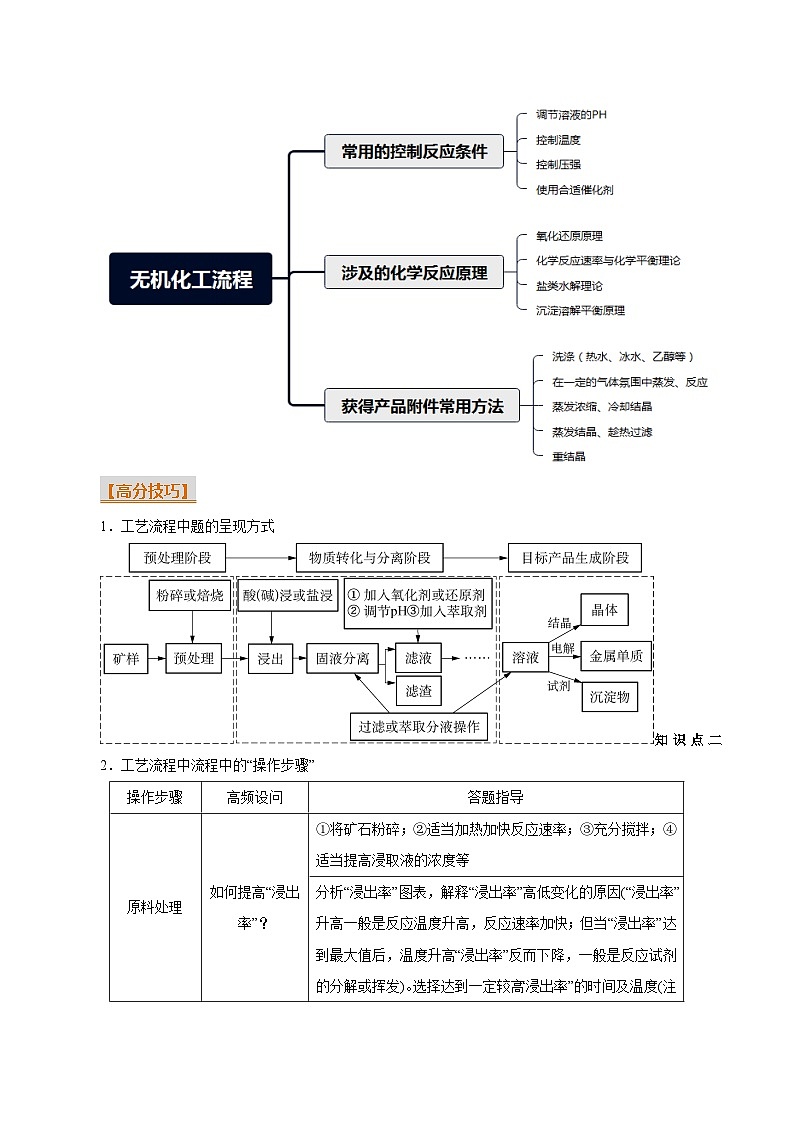
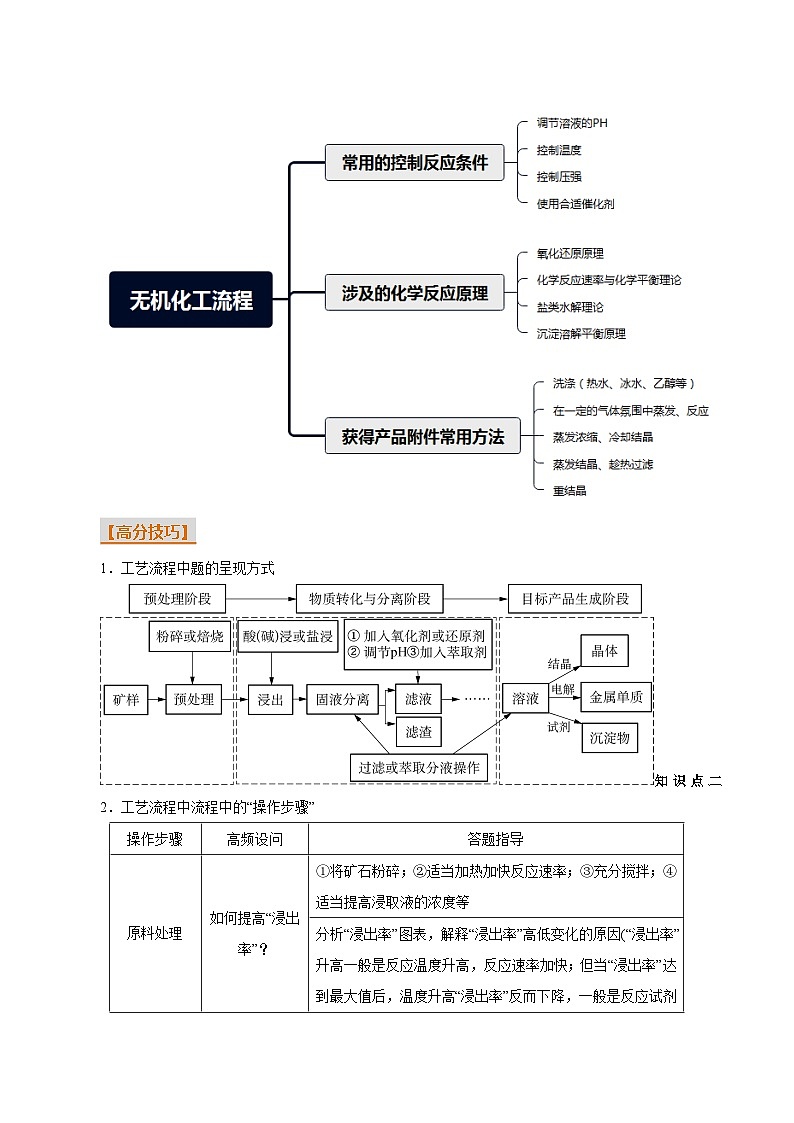
【思维导图】
【高分技巧】
1.工艺流程中题的呈现方式
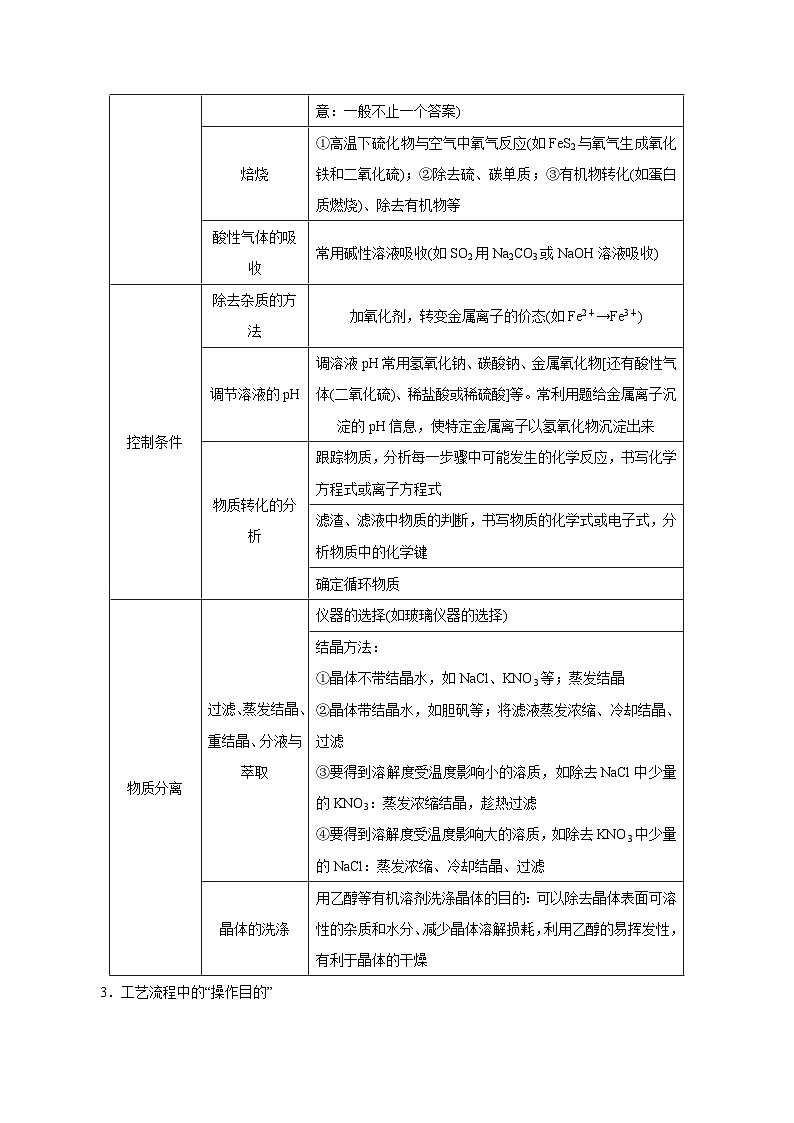
知识点二 2.工艺流程中流程中的“操作步骤”
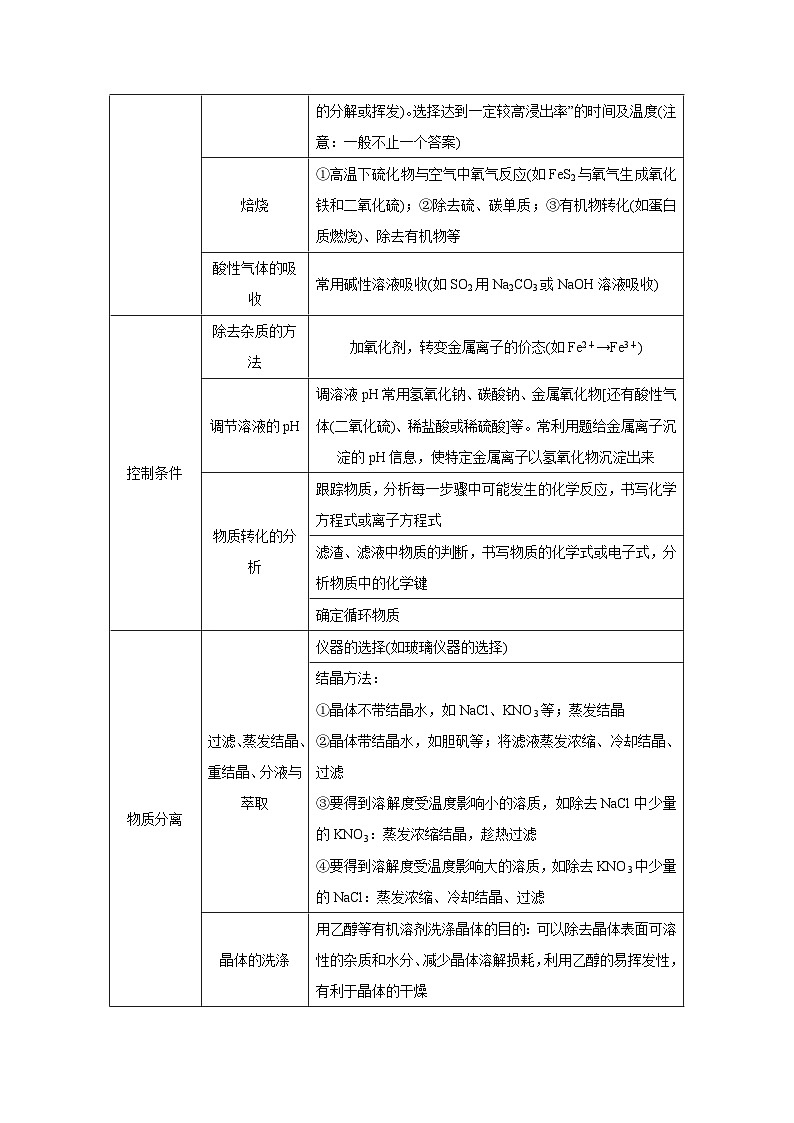
3.工艺流程中的“操作目的”
(建议用时:40分钟)
1.(2025·上海市实验学校高三上学期阶段测试)FeCl3溶液也可蚀刻铜电路板。以下是从FeCl3溶液蚀刻钢电路板的废液(主要成分为CuCl2、FeCl2和FeCl3)中回收FeCl2·4H2O并制备CuSO4·5H2O途径之一。
(1)向滤液A中加入少量铁粉,然后蒸发浓缩至 出现时,趁热过滤除去多余的铁粉,再将滤液 、过滤、洗涤,得到FeCl2·4H2O粗品。
(2)图中“②洗涤”时,检验铜表面Cl-已洗净的方法是 。铜与硝酸和硫酸的混酸反应制备CuSO4时,有红棕色气体生成,该气体是 (选填“氧化”或“还原”)产物。
【答案】(1) 少量晶体 冷却结晶
(2) 取少量最后一次洗涤液于试管中,加入硝酸酸化的AgNO3溶液,若无白色沉淀生成,则证明铜表面Cl-已洗涤干净 还原
【解析】废液的主要成分为CuCl2、FeCl2和FeCl3,加入过量铁粉,发生反应:Fe+2 FeCl3=3FeCl2、Fe+ CuCl2=FeCl2+ Cu,因此过滤后滤液A主要为FeCl2溶液,滤渣B中含有过量的铁和生成的铜;向滤液A中加入少量铁粉,可以防止Fe2+被氧化,最后经过处理得到FeCl2·4H2O晶体;滤渣B中加入过量稀盐酸,溶解铁粉后,过滤得到单质铜,洗涤后经过处理得到CuSO4·5H2O。(1)滤液A中加入少量铁粉,然后蒸发浓缩至少量晶体出现时,趁热过滤除去多余的铁粉,再将滤液冷却结晶、过滤、洗涤、干燥,可得到FeCl2·4H2O粗品。(2)Cl-可以和Ag+反应生成AgCl白色沉淀,因此取少量最后一次洗涤液于试管中,加入硝酸酸化的AgNO3溶液,若无白色沉淀生成,则证明铜表面Cl-已洗涤干净;铜与硝酸和硫酸的混酸反应制备CuSO4时,硝酸被还原生成红棕色气体NO2,则NO2为还原产物。
2.(2025·上海市华东师范大学第二附属中学高三模考试)粉煤灰是燃煤产生的工业固体废料,主要成分有Al2O3、SiO2,还含有少量Fe2O3、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
硫酸熟化过程中发生的反应有:
Al2O3∙2SiO2+3H2SO4=Al2(SO4)3+2SiO2+3H2O
3Al2O3∙2SiO2+9H2SO4=3Al2(SO4)3+2SiO2+9H2O
(1)“结晶”操作:缓缓加热,浓缩至 ,放置冷却,得到Al2(SO4)3∙18H2O。
(2) Al2(SO4)3∙18H2O在250~300℃下失重40.5%得Al2(SO4)3∙ x H2O,x= 。
(3)“还原焙烧”过程中发生反应的化学方程式为 。
(4)设计实验检验粗氧化铝中是否含有Fe2O3: 。
(5)向硅酸钠溶液中通入过量CO2制备白炭黑的化学方程式为 。
【答案】(1)表面出现结晶薄膜 (2)3
(3)2Al2(SO4)3+3C2Al2O3+3CO2↑+6SO2↑
(4)取粗氧化铝少许于试管中加稀硫酸溶解,静置,滴加KSCN溶液,若溶液变红,则粗氧化铝中含有Fe2O3杂质
(5)Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2∙nH2O↓
【解析】粉煤灰主要成分有Al2O3、SiO2,还含有少量Fe2O3、CaO等,加入浓硫酸反应生成硫酸铝,水浸主要得到SiO2高硅渣,滤液经过结晶脱水得到硫酸铝,硫酸铝与焦炭反应生成粗氧化铝;向硅酸钠溶液中通入足量二氧化碳反应生成碳酸氢钠和白炭黑SiO2∙nH2O。(1)“结晶”操作:缓缓加热,浓缩至表面出现结晶薄膜,放置冷却,得到Al2(SO4)3∙18H2O;(2)假设100gAl2(SO4)3∙18H2O在250 ~300℃下失重40.5%,剩余100g×(1−40.5%)=59.5g Al2(SO4)∙xH2O,,解得x=3;(3)根据“还原焙烧”产物之一经过烟气制酸,硫酸铝和碳“还原焙烧”生成氧化铝、二氧化碳和二氧化硫,发生反应的化学方程式为2Al2(SO4)3+3C2Al2O3+3CO2↑+6SO2↑;(4)实验检验粗氧化铝中是否含有Fe2O3,将粗品溶于稀硫酸中,静置,滴加KSCN溶液,若溶液变红,则粗氧化铝中含有Fe2O3杂质;(5)向硅酸钠溶液中通入过量CO2生成碳酸氢钠和白炭黑SiO2∙nH2O,其化学方程式为Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2∙nH2O↓。
3.(2025·上海市复旦大学附属中学高三上学期阶段性教学质量评估)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示
(1)酸浸、过滤后滤液中的主要成分是 ,滤渣是 。
(2)反应I的溶液为防止被氧化,需加入 ,反应I中发生的离子方程式为 。
(3)反应I的反应温度一般需控制在以下,其目的是 。
(4)空气中煅烧FeCO3生成产品b的化学反应方程式为 。
(5)实验室进行煅烧操作所需仪器除了酒精喷灯、三脚架、玻璃棒外,还有 。
(6)煅烧产生的烟气中存在大量含铁颗粒,将烟气通过电场可将颗粒物从气流中分离,移动到导电板上进行捕集,该过程称为_______。
A.电离B.渗析C.电泳D.聚沉
(7)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(8)检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液, 。
【答案】(1) FeSO4 (或FeSO4和H2SO4) SiO2
(2)少量铁粉 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
(3)防止NH4HCO3分解(或减少Fe2+的水解)
(4)4FeCO3+O22Fe2O3+4CO2
(5)坩埚、坩埚钳、泥三角 (6)C
(7)降低硫酸钾的溶解度,有利于硫酸钾析出
(8)滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液,若产生白色沉淀,则含有氯化物杂质
【解析】硫铁矿烧渣在高温焙烧时加入还原剂,Fe的氧化物被还原为Fe单质,加入硫酸后生成硫酸亚铁,过滤后得到的滤渣为二氧化硅;滤液中加入碳酸氢铵溶液,过滤得到碳酸亚铁固体,滤液中主要含有硫酸铵和过量的碳酸氢铵;洗涤、干燥FeCO3后在空气中煅烧得到Fe2O3,即产品b;滤液中加入稀硫酸除去过量的碳酸氢铵,再加入KCl,析出溶解度较小的硫酸钾,过滤得到硫酸钾(即产品a)和氯化铵溶液。(1)焙烧后的固体为Fe和SiO2的混合物,加入H2SO4,Fe与H2SO4反应生成FeSO4,如H2SO4过量,则滤液中还含有H2SO4,而SiO2不溶于稀H2SO4,所以过滤后的滤渣为SiO2。(2)为防止FeSO4溶液中Fe2+的氧化,加入少量铁粉可防止Fe2+氧化;发生反应I时,加入碳酸氢铵将二价铁离子转化为碳酸亚铁固体,即反应为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。(3)NH4HCO3不稳定,受热分解为NH3、H2O、CO2,如果温度过高会导致NH4HCO3分解,同时由于水解反应是吸热反应,温度越高水解速率越快,也会加快Fe2+的水解,这样会使原料利用率降低,因此一般控制在35℃以下,其目的是防止碳酸氢铵受热分解或减少Fe2+的水解。(4)FeCO3与O2在高温下反应生成了Fe2O3和CO2,反应方程式为:4FeCO3+O22Fe2O3+4CO2。(5)实验室进行煅烧操作所需仪器除了酒精喷灯、三脚架、玻璃棒外,还有坩埚、坩埚钳、泥三角。(6)通过电场将颗粒物从气流中分离并移动到导电板上进行捕集的过程称为静电除尘,胶体粒子为带电粒子,带电粒子在电场的作用下,向着与其电性相反的电极移动的现象,该过程称为电泳,故选C。(7)由题目看出在Ⅲ反应中生成的K2SO4为固体,而K2SO4在无机溶剂中溶解度比较大,在醇中溶解度较小,所以加入醇类溶剂目的:降低硫酸钾的溶解度,有利于硫酸钾析出。(8)产品a主要为K2SO4,为检验是否含有氯化物杂质,应加入AgNO3溶液,由于AgNO3溶液会与K2SO4反应产生Ag2SO4白色沉淀,为排除干扰,在加入AgNO3溶液之前应加入过量的Ba(NO3)2溶液,使硫酸根形成BaSO4沉淀,以除去硫酸根的干扰,过滤后再加入硝酸银溶液,即检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液,滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液,若产生白色沉淀,则含有氯化物杂质。
4.(2025·上海市上海中学东校高三上学期阶段性素质评估)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
(1)“酸浸”后所得溶液中含有的阳离子有 种。
(2)“氧化”步骤中,氧化剂A可选用 。(不定项)
A.浓H2SO4 B.Cl2 C.HNO3 D.H2O2
该步骤中检验Fe2+是否被完全氧化能否用KMnO4 (选填“是”或“否”),理由是 。
(3)“过滤”步骤中,试剂B的作用是__________。
A.提高溶液的pH B.降低溶液的pH C.使Fe3+完全沉淀D.使Cu2+完全沉淀
(4)“过滤”步骤,为提高产品纯度并减少原料损耗,应将溶液范围控制在 。
___________________。
(5)“过滤”步骤,要得到较纯的产品,试剂B可选用___________。
A.NaOHB.FeOC.CuOD.Fe2O3
(6)从滤液中得到晶体的步骤: →冷却结晶→过滤→ →低温烘干。
为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止、冷却、称量所得无水CuCl2的质量为。
方案二:称取mg晶体、加入足量NaOH溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为。
(7)试评价上述两种实验方案,其中正确的方案是 (选填“方案一”或“方案二”),据此计算得 (用含m、n的代数式表示)。
【答案】(1)3
(2) BD 否 溶液中有Cl-,也能使高锰酸钾溶液褪色
(3)AC (4)3.7≤pH<5.4 (5)C (6) 蒸发浓缩 洗涤
(7) 方案二
【解析】由题给流程可知,向含少量铁的氧化铜中加入盐酸酸浸,将金属元素转化为金属氯化物,先向溶液中通入氯气或加入过氧化氢溶液,将溶液中的亚铁离子转化为铁离子,再向溶液中加入氧化铜调节溶液pH在3.7≤pH<5.4的范围内,将溶液中的铁离子转化为氢氧化铁沉淀,过滤得到含有氢氧化铁的滤渣和氯化铜溶液;溶液经蒸发浓缩、冷却结晶、过滤、洗涤、低温烘干得到氯化铜晶体。(1)酸浸得到的溶液中含有氯化亚铁、氯化铜和过量的盐酸,阳离子为亚铁离子、铁离子和氢离子,共有3种;(2)向溶液中通入氯气或加入过氧化氢溶液,将溶液中的亚铁离子转化为铁离子,不选用浓硫酸和硝酸的原因是反应后会引入新杂质;溶液中的氯离子也能与酸性高锰酸钾溶液反应使溶液褪色,所以检验亚铁离子是否被完全氧化时,不能选用高锰酸钾溶液;(3)由分析可知,向溶液中加入氧化铜调节溶液pH在3.7≤pH<5.4的范围内的目的是提高溶液的pH,将溶液中的铁离子转化为氢氧化铁沉淀,故选AC;(4)由分析可知,向溶液中加入氧化铜调节溶液pH在3.7≤pH<5.4的范围内的目的是提高溶液的pH,将溶液中的铁离子转化为氢氧化铁沉淀,而铜离子不转化为氢氧化铜沉淀;(5)向溶液中加入氧化铜调节溶液pH在3.7≤pH<5.4的范围内的目的是提高溶液的pH,将溶液中的铁离子转化为氢氧化铁沉淀,而铜离子不转化为氢氧化铜沉淀,不选用氢氧化钠溶液的原因是会引入新杂质,故选C;(6)氯化铜溶液经蒸发浓缩、冷却结晶、过滤、洗涤、低温烘干得到氯化铜晶体;(7)氯化铜是强酸弱碱盐,在溶液中会发生水解生成氢氧化铜和盐酸,直接灼烧氯化铜晶体会因氯化氢挥发导致水解趋于完全得到氢氧化铜,氢氧化铜分解生成氧化铜,无法测得x值,所以正确方案为方案二;由题意可得如下转化关系:(CuCl2·xH2O)—CuO,由题给数据可得:(135+18x):80=m:n,解得x=。
5.(2025·上海市位育中学高三上学期阶段测试)锗在芯片制造领域应用广泛,与镓共同被誉为“芯片新粮食”,锗的出口也因此被许多国家限制,成为了一种重要的战略性金属。所以锗及其化合物的提取技术变得尤为重要。以下是一种用锌浸渣(主要含ZnFe2O4、CaSO4,另含少量ZnS、SiO2以及GeS2)提取高纯GeO2和ZnSO4·H2O的工艺流程:
已知:①常温下,Ksp[Fe(OH)3 ]= 4×10-38,Ksp[Ge (OH)4 ]= 4×10-46。
②GeCl4极易水解,沸点为86.6℃。
请回答下列问题:
(1) GeCl4的晶体类型为___________。
A.共价晶体B.离子晶体C.分子晶体D.金属晶体
(2)“中和沉淀”中,化合物A为 (填化学式),调节溶液使Ge和Fe共沉淀,此时滤液中 。
(3)“中和沉淀”后,用蒸馏水多次洗涤滤饼,判断滤饼洗净的实验操作和现象是 。
(4)称取4g高纯GeO2样品,加入NaOH溶液,用电炉加热溶解。溶解完全后冷却至20℃以下,加入次磷酸钠(Na2HPO2)溶液充分反应,溶液中锗元素以Ge2+存在。加入适量稀硫酸将溶液pH调为酸性,以淀粉为指示剂,用0.500ml·L-1KIO3标准溶液滴定,消耗KIO3溶液的体积为25.00mL。
已知:
a.20℃以下,次磷酸钠不会被KIO3和I2氧化;
b.3Ge2++IO3-+6H+=3Ge4++I-+3H2O;
c.样品中的杂质不参与反应。
①滴定终点的现象为 。
②样品中GeO2的纯度为 %(保留2位小数)。
(5)制得的GeO2有不同的晶型,α-GeO2和β-GeO2在一定条件下可以互变,测定其属于哪种晶型最常用的仪器为___________。
A.核磁共振仪B.X射线衍射仪C.红外光谱仪D.质谱仪
(6) GeO2与碱反应可生成锗酸盐,其中CaGeO3是一种难溶电解质,一定温度下,CaGeO3在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________。(不定项)
A.n点与p点对应的Ksp相等
B.q点无CaGeO3沉淀生成
C.通过蒸发可以使溶液由q点变到p点
D.加入Na2GeO3可以使溶液由n点变到m点
【答案】(1)C (2) ZnO或Zn(OH)2 1.2
(3)取最后一次洗涤液于试管中,加入BaCl2溶液,若未产生白色沉淀,则证明已洗净
(4) 滴入最后半滴标准液,溶液由无色变为蓝色,且30s内不褪色 98.44
(5)B (6)AB
【解析】由题给流程可知,向锌浸渣中加入过氧化氢和硫酸的混合溶液,将ZnFe2O4转化为硫酸锌、硫酸铁,硫化锌,二硫化锗转化为硫酸锌、硫酸锗和硫,二氧化硅不反应,过滤得到含有硫酸钙、二氧化硅和硫的滤渣和滤液;向滤液中加入化合物A,根据不引入新的杂质可知A可以为氧化锌或氢氧化锌调节溶液pH,将溶液中的铁离子、锗离子转化为氢氧化铁、氢氧化锗沉淀,过滤得到滤液和滤饼;滤液经蒸发浓缩、趁热过滤、洗涤、干燥得到一水硫酸锌晶体;向滤饼中加入盐酸溶解后,蒸馏得到四氯化锗,四氧化锗一定条件下水解、过滤得到水解液和二氧化锗。(1)GeCl4沸点为86.6℃,不高,GeCl4的晶体类型为分子晶体,故选C;(2)根据分析可知,向滤液中加入化合物A的目的是为了调节溶液pH,将溶液中的铁离子、锗离子转化为氢氧化铁、氢氧化锗沉淀,根据不引入新的杂质,所以A可以为氧化锌或氢氧化锌;由溶度积可知,,所以;(3)沉淀上面附着的杂质主要是硫酸锌,检验滤饼是否洗净可以检验是否还含有硫酸根,检验操作为取最后一次洗涤液,加入BaCl2溶液,若未产生白色沉淀,则证明已洗净;(4)根据已知,碘酸根和Ge2+反应生成碘离子,当Ge2+反应完,碘酸根就会和生成的I-反应得到碘单质遇溶液中淀粉变蓝,故滴定终点现象为,当最后半滴标准溶液滴下时,溶液由无色变为蓝色,且30s内不褪色;根据所给反应,故样品中GeO2的纯度为;(5)区分晶体与非晶体的科学方法是X射线衍射法,采用的仪器是X射线衍射仪;故选B;(6)A项,Ksp只受温度影响,温度不变则Ksp不变,n点与p点对应温度相同,则Ksp相等,故A正确;B项,q点离子积小于Ksp,无CaGeO3沉淀生成,故B正确;C项,蒸发过程中溶剂损失,溶液中c(Ca2+)、c(GeO32-)浓度均增大,因此通过蒸发不能使溶液由q点变到p点,故C错误;D项,加入Na2GeO3,可使c((GeO32-)浓度增大,同时c(Ca2+)减小,故D错误;故选AB。
6.(2025·上海市长岛中学高三上学期期中考试)磷酸铁(FePO4)可用来制备锂离子电池的电极材料,工业上以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料,制备磷酸亚铁锂(LiFePO4),流程如下图所示:
(1)“焙烧”前需将硫铁矿粉碎,目的是 。
(2)下列物质适合做“氧化”过程的氧化剂的是_________。
A.过氧化氢B.高锰酸钾C.硝酸D.次氯酸
(3)在生成磷酸铁沉淀时,滴加氨水时的控制是关键。如果,沉淀不完全,影响产量;如果,则可能存在的问题是 。
(4)工业制氨气的化学反应方程式为 。
(5)已知:。。若滤液1中含、,为了使完全沉淀(即离子浓度)且Fe2+不沉淀,应控制的范围为 。
(6)iFePO4制备LiFePO4的化学方程式,并用单线桥标出电子转移方向和数目 。
。
(7)可用0.100ml·L-1的酸性K2Cr2O7溶液滴定Fe2+,测定产品LiFePO4的纯度。离子反应方程式为:6 Fe2++Cr2O72-+14H+=6 Fe3++2Cr3++7H2O。
实验步骤:①称量LiFePO4样品,用稀硫酸溶解;
②将溶解后的溶液稀释为;
③量取溶液,滴加2~3滴指示剂;
④用K2Cr2O7标准溶液滴定,3次重复实验平均消耗K2Cr2O7溶液。
请回答下列问题
①实验中需要的定量仪器除天平外,还有 。
②产品LiFePO4的纯度为 。
③若实验测得的产品纯度偏低,可能原因是 。
A.稀硫酸溶解样品时有少量液体溅出 B.稀释时溶液中部分Fe2+被空气中氧气氧化
C.滴定管装入K2Cr2O7标准前未润洗 D.滴定前,锥形瓶中有少量蒸馏水
【答案】(1)增大矿粉与空气的接触面积,加快焙烧速率择性 (2)A
(3)可能生成Fe(OH)3沉淀
(4) 2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
(5)4.7≤pHKsp(FePO4) ,生成FePO4沉淀;(5)提锂后的废渣主要含FePO4、Fe3(PO4)2,当全部转化为FePO4时,Fe3+是过量的,过滤得到电池级FePO4后,滤液中主要的金属阳离子有Fe3+,故选B;(6)加入 HgCl2饱和溶液,发生反应4Cl-+Sn2++2HgCl2= SnCl62-+Hg2Cl2,据此推测其作用是将溶液中过量的 Sn2+转化为稳定的络离子SnCl62-,防止干扰Fe2+的测定;(7)根据滴定反应的方程式可得关系式6Fe2+~Cr2O72-,则有n(Fe2+)=6n(Cr2O72-)=6×0.030 ml/L×50.00×10-3L=9×10-3ml,m(Fe)=9×10-3ml×56 g•ml-1=0.504g,故铁的百分含量。
8.(2025·上海市崇明区高三下学期学业质量调研)碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是一种重要的无机化工产品。一种由白云石【主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等】为原料制备碱式碳酸镁的实验流程如下:
(1)常温常压下,“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
应控制“碳化”终点pH约为 ,钙元素的主要存在形式是 (填化学式)。
(2)“热解”生成碱式碳酸镁的化学方程式为 。
(3)该工艺为达到清洁生产,可以循环利用的物质是 (填化学式)。
【答案】(1) 9.0 CaCO3
(2)5Mg(HCO3)2=4MgCO3·Mg(OH)2·4H2O+6CO2↑
(3)CO2
【解析】白云石[主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等]在高温下焙烧,其中CaMg(CO3)2分解生成CaO、MgO和CO2,再加水“消化”,其中MgO、CaO均与水反应生成Mg(OH)2和Ca(OH)2,经过滤除去SiO2、Fe2O3等残渣,再向所得溶液中通入CO2气体进行碳化,使得Mg(OH)2转化为可溶的Mg(HCO3)2,经过滤除去CaCO3,将所得Mg(HCO3)2溶液加热并控制温度95∼100℃即得到碱式碳酸镁,最后过滤并洗涤得到产品。(1)由图象可知,应控制“碳化”终点pH约为9.0,这时碱式碳酸镁产率较高,而CaO含量较低;煅烧产物CaO和MgO都可与水反应生成Ca(OH)2和Mg(OH)2,结合产物的要求,所以“碳化”时发生的主要反应有Mg(OH)2+2CO2=Mg(HCO3)2 和Ca(OH)2+CO2= CaCO3↓+H2O,钙元素存在的主要形式为CaCO3;(2)由Mg(HCO3)2受热分解生成碱式碳酸镁的化学方程式为5Mg(HCO3)2=4MgCO3·Mg(OH)2·4H2O+6CO2↑;(3)由流程图可知,可循环利用的物质有CO2。
9.(2024·上海市育才中学高三下学期第一次教学质量检测调研)钼(M)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和MS2形式存在,从镍钼矿中分离钼,并得到Na2SO4的一种工艺流程。
已知“浸取”过程中发生如下反应:
(1)位于元素周期表第 周期第 族。
(2)“焙烧”中生成,Na2MO4的反应如下所示,请配平该化学方程式 。
上述反应中共价化合物的中心原子杂化方式是 杂化。
(3)下列说法正确的是________。(不定项)
A.电负性:B.离子半径:
C.第一电离能:D.基态的简化电子排布式
Na2CO3用量对钼浸出率和浸取液中CO32-浓度的影响如左下图所示,Na2MO4、Na2SO4的溶解度曲线如右下图所示。
(4)分析实际生产中选择用量为理论用量1.2倍的原因是: 。
(5)为充分分离Na2SO4,工艺流程中的“操作”应为________。
A.蒸发结晶B.低温结晶C.蒸馏D.萃取
(6) (NH4)2MO4中存在的相互作用有________。
A.分子间作用力B.金属键C.共价键D.离子键
(7) (NH4)2MO4分解可得MO3。高温下,用铝粉还原MO3得到金属钼的化学方程式为: 。
【答案】(1) 四 VIII
(2) 2MS2+6Na2CO3+9O2=2Na2MO4+6CO2+4Na2SO4 sp
(3)D
(4)若高于1.2倍,会导致净化过程消耗过多的硫酸镁,若低于1.2倍,钼浸出率较低
(5)B (6)CD (7) 2Al+MO3Al2O3+M
【解析】镍钼矿与碳酸钠、通空气焙烧后,加水浸取得到含NiO的浸渣,滤液中含Na2MO4、Na2SO4等,加入MgSO4净化后,滤液进行操作X得到Na2SO4,溶液进行离子交换萃取得到交换溶液,最后萃取液经系列操作得(NH4)2MO4。(1)Ni元素在元素周期表中位于第四周期第Ⅷ族。(2)反应MS2+Na2CO3+O2→Na2MO4+CO2+Na2SO4中M元素的化合价由+4价升至+6价、S元素的化合价由-2价升至+6价,1mlMS2参与反应失去18ml电子,1mlO2得到4ml电子,根据得失电子守恒和原子守恒,配平后的方程式为2MS2+6Na2CO3+9O2=2Na2MO4+6CO2+4Na2SO4;该反应中的共价化合物为CO2,CO2中中心碳原子的价层电子对数为2+×(4-2×2)=2,C采取sp杂化。(3)A项,同周期从左到右主族元素的电负性逐渐增大,同主族从上到下电负性逐渐减小,元素的非金属性越强、电负性越大,则电负性:O>S>C,A项错误;B项,根据“层多径大、序大径小”,离子半径:Na+<O2-<S2-,B项错误;C项,同周期从左到右主族元素的第一电离能呈增大趋势,第ⅡA、ⅤA族大于相邻元素,同主族从上到下元素的第一电离能逐渐减小,则第一电离能:Na<O<N,C项错误;D项,基态Ni的简化电子排布式为[Ar]3d84s2,基态Ni2+的简化电子排布式为[Ar]3d8,D项正确;答案选D。(4)若高于1.2倍,会导致净化过程消耗过多的硫酸镁,由图可知,若低于1.2倍,钼浸出率较低,故实际生产中选择碳酸钠用量为理论用量1.2倍。(5)由Na2MO4和Na2SO4的溶解度曲线可知,为充分分离Na2SO4,工艺流程中的“操作X”应为低温结晶,答案选B。(6)(NH4)2MO4中NH4+与MO42-之间为离子键,NH4+中N与H、MO42-中M与O之间为共价键,答案选CD。(7)Al与MO3发生铝热反应生成Al2O3和M,反应的化学方程式为2Al+MO3Al2O3+M。
10.(2024·上海市曹杨第二中学高三下学期等级考模拟)处理并利用硫酸尾气NOx制备工业原料亚硝酸钠和硝酸钠的工艺如下:
(1)在一定的气体流速下,碱液吸收时,富“NO2”尾气中的NO、NO2含量与吸收度的关系如图所示,由图可知,最合适的NO含量应为 ,过高和过低都不利于NOx的吸收,其原因是 。
(2)富“NO2”尾气应从吸收塔的___________部通入。
A.顶部B.上部C.中部D.底部
(3)在30℃时进行碱液吸收NOx的反应,此时NaOH的浓度控制在22%~25%最佳,NaOH浓度不宜过高的原因是 。
(4)在分离池中分离出NaNO2的操作为:蒸发浓缩、___________、过滤洗涤。
A.冷却结晶B.趁热过滤C.蒸发至干D.重结晶
(5)转化池中加入硝酸用于除杂,同时产生NO,其发生的离子反应方程式为 。在转化池内通常需要一定量的空气,其作用是 。
A.减少氮氧化物二次污染 B. 除去溶液中的杂质
C.有利于产品的分离 D. 节省HNO3的用量
(6)已知硝酸尾气中NOx的总含量为6.2×10-3ml/m3,气体流速为1268m3/h,经该吸收工艺后,排出气体中NOx的总含量降低为5.0×10-4ml/m3,则每小时至少需要质量分数为25%的NaOH溶液(密度为1.04g/cm3) m3(保留2位有效数字)。
【答案】(1) 50% 过高吸收效果降低,过低吸收速率减慢
(2)D (3)浓度过高不利于NO2的溶解 (4)D
(5) 3NO2-+2H+=2NO+NO3-+H2O ACD (6)1.1×10-3
【解析】硝酸尾气与富氧空气混合,配制富NO2尾气,利用NaOH吸收,吸收后再分离池中将NaNO2分离出,在转化池中加入硝酸,得硝酸钠。(1)如图所示,最合适的NO含量应为50%,因为过高吸收效果降低,过低吸收速率减慢;(2)NaOH溶液从吸收塔从上而下喷洒,富“NO2”尾气应从吸收塔的底部通入;(3)NaOH的浓度控制在22%~25%最佳,NaOH浓度不宜过高的原因:浓度过高不利于NO2的溶解;(4)在分离池中分离出NaNO2的操作:蒸发浓缩、重结晶、过滤洗涤;(5)转化池中加入硝酸与亚硝酸根离子作用生成NO,离子方程式:3NO2-+2H+=2NO+NO3-+H2O;A项,生成的NO与空气中氧气反应可在溶液中形成硝酸,可减少氮氧化物二次污染,A正确;B项,生成的NO与空气中氧气反应可在溶液中形成硝酸,不能起到除杂作用,B错误;C项,生成的NO与空气中氧气反应可生成二氧化氮,与NaOH反应生成硝酸钠和亚硝酸钠,有利于产品的分离,C正确;D项,生成的NO与空气中氧气反应可在溶液中形成硝酸,节省HNO3的用量,D正确;(6)假设每小时至少需要质量分数为25%的NaOH溶液为Vm3,则列等式:,解得。
操作步骤
高频设问
答题指导
原料处理
如何提高“浸出率”?
①将矿石粉碎;②适当加热加快反应速率;③充分搅拌;④适当提高浸取液的浓度等
分析“浸出率”图表,解释“浸出率”高低变化的原因(“浸出率”升高一般是反应温度升高,反应速率加快;但当“浸出率”达到最大值后,温度升高“浸出率”反而下降,一般是反应试剂的分解或挥发)。选择达到一定较高“浸出率”的时间及温度(注意:一般不止一个答案)
焙烧
①高温下硫化物与空气中氧气反应(如FeS2与氧气生成氧化铁和二氧化硫);②除去硫、碳单质;③有机物转化(如蛋白质燃烧)、除去有机物等
酸性气体的吸收
常用碱性溶液吸收(如SO2用Na2CO3或NaOH溶液吸收)
控制条件
除去杂质的方法
加氧化剂,转变金属离子的价态(如Fe2+→Fe3+)
调节溶液的pH
调溶液pH常用氢氧化钠、碳酸钠、金属氧化物[还有酸性气体(二氧化硫)、稀盐酸或稀硫酸]等。常利用题给金属离子沉淀的pH信息,使特定金属离子以氢氧化物沉淀出来
物质转化的分析
跟踪物质,分析每一步骤中可能发生的化学反应,书写化学方程式或离子方程式
滤渣、滤液中物质的判断,书写物质的化学式或电子式,分析物质中的化学键
确定循环物质
物质分离
过滤、蒸发结晶、重结晶、分液与萃取
仪器的选择(如玻璃仪器的选择)
结晶方法:
①晶体不带结晶水,如NaCl、KNO3等;蒸发结晶
②晶体带结晶水,如胆矾等;将滤液蒸发浓缩、冷却结晶、过滤
③要得到溶解度受温度影响小的溶质,如除去NaCl中少量的KNO3:蒸发浓缩结晶,趁热过滤
④要得到溶解度受温度影响大的溶质,如除去KNO3中少量的NaCl:蒸发浓缩、冷却结晶、过滤
晶体的洗涤
用乙醇等有机溶剂洗涤晶体的目的:可以除去晶体表面可溶性的杂质和水分、减少晶体溶解损耗,利用乙醇的易挥发性,有利于晶体的干燥
操作目的
答题指导
固体原料进行“粉碎”
减小颗粒直径,增大浸取时的反应速率,提高浸取率
酸(或碱)溶
①原料经酸(或碱)溶后转变成可溶物进入溶液中,以达到与难溶物分离的目的
②用碱性溶液吸收酸性气体原料
灼烧(焙烧)
①除去硫、碳单质;②有机物转化、除去有机物;③高温下原料与空气中氧气反应等
金属用热碳酸钠溶液洗涤
除去金属表面的油污
过滤
固体与液体的分离;要分清楚需要的物质在滤液中还是在滤渣中。滤渣是难溶于水的物质,如SiO2、PbSO4、难溶的金属氢氧化物和碳酸盐等
萃取与分液
选用合适的萃取剂(如四氯化碳、金属萃取剂),萃取后, 静置、分液——将分液漏斗玻璃塞的凹槽与分液漏斗口的小孔对准。下层液体从下口放出,上层液体从上口倒出
加入氧化剂(或还原剂)
①转化为目标产物的价态
②除去杂质离子(如把Fe2+氧化成Fe3+,而后调溶液的pH,使其转化为Fe(OH)3沉淀除去)
加入沉淀剂
①生成硫化物沉淀(如加入硫化钠、硫化铵、硫化亚铁等)
②加入可溶性碳酸盐,生成碳酸盐沉淀
③加入氟化钠,除去Ca2+、Mg2+
判断能否加其他物质
要考虑是否引入杂质(或影响产物的纯度)等
在空气中或在其他气体中进行的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应;能否达到隔绝空气、防氧化、防水解、防潮解等目的
调溶液pH
①生成金属氢氧化物,以达到除去金属离子的目的
②抑制盐类水解
③促进盐类水解生成沉淀,有利于过滤分离
④用pH计测量溶液的pH
⑤用pH试纸测定溶液的pH:将一小块pH试纸放在洁净干燥的玻璃片或表面皿上,用洁净的玻璃棒蘸取少量待测液点在pH试纸的中部,待试纸变色后再与标准比色卡对照读数
控制温度
①控制物质的溶解与结晶
②防止某些物质分解或挥发(如H2O2、氨水、草酸)
③控制反应速率、使催化剂达到最大活性、防止副反应的发生
④控制化学反应的方向,使化学平衡移动
⑤煮沸:促进溶液中的气体(如氧气)挥发逸出
⑥趁热过滤:减少因降温而析出的溶质的量
洗涤晶体
洗涤试剂
适用范围
目的
蒸馏水
冷水
产物不溶于水
除去固体表面吸附着的××杂质;可适当降低固体因为溶解而造成的损失
热水
有特殊的物质其溶解度随着温度升高而下降
除去固体表面吸附着的××杂质;可适当降低固体因为温度变化溶解而造成的损失
有机溶剂(酒精、丙酮等)
固体易溶于水、难溶于有机溶剂
减少固体溶解;利用有机溶剂的挥发性除去固体表面的水分,产品易干燥
饱和溶液
对纯度要求不高的产品
减少固体溶解
酸、碱溶液
产物不溶于酸、碱
除去固体表面吸附着的可溶于酸、碱的杂质;减少固体溶解
洗涤沉淀方法:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次
提高原子利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
pH
Fe(OH)3
Cu(OH)2
Fe(OH)3 2
开始沉淀
2.7
5.4
8.1
沉淀完全
3.7
6.9
9.6
相关试卷
这是一份重难点16 化学实验综合题-2025年高考化学 热点 重点 难点 专练(上海专用),文件包含重难点16化学实验综合题-2025年高考化学热点重点难点专练上海专用原卷版docx、重难点16化学实验综合题-2025年高考化学热点重点难点专练上海专用解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
这是一份重难点14 化学反应原理综合题-2025年高考化学 热点 重点 难点 专练(上海专用),文件包含重难点14化学反应原理综合题-2025年高考化学热点重点难点专练上海专用原卷版docx、重难点14化学反应原理综合题-2025年高考化学热点重点难点专练上海专用解析版docx等2份试卷配套教学资源,其中试卷共43页, 欢迎下载使用。
这是一份重难点07 化学实验基础-2025年高考化学 热点 重点 难点 专练(浙江专用),文件包含重难点07化学实验基础-2025年高考化学热点重点难点专练浙江专用原卷版docx、重难点07化学实验基础-2025年高考化学热点重点难点专练浙江专用解析版docx等2份试卷配套教学资源,其中试卷共77页, 欢迎下载使用。









