


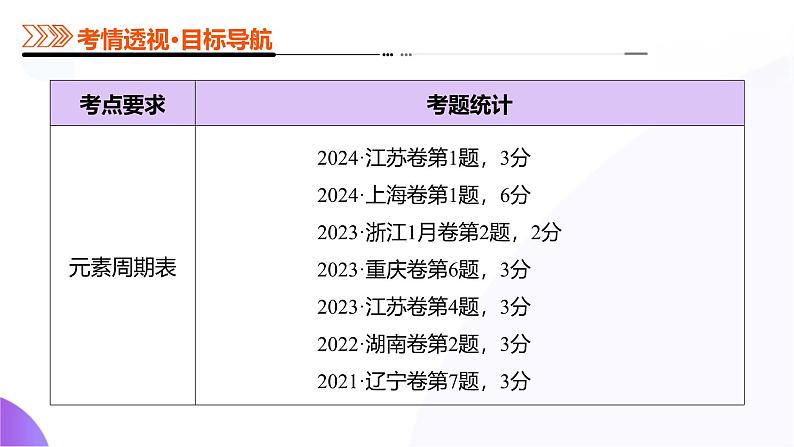
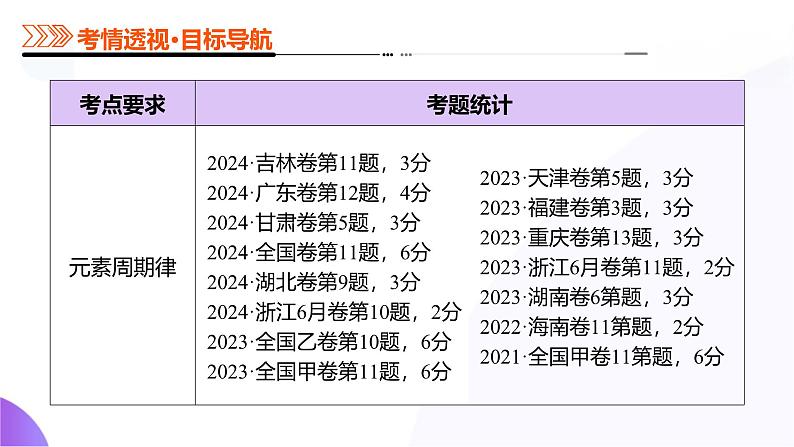



所属成套资源:【高考二轮】2025年高考化学二轮复习课件PPT
第五部分 第01讲 元素周期表、元素周期律(课件)-2025年高考化学二轮复习课件ppt
展开
这是一份第五部分 第01讲 元素周期表、元素周期律(课件)-2025年高考化学二轮复习课件ppt,共60页。PPT课件主要包含了第01讲,考情透视,知识导图,考点突破,真题练习,考点一,元素周期表,考点二,元素周期律,知识点1元素周期律等内容,欢迎下载使用。
元素周期表、元素周期律
考向1 元素周期表的结构考向2 元素周期表的应用
考向1 金属性和非金属性相关的递变考向2 原子半径、离子半径相关的递变考向3 第一电离能、电负性相关的递变考向4 位、构、性关系的综合判断
考向1 元素周期表的结构
考向2 元素周期表的应用
知识点1 元素周期表的结构
周期:把电子层数______的元素,按原子序数______的顺序,从________ 排成的______行。
(2) 族:把最外层电子数______的元素,按电子层数_____的顺序,从______ 排成的纵行。
3. 元素周期表的结构
族(18个纵列,16个族)
(1) 周期 (7个横行,7个周期)
(2) 族(18个纵列,16个族)
(1) 碱金属元素位于ⅠA族,氢元素不属于碱金属元素。
(3) 根据元素周期表的构成特点,可分析每个族的元素种类,含元素种类最多 的族是_____族(含有____系、____系元素),共有____种元素。
(4) 过渡元素包括7个副族和第Ⅷ族,全部是______元素,原子最外层电子数 不超过_____个(________个)。
(5) 最外层电子数为3~7个的原子一定属于______元素,且最外层电子数即 为主族的________。
(6) 电子层数=________数,主族序数=________数。
① 按价层电子排布分区(一)
说明:各区价层电子排布特点
② 根据元素的金属性与非金属性分区(二)
① 过渡元素:元素周期表中从ⅢB族到ⅡB族10个纵列元素,都是______元素。
② 镧系:元素周期表第6周期第ⅢB族中,57号元素镧到71号元素镥共____种元素。
③ 锕系:元素周期表第7周期第ⅢB族中,89号元素锕到103号元素铹共____种元素。
(4) 元素周期表中的特殊位置
根据元素周期表中的位置寻找未知元素
知识点2 周期表的应用
预测元素的性质(由递变规律推测)
① 比较不同周期、不同主族元素的性质。如:金属性:Mg>Al、Ca>Mg,则碱性:Mg(OH)2 Al(OH)3 、Ca(OH)2 Mg(OH)2,则Ca(OH)2 Al(OH)3 (填“>”“<” 或“=”)。
启发人们在一定区域内寻找新物质
① 半导体元素在金属与非金属分界线附近,如:Si、Ge、Ga等。② 农药中常用元素在右上方,如:F、Cl、S、P、As等。
【例1】(2024⋅山东·模拟预测) “嫦娥石”是中国首次在月球上发现的新矿物,其主要由??、??、P、O和?(钇,原子序数比??大13)组成。下列说法正确的是 ( )
元素周期表结构巧记口诀:
横行叫周期,现有一至七,四长三个短,全部已填满。纵列称为族,共有十六族,一八依次现①,一零再一遍②。一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
A. 第三周期元素中第一电离能介于??和??之间的元素有1种B. 上述元素位于d区的有3种C. 基态??原子最外层电子的电子云轮廓图:D. 基态??原子的价层电子轨道表示式为:
【例2】(23-24高三上·江苏徐州·阶段考试)CrSi、??−GaAs、ZnGeAs2和 SiC 都是重要的半导体化合物,下列说法错误的是 ( )
元素周期表在生产方面的应用表现在以下几个方面:
③ 催化剂的选择:人们在长期的生产实践中,已发现过渡元素对许多 化学反应有良好的催化性能。
④ 耐高温、耐腐蚀的特种合金材料的制取:在周期表里从ⅢB到ⅣB的过 渡元素,如钛、钽、钼、钨、铬,具有耐高温、耐腐蚀等特点。它们 是制作特种合金的优良材料,是制造火箭、导弹、宇宙飞船、飞机、 坦克等的不可缺少的金属。
元素周期表在生产方面的应用表现在以下几个方面:
⑤ 矿物的寻找:地球上化学元素的分布跟它们在元素周期表里的位置有 密切的联系。科学实验发现如下规律:相对原子质量较小的元素在地 壳中含量较多,相对原子质量较大的元素在地壳中含量较少;偶数原子 序数的元素较多,奇数原子序数的元素较少。处于地球表面的元素多数 呈现高价,处于岩石深处的元素多数呈现低价;碱金属一般是强烈的 亲石元素,主要富集于岩石圈的最上部;熔点、离子半径、电负性大小 相近的元素往往共生在一起,同处于一种矿石中。
1. 内容: 元素的性质随着__________的递增而呈周期性变化。
3. 主族元素的周期性变化规律
2. 实质: 元素性质的周期性变化是______________周期性变化的必然结果。
4. 元素金属性和非金属性强弱的判断方法
1. 第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的 __________。符号:___,单位:__________。
2. 规律① 同周期:第一种元素的第一电离能______,最后一种元素的第一电离能______, 从左到右总体呈现__________的变化趋势。
1. 含义:元素的原子______________能力的标度。元素的电负性越大,表示其原子 ______________的能力越____。
2. 标准:以最活泼的非金属元素氟的电负性为_____作为相对标准,计算得出其他 元素的电负性(稀有气体未计)。
3. 变化规律① 金属元素的电负性一般______1.8,非金属元素的电负性一般______1.8,而位于 非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。② 在元素周期表中,同周期从左到右,元素的电负性逐渐______,同主族从上到下, 元素的电负性逐渐______。
4. 电负性的三大应用① 判断元素金属性与非金属性的强弱:金属元素的电负性一般______1.8,金属元素 的电负性越____,金属元素越______;非金属元素的电负性一般______1.8,非金 属元素的电负性越____,非金属元素越______。② 判断元素在化合物中的价态:电负性大的元素易呈现____价;电负性小的元素易 呈现____价。③ 判断化学键类型:电负性差值大的元素原子之间形成的化学键主要是______键; 电负性差值小的元素原子之间形成的化学键主要是______键。
知识点4 元素周期表中的有关规律
(1) 同主族、邻周期元素的原子序数差
(2) 同周期第ⅡA族和第ⅢA族元素原子序数差
(2) 只有________元素才有负价,非金属元素的最高正价与它的负化合价的绝对值 之和等于___。
3. 微粒半径大小比较的一般规律
4. 元素种类判断规律
(1) 周期元素种类:设n为周期序数,每一周期排布元素的数目为:___数周期为 ; ____数周期为 。如第___周期为 种,第___周期为 种。
(1) 相邻相似:元素周期表中,__________相邻的元素性质差别不大,俗称相邻相似规律;
(2) 同族相似;由于同族元素的最外层电子数______,故同族元素性质______。
(3) 对角相似:①沿表中金属与非金属分界线方向( ),对角相邻的两主族元素(都是金属或非金属)性质(金属性或非金属性)______.②元素周期表中左上右下( )相邻的两金属元素的离子半径______.
(1) 同周递变:同一周期的元素从左到右,随着核电荷数的______,最外层电子数依次_____,原子半径逐渐_____,原子失电子能力逐渐_____,得电子能力逐渐______,所以,元素的金属性逐渐______,非金属性逐渐______。
(2) 同族递变:同一主族的元素从上到下,随着核电荷数的______,电子层数依次______,原子半径逐渐______,原子失电子能力逐渐______,得电子能力逐渐_____,所以,元素的金属性逐渐______,非金属性逐渐______。
质子数 → 决定原子序数电子层数 → 决定周期数最外层电子数 → 决定主族序数
质子数 → 决定元素种类 原子半径最外层电子数
①同周期从左到右:金属性减弱,非金属性渐强
②同主族从上到下:化学性质相似,但又有递变
(1) 结构与位置的互推
(2) 性质与位置互推
熟悉元素周期表中同周期、同主族元素性质的递变规律,根据元素性质可以推知元素在周期表中的位置,根据元素在周期表中的位置可以推知元素性质。主要包括:
① 元素的金属性、非金属性。
② 气态氢化物的稳定性。
③ 最高价氧化物对应水化物的酸碱性。
(3) 结构和性质的互推
① 最外层电子数是决定元素原子的氧化性和还原性的主要因素。
② 原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质。
③ 同主族元素最外层电子数相同,性质相似。
若干元素原子序数间关系
(1) 结构与位置互推是解题的核心
(2) 熟记常见元素及其化合物的特性
① 形成化合物种类最多的元素、单质是自然界中存在的硬度最大的物质的元素、 气态氢化物中氢的质量分数最大的元素:C。
② 空气中含量最多的元素、气态氢化物水溶液呈碱性的元素:N。
③ 地壳中含量最多的元素:O。
⑤ 单质是最活泼的非金属元素、无正价的元素或无含氧酸的非金属元素、气态氢化 物的水溶液可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子还原性最弱的 元素:F。
⑨ 元素的气态氢化物和它的最高价氧化物对应的水化物能化合的元素:N ; 能发生氧化还原反应的元素:S 。
考向1 考查金属性和非金属性相关的递变规律
【例1】(23-24高三上·上海宝山·阶段考试) S与?? 为同一周期元素,下列事实正确且能比较两者非金属性强弱的是 ( )
元素的非金属性越强,其简单气态氢化物越稳定, HCl比H2S稳定,说明非金属性:Cl>S,A错误;
元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,但是HCl和H2SO3不是相应元素的最高价含氧酸,B错误;
氢化物的沸点高低不能用于比较元素的非金属性强弱,C错误;
Cl2可以从含有S2-的溶液中将S置换出来,因Cl2的氧化性强于S,单质的氧化性越强,元素的非金属性越强,说明非金属性:Cl>S,D正确.
金属性、非金属性强弱判断的常见误区:
(1)认为根据酸性HCl>H2S,可判断非金属性Cl大于S,应根据最高价氧化物对应水化物的酸性强弱判断。(2)认为根据失电子数NaHCl>HBr>HI,可判断酸性:HF>HCl>HBr>HI,实际是酸性HF
相关课件
这是一份第六部分 第01讲 化学反应的热效应(课件)-2025年高考化学二轮复习课件PPT,共60页。PPT课件主要包含了第01讲,化学反应的热效应,考情透视,知识导图,考点突破,真题练习,考点一,反应热与焓变,考点二,考点三等内容,欢迎下载使用。
这是一份第八部分 第01讲 电离平衡(课件)-2025年高考化学二轮复习课件PPT,共60页。PPT课件主要包含了第01讲,电离平衡,考情透视,知识导图,考点突破,真题练习,考点一,弱电解质的电离平衡,知识点1弱电解质,考点二等内容,欢迎下载使用。
这是一份第01讲+元素周期表、元素周期律(练习)- 2025年高考化学一轮复习讲义+课件+专练(新教材新高考),文件包含第01讲元素周期表元素周期律练习原卷版docx、第01讲元素周期表元素周期律练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。








