





所属成套资源:【高考二轮】2025年高考化学二轮复习课件PPT
第一部分 第05讲 氧化还原反应方程式的配平、书写及计算(课件)-2025年高考化学二轮复习课件PPT
展开
这是一份第一部分 第05讲 氧化还原反应方程式的配平、书写及计算(课件)-2025年高考化学二轮复习课件PPT,共60页。PPT课件主要包含了第05讲,考情透视,知识导图,考点突破,真题练习,考点一,考点二,知识点1计算原理等内容,欢迎下载使用。
氧化还原反应方程式的配平、书写及计算
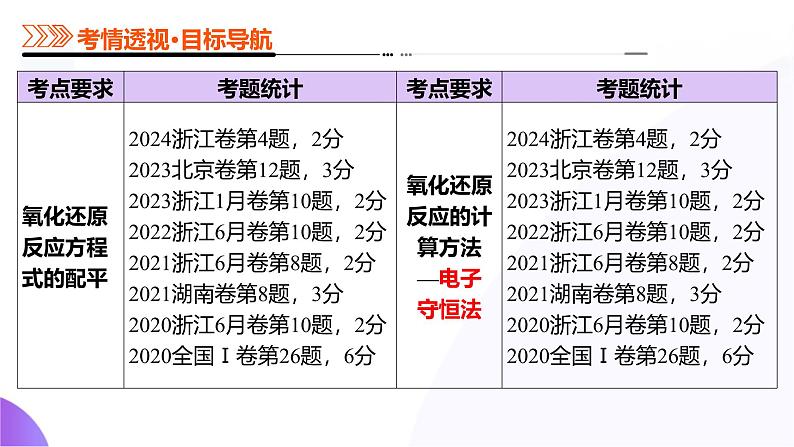
考向1 考查氧化还原方程式的配平
考向2 考查“信息型”氧化还原反应方程式的书写
考向1 考查多元素之间得失电子守恒问题
考向2 考查多步反应得失电子守恒问题
考向3 气体摩尔质量计算的常用方法
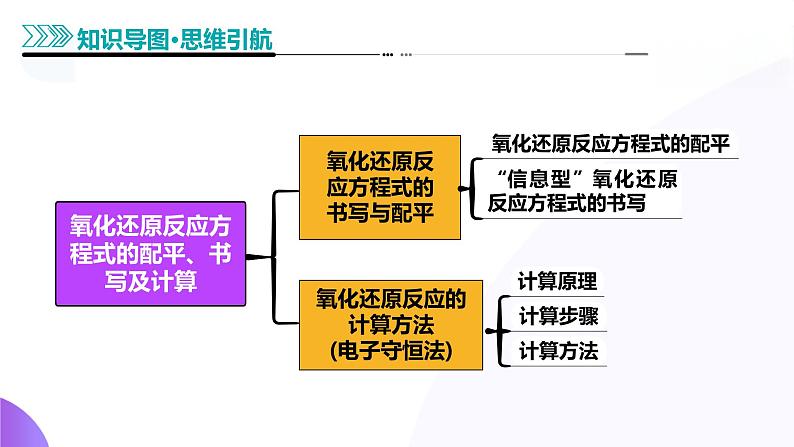
氧化还原反应方程式的书写与配平
知识点1 氧化还原反应方程式配平
1.氧化还原方程式配平的基本原则——配平三大原则
2.“五步骤”配平氧化还原反应方程式
(1)记住元素的常见价态
⑦HCN:________________;
⑧CuH:________________;
(2)明确一些特殊物质中元素的化合价
第三步:根据______守恒和反应物的______性,在方程式左边或右边补充____、_____或_____等;
第四步:根据质量守恒配平反应方程式;
第五步:检查______、______、______是否守恒。
4.氧化还原反应配平的思维模型
第一步:根据元素化合价的升降,判断氧化剂、______剂、______产物、还原产物;
(2)逆向配平法适用于一种元素的化合价既____________的反应和______反应中的氧化还原反应。
先确定生成物的化学计量数,然后再确定反应物的化学计量数。
___S+___KOH(热、浓)=___K2S +___K2SO3 + ___H2O
(3)缺项型氧化还原反应方程式的配平缺项方程式是指某些______物或______物的分子式没有写出来,一般为____、____或____。
1)配平方法先用“化合价升降法”配平含有变价元素的物质的化学计量数,然后由原子守恒确定未知物,再根据原子守恒进行配平。
1.“信息型”氧化还原反应化学(离子)方程式的书写程序
知识点2 “信息型”氧化还原反应(离子)方程式的书写
2.熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物
第1步:根据题干信息或流程图,判断氧化剂、还原剂、氧化产物、还原产物
3.掌握书写信息型氧化还原反应化学(离子)方程式的步骤(4步法)
第3步:根据电荷守恒和溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
4.氧化还原反应化学(离子)方程式的配平步骤
【例1】(1)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO⋅Cr2O3,还含有硅、铝等杂质:
____???(??)?+ ____?−+ ____?+ → ____???+ + ____??+ ____???
1、2、4、1、1、3
【变式训练1】配平下列方程式
【变式训练2】配平下列方程式
【例2】根据图示信息书写方程式。
①反应I的化学方程式为__________________________________________。
【变式训练1】(2024秋·江苏·高三开学考试)根据信息书写方程式或描述反应过程。
①虚线框内BMO降解苯酚的过程可描述为:__________________________________________________________。
(2)氯化银可以溶于氨水中,写出该反应的离子方程式:____________________________________________________________________________。
【解析】氯化银可以溶于氨水中生成银氨络离子。
氧化还原反应的计算方法(电子守恒法)
对于氧化还原反应的计算,要根据氧化还原反应的实质——反应中氧化剂____的电子总数与还原剂______的电子总数相等,即______电子守恒。利用守恒思想,可以抛开繁琐的反应过程,可不写化学方程式,不追究中间反应过程,只要把物质分为始态和终态,从____电子与____电子两个方面进行整体思维,便可迅速获得正确结果。
知识点2 守恒法解题的思维流程
找出氧化剂、还原剂及相应的还原产物和氧化产物
确定一个原子或离子得失电子数(注意化学式中粒子的个数)
根据题中物质的物质的量和得失电子守恒列出等式
得失电子守恒是指在发生氧化还原反应时,氧化剂得到的电子总数一定_____还原剂失去的电子总数。得失电子守恒法常用于氧化还原反应中氧化剂、还原剂、氧化产物、还原产物的有关计算及电解过程中电极产物的有关计算等。
(1)直接计算反应物与产物或反应物与反应物之间的______关系。
(2)对于多步连续的氧化还原反应则可根据“电子传递”,找出______反应物与______生成物之间的关系进行计算,忽略反应过程。
知识点3 电子守恒在氧化还原反应计算中的应用
(3)以电子守恒为核心,建立起“等价代换”,找出有关物质之间的关系进行计算等。
(4)多池串联时,流经各个电极上的电子数______。
n(H2O)=0.35 ml
n(O)=0.35 ml
n(HCl)=0.7 ml
n(Cl-)=0.7 ml
n(Cl-)总=0.75 ml
n(Cl-)=0.05 ml
n(Fe)=0.35 ml
N(Fe):N(O)=?.??ml:?.??ml=?:?
相关课件
这是一份第05讲 氧化还原反应方程式的配平、书写及计算(课件)-2025年高考化学一轮复习课件(新教材新高考),共60页。PPT课件主要包含了第05讲,考情透视,知识导图,考点突破,真题练习,考点一,考点二,知识点1计算原理等内容,欢迎下载使用。
这是一份第05讲 氧化还原反应方程式的配平、书写及计算(练习)- 2025年高考化学一轮复习讲义+课件+专练(新教材新高考),文件包含第05讲氧化还原反应方程式的配平书写及计算练习原卷版docx、第05讲氧化还原反应方程式的配平书写及计算练习解析版1docx、第05讲氧化还原反应方程式的配平书写及计算练习解析版docx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份第05讲 氧化还原反应方程式的配平、书写及计算(课件)-2025年高考化学一轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了考情透视,知识导图,考点突破,真题练习,考点一,考点二,知识点1计算原理等内容,欢迎下载使用。









