

所属成套资源:【高考一轮】2025年高考化学一轮复习知识点(新高考专用)
专题05 钠及其重要化合物--2025年高考化学一轮复习知识点(新高考专用)
展开
这是一份专题05 钠及其重要化合物--2025年高考化学一轮复习知识点(新高考专用),文件包含专题05钠及其重要化合物原卷版docx、专题05钠及其重要化合物解析版docx等2份学案配套教学资源,其中学案共40页, 欢迎下载使用。
2.精练高考真题,明确方向。以下三点:一是主干知识考查“集中化”,二是基础知识新视角,推陈出新,三是能力考查“综合化”。
3.摸清问题所在,对症下药。要提高后期的备考质量,还要真正了解学生存在的问题,只有如此,复习备考才能更加科学有效。所以,必须加大信息反馈,深入总结学情,明确备考方向,对症开方下药,才能使学生的知识结构更加符合高考立体网络化要求,才能实现基础→能力→分数的转化。
4.切实回归基础,提高能力。复习训练的步骤包括强化基础,突破难点,规范作答,总结方法,通过这样的总结,学生印象深刻,应用更加灵活。
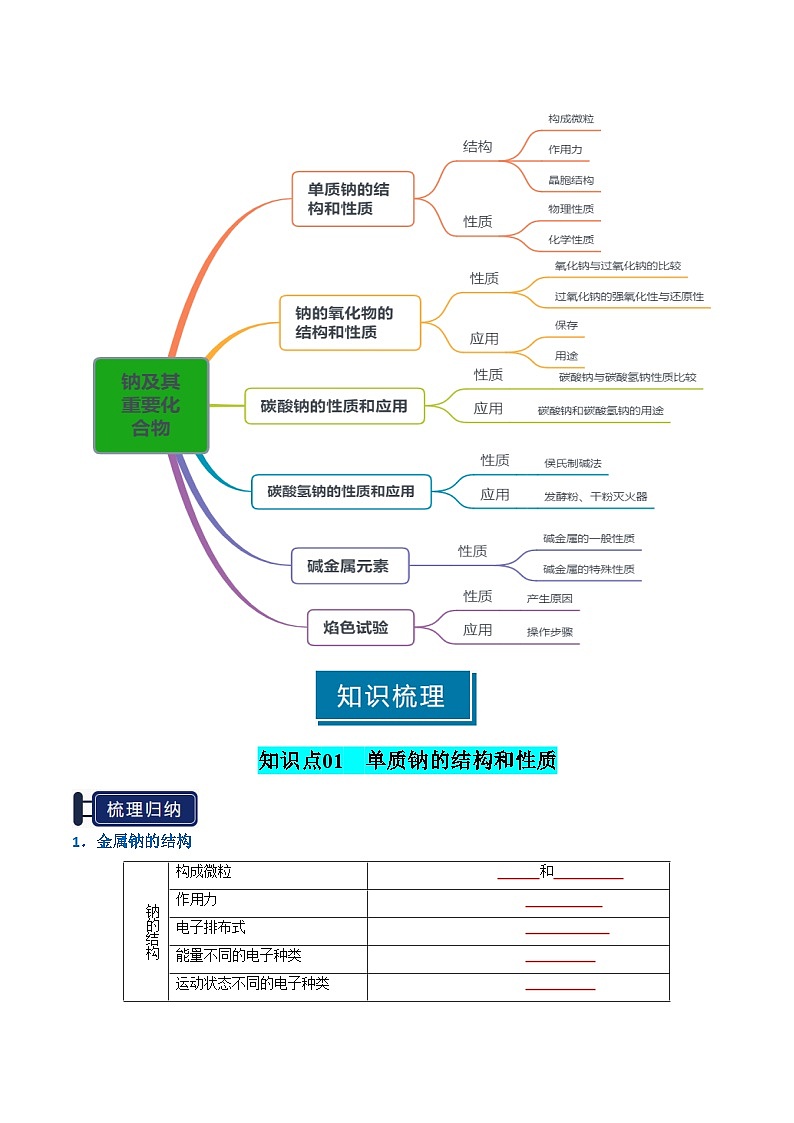
知识清单05 钠及其重要化合物
知识点01 单质钠的结构和性质
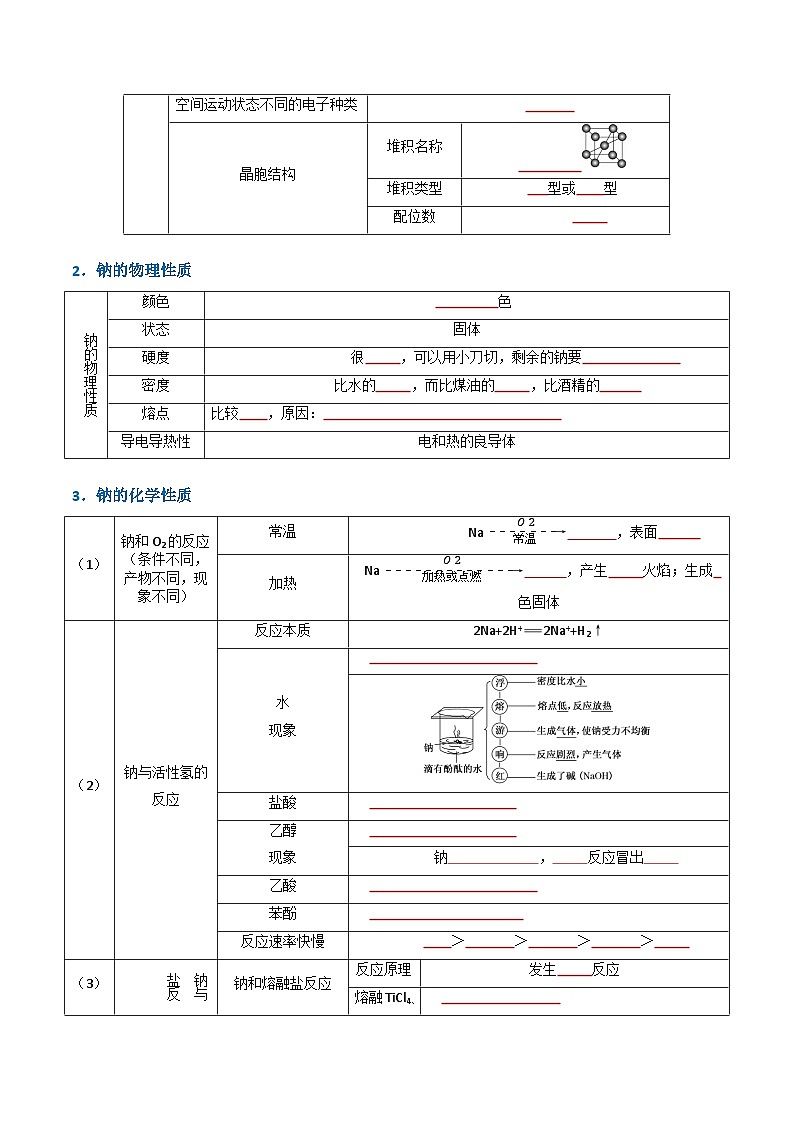
1.金属钠的结构
2.钠的物理性质
3.钠的化学性质
4.钠的存在、制备、保存和用途
钠的易错知识点
(1)钠与盐溶液反应,不能置换出盐中的 ,如:钠与CuSO4溶液反应不能置换出铜;钠与熔融的盐反应才可能置换出盐中的金属。
(2)Na与足量O2反应无论生成Na2O还是Na2O2,只要参与反应的Na的 相等,则转移 数一定相等。
(3)Na分别与H2O和乙醇发生反应均能生成 ,但反应的剧烈程度不同,前者反应 ,后者反应 。
(4)Na与酸溶液反应:直接与 反应,而不是先和水反应。
(5)一定量的钠与足量的某溶液反应,产生氢气的量相同,与该溶液中溶质的多少无关。
(6)钠与水、酸反应的实质都是与H+的反应。
1.研究金属钠的性质,实验如下(钠的大小相同):
下列说法正确的是
A.I中反应的离子方程式为
B.随着增大,钠与盐酸反应的剧烈程度增大
C.对比实验I、Ⅳ可知羟基极性:
D.推测Ⅲ中溶液中的以及生成的固体对反应剧烈程度有影响
2.氢化钠()可在野外作生氢剂,也可用于医药、香料、农药、染料增白剂和高分子工业等。如图实验装置制备,下列说法正确的是
A.安全漏斗可以换为分液漏斗B.装置A中的试剂是稀盐酸和锌粒
C.装置D的作用是尾气处理D.实验开始后先点燃C处酒精灯,再启动A中反应
知识点02 钠的氧化物的结构和性质
1.氧化钠和过氧化钠的比较
2.Na2O的晶胞
(1)晶胞中含Na2O个数: ,O2-的堆积方式:
(2)Na+的配位数: ,O2-的配位数
3.Na2O2的自身氧化还原反应
4.Na2O2的还原性和强氧化性
(1)遇KMnO4等强氧化剂时,表现出还原性,氧化产物为 。
(2)强氧化性
遇到CO2、SO3等最高价氧化物时发生自身氧化还原反应生成盐和O2,既表现氧化性又表现还原性
、
遇到CO、SO2等低价氧化物时一般将其氧化成最高价含氧酸盐,只表现氧化性
、
5.钠的氧化物和盐溶液反应
6.Na2O2的漂白性
7.Na2O2的用途
(1)漂白剂:纸浆、毛、丝、草帽辫
(2)消毒剂:强氧化性,杀菌消毒
(3)供氧剂:吸入二氧化碳和水蒸气,呼出氧气
易错点1:钠的氧化物的易错知识点
(1)Na2O2歧化反应转移电子数的关系式:2Na2O2——O2——2e-。
(2)钠的氧化物和盐溶液反应的过程:先和水反应生成碱,碱再与盐溶液发生复分解反应。
(3)Na2O2投入品红溶液中,因溶液中有强氧化性物质,因而Na2O2可使品红溶液褪色。Na2O2投入无色酚酞溶液中,酚酞溶液先变红后褪色。
(4)Na2O2与SO2反应的化学方程式是 ,而非2Na2O2+2SO2=2Na2SO3+O2。
(5)Na2O2不属于碱性氧化物。
易错点2:Na2O2与H2O、CO2反应的四种关系规律
(1)Na2O2与H2O、CO2反应的定量关系
(2)特殊应用:凡分子组成符合(CO)m·(H2)n的物质,m g该物质在O2中完全燃烧,将其产物[CO2和H2O(g)]通入足量Na2O2后,固体增重必为m g。或者是由C、H、O三种元素组成的物质,只要C、O原子个数比为1∶1,即可满足上述关系。
3.在潜水艇和消防员的呼吸面具中,作为氧气的来源。下列说法不正确的是
A.和反应可生成
B.可使酚酞溶液先变红色后褪色
C.工业上用未经过处理的空气和钠直接反应来制备
D.可用焰色试验来检验中的阳离子
4.研究小组探究Na2O2与水反应。取1.56gNa2O2粉末加入到40mL水中,充分反应得溶液A(液体体积无明显变化),进行以下实验。
下列说法不正确的是
A.溶液A中氢氧化钠浓度近似为1ml/L
B.由③、④可知,越大,溶液红色褪色现象更明显
C.向①中褪色后的溶液中滴加5滴6ml/L盐酸,溶液最终变成红色
D.向②中褪色后的溶液中滴加5滴6ml/L盐酸,溶液最终变成红色
知识点03 碳酸钠的性质和应用
一、碳酸钠的性质及应用
钠的碳酸盐的易错知识点
(1)除去CO2中的HCl气体,应选用饱和 溶液;
(2)向饱和Na2CO3溶液中通入过量CO2,有 晶体析出。
(3)鉴别Na2CO3和NaHCO3溶液不能用Ca(OH)2或Ba(OH)2,二者均会产生 沉淀
(4)Na2CO3溶液与盐酸反应的过程为:Na2CO3NaHCO3CO2,可以用互滴法鉴别两种无色溶液。
5.常温下,分别向相同浓度的NaHCO3、Na2CO3溶液中逐滴加入盐酸,滴加过程中溶液的pH变化如下图所示。下列说法正确的是
A.曲线①表示盐酸滴入NaHCO3溶液的过程
B.d、e点水的电离程度:d>e
C.a点的KW大于d点的KW
D.b、c、e点均满足:
6.过碳酸钠()是一种白色固体,具有碳酸钠和过氧化氢的性质,可用于杀菌消毒等。实验室中用如下方法合成过碳酸钠晶体。
下列说法错误的是
A.采用冰水浴控制三颈烧瓶中反应的温度
B.操作①使用的玻璃仪器是漏斗、烧杯和玻璃棒
C.过碳酸钠晶体内与以氢键结合
D.操作③可用加热法干燥
知识点04 碳酸氢钠的性质和应用
碳酸氢钠的性质及应用
易混易错点:碳酸钠、碳酸氢钠的除杂和鉴别
1.Na2CO3、NaHCO3的除杂
2.Na2CO3、NaHCO3的鉴别
(1)固体的鉴别
①加热法:产生使澄清石灰水变浑浊的气体的是 固体。
②气体法:滴入稀盐酸,产生气泡速率快的是 固体。
(2)溶液的鉴别
①沉淀法:加入 溶液或 溶液,产生沉淀的是Na2CO3溶液。
②测pH法:用pH试纸测相同浓度的稀溶液,pH大的是 溶液。
3.Na2CO3和NaHCO3的检验
(1)步骤
①向溶液中加入足量的 溶液或 溶液,过滤
分别向沉淀和滤液中加入足量的
③将产生的气体依次通过 溶液和
(2)现象及结论:品红溶液不褪色,澄清石灰水变浑浊
①沉淀上产生该现象:原溶液中含有
滤液中产生该现象:原溶液中含有
同时产生该现象:原溶液中含有Na2CO3和NaHCO3
7.探究同浓度的与溶液和不同盐溶液间的反应,①中产生白色沉淀和无色气体,②中只产生白色沉淀。(已知:碳酸铝在水溶液中不能稳定存在)
下列说法不正确的是
A.能促进的水解
B.①中沉淀可能是氢氧化铝和碱式碳酸铝中的一种或二者的混合物
C.同浓度的与溶液分别加入酚酞,溶液的红色深
D.②中溶液滴入后,溶液的不变,溶液的降低
8.侯氏制碱法中制取的原理为。下列实验装置合理、操作规范,能达到实验目的的是
A.AB.BC.CD.D
知识点05 碱金属元素
1.碱金属的原子结构与性质
2.碱金属的化学性质
(1)性质的相似性(用R表示碱金属元素)
(2)性质的递变性
(3)性质的具体体现
易错点:碱金属元素的特殊性
(1)密度:一般随核电荷数的增大而 ,但钾的密度比钠的 。
(2)颜色:除了Cs略带 光泽外,其余的都是 色有金属光泽的固体
(3)保存
①一般都保存在 或 中,锂只能保存在 中
②试剂瓶中的试剂取出后,一般不能放回原瓶,但金属 等需立即放回原瓶
(4)盐的溶解性
①一般情况下,碱金属所形成的盐均 水,并且在一定温度下,酸式盐比正盐的溶解度
②NaHCO3的溶解度比Na2CO3的
(5)碱金属氢化物(如NaH):碱金属可与H2发生反应生成RH(R代表碱金属),属于离子化合物,H元素显-1价,碱金属氢化物是强还原剂。如NaH+H2O===NaOH+H2↑,NaH是还原剂,H2O是氧化剂,氧化产物为 H2,还原产物也为 H2。
(6)锂与O2反应与钠不同,只生成 ,而不生成Li2O2。
(7)碱金属氧化物的结构
9.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是
①金属性最强的是铯
②形成的离子中氧化性最强的是锂离子
③在自然界中均以化合态形式存在
④Li的密度最小
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥它们的氧化物都只有和两种形式
⑦粒子半径:
A.①②③④B.④⑤⑥⑦C.②⑥D.①②③④⑤⑦
10.第87号元素钫,它位于碱金属族,根据元素周期表结构及元素性质变化趋势,下列关于碱金属某些元素原子结构和性质的判断,错误的是
①锂与水反应比钠剧烈 ②金属单质都可以密封保存在煤油中 ③钾的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同 ⑤钫单质是强还原剂 ⑥钫在化合物中显+1价 ⑦钫单质的密度应该大于 ⑧钫单质有较高的熔点
A.①②④⑧B.①②③⑦C.③④⑤⑧D.①③④⑥
知识点06 焰色试验
1.实验图示
2.操作顺序
3.图解操作
4.常见元素的焰色试验的颜色
5.产生原因:灼烧时,基态电子吸收能量 到激发态,由 跃迁回基态时,释放的能量以可见光形式呈现
易错点:焰色试验“易错点”
(1)焰色试验体现的是元素的性质,无论元素是游离态还是化合态,同一元素均具有相同的 。
(2)焰色试验发生的是 变化。
(3)在观察钾元素的焰色时,应透过蓝色的钴玻璃片观察,蓝色钴玻璃可以将 过滤掉,避免钠元素的干扰。
①若肉眼看不到紫色火焰,则样品中 含钾元素
②若肉眼看到紫色火焰,则样品中 含钠元素
(4)洗涤做焰色反应的铂丝,可选用稀盐酸,不能用稀硫酸。选用稀盐酸,生成的 在高温时可挥发,不能选择稀硫酸,硫酸不挥发。
11.下列有关焰色试验操作的描述正确的是
A.取一根洁净的细铁丝,放在酒精灯上灼烧至无色,再蘸取少量NaCl溶液,进行焰色试验
B.在观测焰色试验时均要透过蓝色钴玻璃片,以便隔绝钠元素的黄光的干扰
C.铂丝在做完氯化钠溶液的焰色试验后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
12.下列说法中正确的是
A.焰色试验是化学变化
B.用稀硫酸清洗做焰色试验的铂丝(镍丝或铁丝)
C.焰色试验均应透过蓝色钴玻璃观察
D.利用焰色试验不能区分NaCl与Na2CO3固体
知识点01单质钠的结构和性质
知识点02 钠的氧化物的结构和性质
知识点03 碳酸钠的性质和应用
知识点04 碳酸氢钠的性质和应用
知识点05 碱金属元素
知识点06 焰色试验
钠的结构
构成微粒
和
作用力
电子排布式
能量不同的电子种类
运动状态不同的电子种类
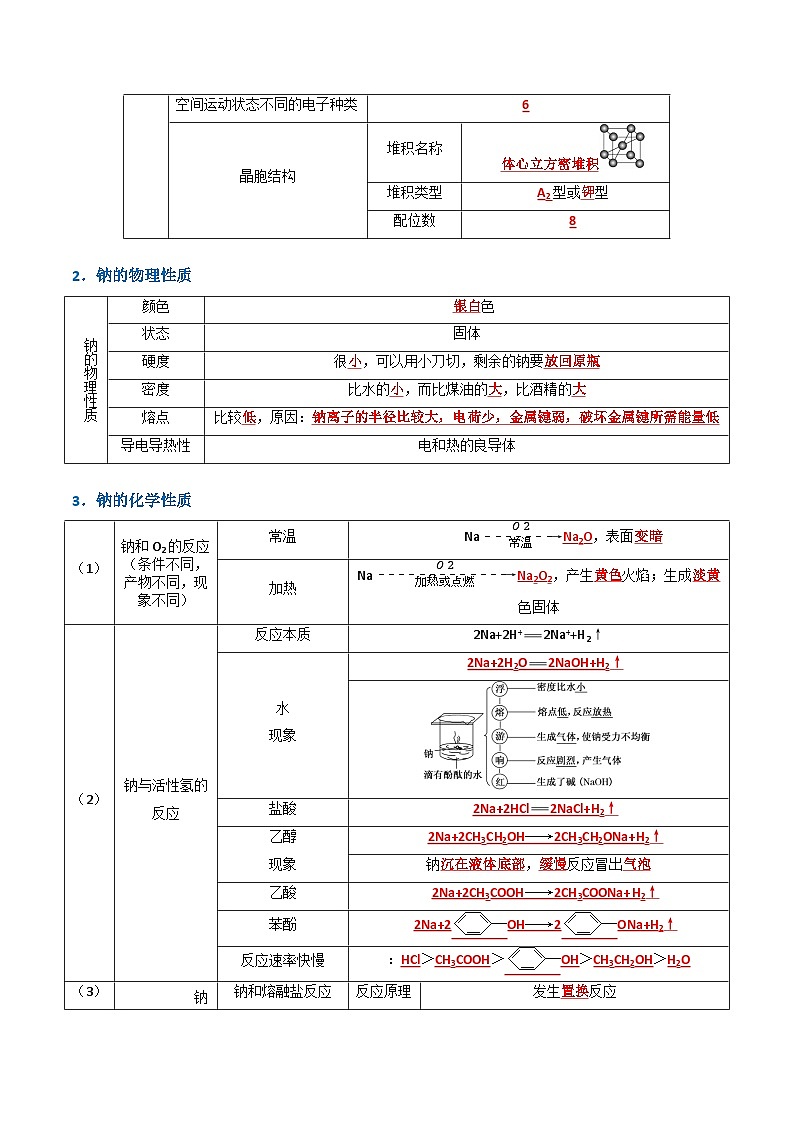
空间运动状态不同的电子种类
晶胞结构
堆积名称
堆积类型
型或 型
配位数
钠的物理性质
颜色
色
状态
固体
硬度
很 ,可以用小刀切,剩余的钠要
密度
比水的 ,而比煤油的 ,比酒精的
熔点
比较 ,原因:
导电导热性
电和热的良导体
(1)
钠和O2的反应(条件不同,产物不同,现象不同)
常温
Naeq \(-------→,\s\up7(O2),\s\d5(常温)) ,表面
加热
Naeq \(-------------→,\s\up7(O2),\s\d5(加热或点燃)) ,产生 火焰;生成 色固体
(2)
钠与活性氢的反应
反应本质
2Na+2H+2Na++H2↑
水
现象
盐酸
乙醇
现象
钠 , 反应冒出
乙酸
苯酚
反应速率快慢
> > > >
(3)
钠与盐反应
钠和熔融盐反应
反应原理
发生 反应
熔融TiCl4、KCl
CuSO4溶液反应
反应原理
Na
主要现象
有 产生,产生 沉淀
存在形态
只以 形式存在
制备
2NaCl(熔融)2Na+Cl2↑
变质
钠在空气中长期放置最终变成
保存
一般保存在 或 中
灭火
钠着火时一般用 扑灭
用途
制钠的化合物:
制Na2O2等
冶金还原剂
从熔融的卤化物中置换出钛、锆、铌、钽等难熔金属
制 灯
黄光,射程远、透雾能力强
原子反应堆导热剂
,室温下是液体,吸热能力强
实验装置
液体
现象
蒸馏水
Ⅰ.钠浮在水面,剧烈反应,有少量白雾
盐酸
Ⅱ.钠浮在液面,反应比I剧烈,有白雾产生
浓盐酸
Ⅲ.钠浮在液面,反应比I缓慢,产生大量白雾,底部有白色固体
无水乙醇
Ⅳ.钠沉入底部,反应比I缓慢得多,未见有固体生成
物质
氧化钠(Na2O)
过氧化钠(Na2O2)
色态
固体
色固体
类别
氧化物
化物
(非碱性氧化物)
氧的价态
-2
电子式
阴阳离子
个数比
化学键
离子键
生成条件
常温
加热或点燃
相互转化
热稳定性
不稳定
稳定
电子转移
关系式
氧化剂、还原剂
既是氧化剂,又是还原剂
Na2O2变质
在空气中长期放置最终变成
Na2O2和水反应的原理
复分解反应:Na2O2+2H2O
热分解反应
反应原理
钠的氧化物先和水反应,生成的NaOH再和盐发生复分解反应
过氧化钠与还原性溶液反应:直接发生氧化还原反应
与非还原性盐溶液的反应
CuCl2溶液eq \(------→,\s\up7(Na2O),\s\d5(现象))产生
MgCl2溶液eq \(------→,\s\up7(Na2O2),\s\d5(现象))产生
与还原性盐溶液的反应
FeCl2溶液eq \(------→,\s\up7(Na2O),\s\d5(现象))产生 ,迅速变成 ,最后变成
FeCl2溶液eq \(------→,\s\up7(Na2O2),\s\d5(现象))立即产生 和
原理及特点
性漂白, 性漂白
适用范围
能漂白有机色素,不能漂白无机色素(如墨汁)
实验现象
石蕊试液现象是溶液先 后 ,并有 产生
酚酞试液现象是溶液先 后 ,并有 产生
品红溶液现象是溶液 ,并有 产生
电子转移关系
当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e-,
气体体积变化关系
若CO2、水蒸气(或两混合气体)通过足量Na2O2,气体体积的减少量是原来气体体积的eq \f(1,2),等于生成氧气的量,
先后顺序关系
由于CO2能够与NaOH反应,所以一定量的Na2O2与一定量的H2O(g)和CO2的混合物反应,可视为Na2O2先与CO2反应,剩余的Na2O2再与H2O(g)反应。
固体质量变化关系
CO2、水蒸气分别与足量Na2O2反应时,固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”,所以固体增加的质量Δm(CO2)=28 g·ml-1×n(CO2),Δm(H2O)=2 g·ml-1×n(H2O)
无机化合物
H2、CO及H2和CO的混合气体
有机化合物
CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、
HCOOCH3(甲酸甲酯)、C6H12O6(葡萄糖)等
编号
①
②
③
④
操作
现象
溶液变红色,20秒后褪色
i.产生大量能使带火星木条复燃的气体
ii.溶液变红色,10分钟后褪色
i.溶液变红色,10分钟后溶液褪色
ii.变红色
溶液变红色,2小时后无明显变化
Na2CO3
俗名
纯碱或苏打,水溶液呈碱性
颜色状态
白色粉末
溶解性
易溶于水
水解
②
与盐酸反应
Na2CO3 ②HCl
与NaOH反应
不反应
与足量Ca(OH)2反应
与BaCl2反应
与CO2反应
COeq \\al(2-,3)+CO2+H2O===2HCOeq \\al(-,3)
铝、铁盐(双水解)
①
热稳定性
较稳定
与NaHCO3相互转化
Na2CO3 NaHCO3
Na2CO3的用途
制玻璃① ②
制肥皂:油脂的碱性水解,其主要成分是高级脂肪酸钠
去污剂:热的碱液去除餐具上的油污
造纸、纺织
NaHCO3
俗名
小苏打,水溶液呈 性
颜色状态
白色细小的晶体
溶解性
易溶于水(溶解度比Na2CO3 )原因是NaHCO3中含有
饱和Na2CO3溶液eq \(------→,\s\up7(CO2),\s\d5(过量))现象是有
水解
HCOeq \\al(-,3)+H2OH2CO3+OH-
与盐酸反应
与NaOH反应
HCOeq \\al(-,3)+OH-===COeq \\al(2-,3)+H2O
与足量Ca(OH)2反应
少量Ca(OH)2
2NaHCO3+Ca(OH)2CaCO3↓+Na2CO3+2H2O
与BaCl2反应
不反应
与CO2反应
不反应
与铝、铁盐(双水解)
与Na[Al(OH)4]或NaAlO2酸碱中和反应
热稳定性
2NaHCO3eq \(=====,\s\up7(△))Na2CO3+CO2↑+H2O
与碳酸钠相互转化
Na2CO3 NaHCO3
侯氏制碱法
流程:饱和NaClNaHCO3Na2CO3
原理:利用NaHCO3的溶解度小,析出晶体
制NaHCO3:
制Na2CO3:
循环利用的物质:
NaHCO3的用途
发酵粉:①中和食品发酵产生的有机酸;②加热分解产生大量CO2
治胃酸:中和胃中过多的盐酸
干粉灭火剂①:
泡沫灭火器②:Al3++3HCO3-Al(OH)3↓+3CO2↑
序号
混合物(括号内为杂质)
除杂方法
①
Na2CO3(s)(NaHCO3)
②
NaHCO3(aq)(Na2CO3)
③
Na2CO3(aq)(NaHCO3)
选项
A
B
C
D
目的
制取
除去中的
制备
分离
操作
原子结构与性质
相同点
最外层上都只有 个电子eq \(――→,\s\up7(推测))具有相似的化学性质
不同点
从Li→Cs电子层数逐渐 ,原子半径逐渐增大eq \(――→,\s\up7(推测))从Li到Cs金属性逐渐
物理性质
相同点
碱金属除Cs略带金色光泽外,其他都是银白色有金属光泽的固体,密度较小,硬度较小,熔、沸点较低,导电、导热性较强
递变性
从Li→Cs密度逐渐 (Na、K反常),熔、沸点逐渐
元素
Li
Na
K
Rb
Cs
与氧气反应
反应越来越 ,产物越来越复杂
Li2O
Na2O、Na2O2
K2O、K2O2、KO2
更复杂氧化物
与水反应
反应越来越
反应
反应
爆炸
爆炸
氢氧化物
碱性强弱:LiOH NaOH KOH RbOH CsOH
氧化物
氧化钠
过氧化钠
超氧化钾
臭氧化钾
化学式
Na2O
Na2O2
KO2
KO3
氧的价态
-2价
-1价
-价
-价
所含离子
2Na++1
2Na++1
K++1
K++1
化学键
离子键
离子键和
和共价键
离子键和共价键
相关学案
这是一份专题11 氮及其重要化合物--2025年高考化学一轮复习知识点(新高考专用),文件包含专题11氮及其重要化合物-2025年高考化学一轮复习知识点新高考专用原卷版docx、专题11氮及其重要化合物-2025年高考化学一轮复习知识点新高考专用解析版docx等2份学案配套教学资源,其中学案共38页, 欢迎下载使用。
这是一份专题10 硫及其重要化合物--2025年高考化学一轮复习知识点(新高考专用),文件包含专题10硫及其重要化合物-2025年高考化学一轮复习知识点新高考专用原卷版docx、专题10硫及其重要化合物-2025年高考化学一轮复习知识点新高考专用解析版docx等2份学案配套教学资源,其中学案共31页, 欢迎下载使用。
这是一份专题09 氯及其重要化合物--2025年高考化学一轮复习知识点(新高考专用),文件包含专题09氯及其重要化合物-2025年高考化学一轮复习知识点新高考专用原卷版docx、专题09氯及其重要化合物-2025年高考化学一轮复习知识点新高考专用解析版docx等2份学案配套教学资源,其中学案共31页, 欢迎下载使用。








