


所属成套资源:2025年高二化学寒假衔接讲练 (人教版)
①寒假复习-第5讲 原子结构与性质-2025年高二化学寒假衔接讲练 (人教版)
展开
这是一份①寒假复习-第5讲 原子结构与性质-2025年高二化学寒假衔接讲练 (人教版),文件包含①寒假复习-第5讲原子结构与性质教师版-2025年高二化学寒假衔接讲练人教版docx、①寒假复习-第5讲原子结构与性质学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
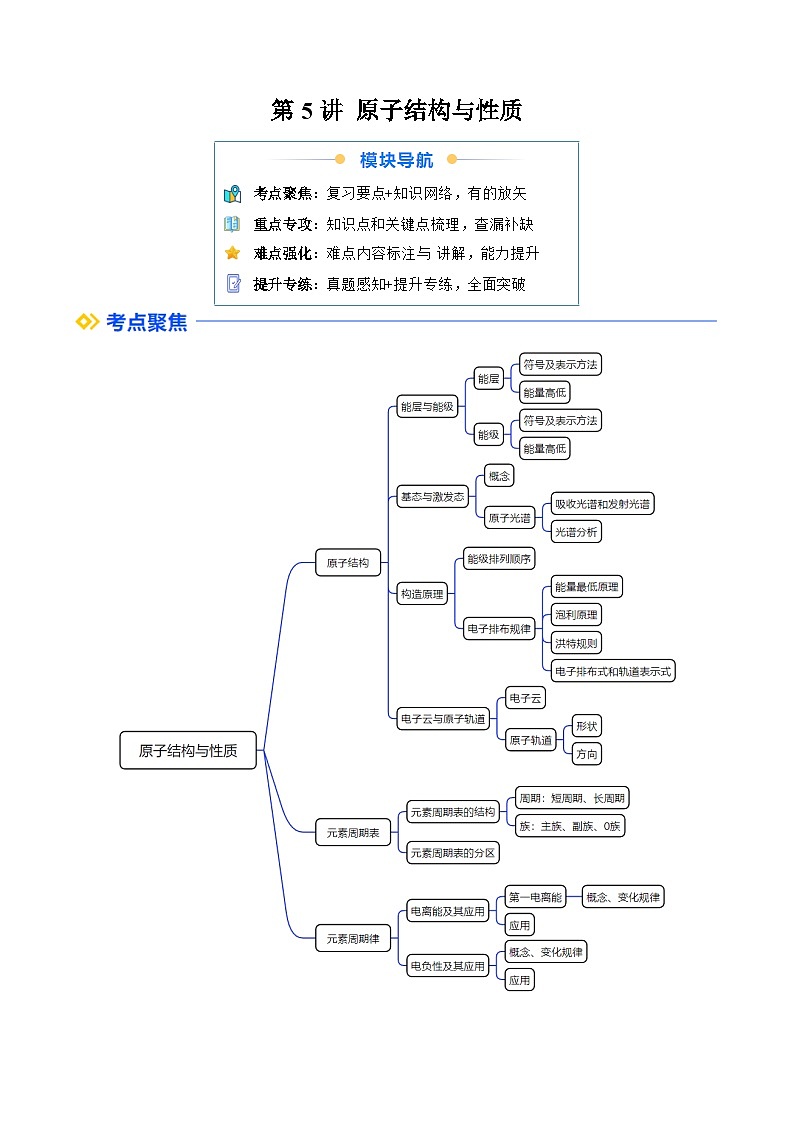
考点1 原子核外电子的运动特征
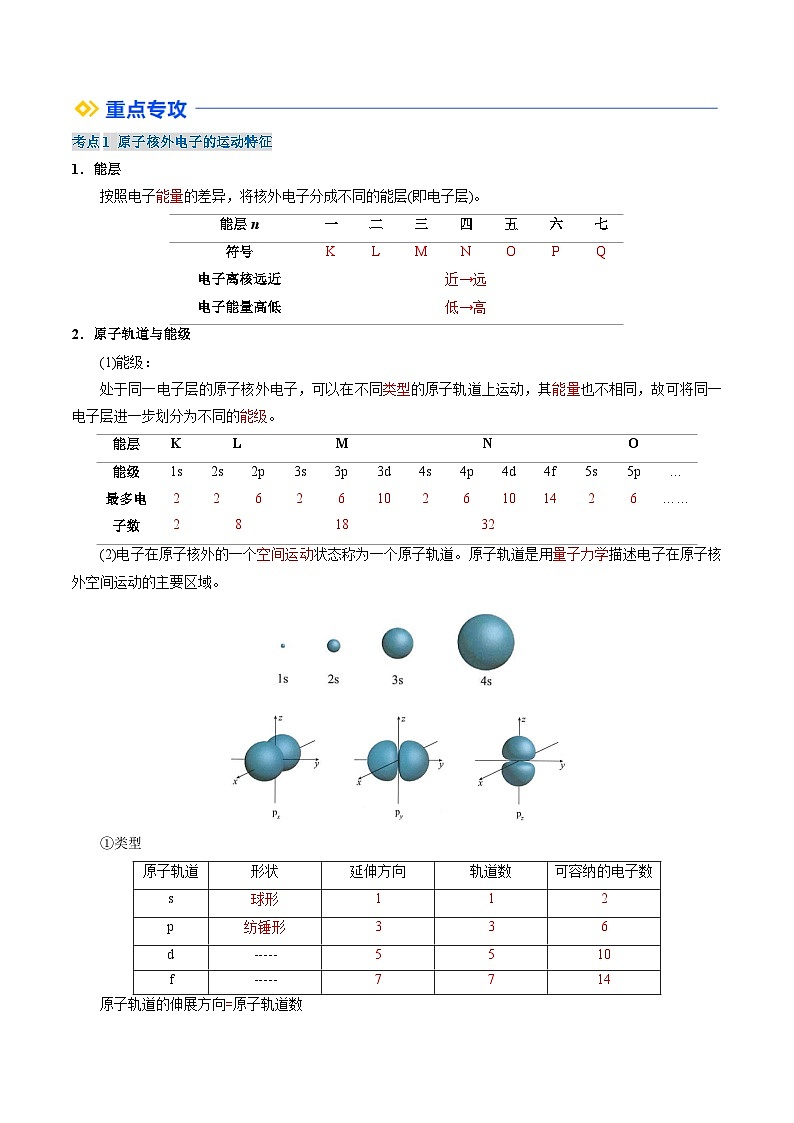
1.能层
按照电子_______的差异,将核外电子分成不同的能层(即电子层)。
2.原子轨道与能级
(1)能级:
处于同一电子层的原子核外电子,可以在不同_______的原子轨道上运动,其_______也不相同,故可将同一电子层进一步划分为不同的_______。
(2)电子在原子核外的一个___________状态称为一个原子轨道。原子轨道是用__________描述电子在原子核外空间运动的主要区域。
①类型
原子轨道的伸展方向_____原子轨道数
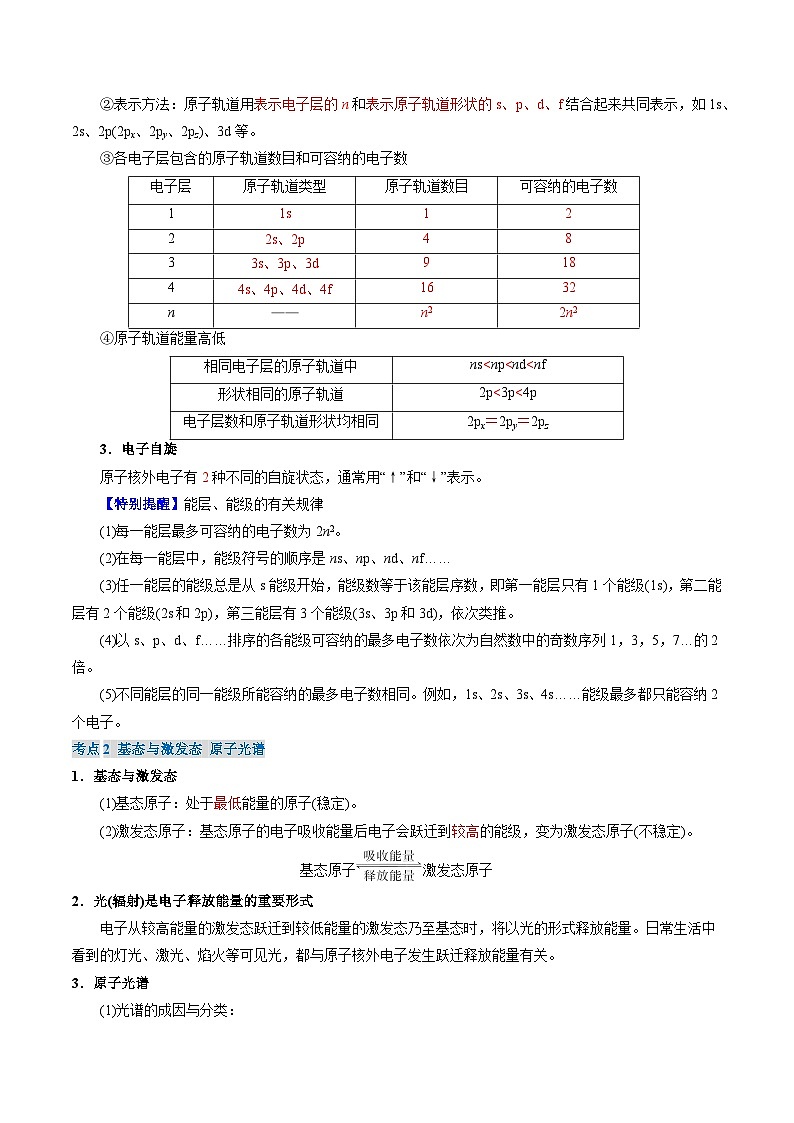
②表示方法:原子轨道用______________和_____________________结合起来共同表示,如1s、2s、2p(2px、2py、2pz)、3d等。
③各电子层包含的原子轨道数目和可容纳的电子数
④原子轨道能量高低
3.电子自旋
原子核外电子有______种不同的自旋状态,通常用“↑”和“↓”表示。
【特别提醒】能层、能级的有关规律
(1)每一能层最多可容纳的电子数为2n2。
(2)在每一能层中,能级符号的顺序是ns、np、nd、nf……
(3)任一能层的能级总是从s能级开始,能级数等于该能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依次类推。
(4)以s、p、d、f……排序的各能级可容纳的最多电子数依次为自然数中的奇数序列1,3,5,7…的2倍。
(5)不同能层的同一能级所能容纳的最多电子数相同。例如,1s、2s、3s、4s……能级最多都只能容纳2个电子。
考点2 基态与激发态 原子光谱
1.基态与激发态
(1)基态原子:处于_________能量的原子(稳定)。
(2)激发态原子:基态原子的电子吸收能量后电子会跃迁到_______的能级,变为激发态原子(不稳定)。
基态原子激发态原子
2.光(辐射)是电子释放能量的重要形式
电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量。日常生活中看到的灯光、激光、焰火等可见光,都与原子核外电子发生跃迁释放能量有关。
3.原子光谱
(1)光谱的成因与分类:
(2)光谱分析:
在现代化学中,利用原子光谱上的特征谱线来鉴定元素的分析方法。
(3)光谱分析的应用:鉴定元素。
考点3 构造原理与电子排布式
1.构造原理
电子是按照一定顺序填充的,_________一个能级之后再填下一个能级,这个规律称为构造原理。原子核外电子的排布遵循构造原理的三大内容:能量最低原理、泡利不相容原理和洪特规则。
原子核外电子排布的轨道能量顺序
(1)能量最低原理:原子核外电子先占据_________的轨道,然后依次进入_________的轨道,这样使整个原子处于_____________的状态。
电子所排的轨道顺序:1s、2s、2p、3s、3p、4s、_____、4p、5s、_____、5p、6s、_____、_____、6p、7s……,这是实验得到的规律,适用于大多数基态原子的核外电子排布。
(2)泡利不相容原理:每个原子轨道上最多容纳_____个自旋状态不同的电子。
(3)洪特规则:原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在_________________上,且自旋状态_________,这样整个原子的能量_________。
(4)洪特规则特例:能量相同的原子轨道在_________(如p6和d10)、_________(如p3和d5)和________(如p0和d0)状态时,体系的能量较低,原子较稳定。这称为洪特规则特例。
2.原子核外电子排布的表示方法
(1)电子排布式:用数字在轨道符号右上角标明该轨道上排布的电子数,例如:
15P:___________________________ 19K:___________________________
(2)简化的电子排布式
为了避免电子排布式书写过于繁琐,把内层电子已达到____________结构的部分写成“原子实”,以相应__________________符号外加方括号表示,得到简化的电子排布式。例如:
16S:__________________ 21Sc:__________________
(3)外围电子排布式:外围电子又称价电子,对主族元素而言,外围电子就是最外层电子。例如:
8O:__________________ 13Al:__________________
(4)轨道表示式:将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子称为轨道表示式。例如Al的轨道表示式为:____________________________________。
【特别提醒】
(1)能级数等于能层序数,英文字母相同的不同能级中所能容纳的最多电子数相同。
(2)虽然电子排布是遵循构造原理的,但在书写电子排布式时,应将能层低的能级写在左边,而不能按填充顺序写。如铁原子的电子排布式是1s22s22p63s23p63d64s2,而不能写成1s22s22p63s23p64s23d6,即最后两个能级表示为3d64s2,而不能写成4s23d6。
(3)书写离子的电子排布式时,从最外层起得到或失去电子,若为副族元素,还可失去次外层电子。
考点4 原子结构与元素周期表
1.元素周期律、元素周期系和元素周期表
(1)元素周期律
①定义:元素的性质随原子的___________递增发生周期性递变,这一规律叫做元素周期律。
②实质:元素性质的周期性变化是元素原子的__________________周期性变化的必然结果。
注:门捷列夫提出的元素周期律中的原子序数是按相对原子质量从小到大的顺序对元素进行编号。
(2)元素周期系
①含义:元素按其原子____________递增排列的序列称为元素周期系。这个序列中的元素性质随着原子核电荷数的递增发生周期性的重复。
②形成
(3)元素周期系与元素周期表的关系
元素周期表是呈现元素周期系的表格。
2.构造原理与元素周期表
(1)核外电子排布与周期的关系
根据构造原理得出的核外电子排布,可以解释元素周期系的基本结构。例如,可以解释元素周期系中每个周期的元素数,第一周期从_______开始,以_______结束,只有两种元素;其余各周期总是从______能级开始,以_______能级结束,递增的核电荷数(或电子数)就等于每个周期里的元素数。
(2)核外电子排布与族的关系
在常见的元素周期表中,同族元素_______________相同,这是同族元素性质相似的结构基础。例如,元素周期表最左侧第ⅠA族元素的基态原子最外层都只有一个电子,即_______;元素周期表最右侧稀有气体元素的基态原子,除氦(1s2)外,最外层都是8电子,即_________。
(3)元素周期表的分区
①元素周期表的分区
按照核外电子排布,可把元素周期表划分成5个区。除ds区外,各区的名称来自按构造原理_________ _________的能级的符号。
②各区价层电子排布特点
考点4 电离能及其应用
1.电离能的概念
(1)第一电离能:___________原子失去一个电子转化为__________________所需要的___________叫做第一电离能,通常用I1表示。
(2)各级电离能:+1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫做第二电离能,用I2表示;+2价气态正离子再失去一个电子,形成+3价气态正离子所需要的最低能量叫做第三电离能,用I3表示;依次类推。
2.第一电离能的变化规律
(1)同周期元素随着原子序数的递增,元素的第一电离能呈现_________的趋势。其中_______与_______、_______与________之间元素的第一电离能出现反常。
(2)同族元素从上到下第一电离能_________。
(3)同种原子的逐级电离能越来越_______(I1<I2<I3…)。
【特别提醒】
1.电离能数值大小规律及原因
同周期元素第一电离能的变化规律呈现的是一种增大的趋势,第ⅡA族和第ⅤA族元素会出现反常变化,通常同周期第ⅡA族、第ⅤA族元素的第一电离能比与它左右相邻的两种元素的第一电离能都大,这是因为第ⅡA族、第ⅤA族元素原子的价层电子排布分别是ns2、ns2np3,前者np能级处于全空状态,后者np能级处于半充满状态,第一电离能均较大。
2.电离能的应用
(1)确定元素原子的核外电子排布:如Li:I1≪I2r(Fe3+)。
(2)电子层结构相同的离子,核电荷数越大,半径越小。如r(O2-)>r(F-)>
r(Na+)>r(Mg2+)>r(Al3+)。
(3)带相同电荷的离子,电子层数越多,半径越大。如r(Li+)
相关试卷
这是一份②寒假预习-第12讲 芳香烃-2025年高二化学寒假衔接讲练 (人教版),文件包含②寒假预习-第12讲芳香烃教师版-2025年高二化学寒假衔接讲练人教版docx、②寒假预习-第12讲芳香烃学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
这是一份②寒假预习-第11讲 烯烃 炔烃-2025年高二化学寒假衔接讲练 (人教版),文件包含②寒假预习-第11讲烯烃炔烃教师版-2025年高二化学寒假衔接讲练人教版docx、②寒假预习-第11讲烯烃炔烃学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
这是一份②寒假预习-第10讲 烷烃-2025年高二化学寒假衔接讲练 (人教版),文件包含②寒假预习-第10讲烷烃教师版-2025年高二化学寒假衔接讲练人教版docx、②寒假预习-第10讲烷烃学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。









