



所属成套资源:2025年高二化学寒假衔接讲练 (人教版)
②寒假预习-第06讲 金属晶体和离子晶体-2025年高二化学寒假衔接讲练 (人教版)
展开
这是一份②寒假预习-第06讲 金属晶体和离子晶体-2025年高二化学寒假衔接讲练 (人教版),文件包含②寒假预习-第06讲金属晶体和离子晶体教师版-2025年高二化学寒假衔接讲练人教版docx、②寒假预习-第06讲金属晶体和离子晶体学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
【学习新知】
知识点一 金属键和金属晶体
1.金属键
(1)定义:______________和__________之间存在的强烈的相互作用称为金属键。
(2)本质:金属原子脱落下来的_______形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的__________维系在一起。这一理论称为“电子气理论”。
(3)成键粒子:____________和__________。
(4)存在:金属单质或合金。
(5)金属键的强弱和对金属性质的影响
①金属键的强弱主要取决于金属元素的原子半径和价电子数,原子半径越小,价电子数越多,金属键_______;反之,金属键_______。
②金属键越强,金属的熔、沸点_______,硬度_______。
2.金属晶体
(1)概念:金属阳离子与自由电子(“电子气”)之间通过_________形成的晶体叫做金属晶体。
(2)通性:金属晶体有优良的_______性、_______性和_______性。
(3)用“电子气理论”解释金属的性质
①延展性:当金属收到外力作用时,晶体中的各原子层就会发生相对滑动,但金属原子的排列方式不变,金属晶体中的化学键没有被破坏,所以金属有良好的延展性。
②导电性:在外加电场的作用下,金属晶体中的电子气做定向移动形成电流,呈现良好的导电性。
③导热性:电子气中自由电子在运动时会与金属离子不断发生碰撞,从而引起两者的能量交换。
(4)金属晶体中,除了纯金属,还有大量的合金。
(5)金属晶体有导电性,但能导电的晶体不一定是金属。
知识点二 离子晶体
1.定义:
由_________和_________相互作用而形成的晶体。
2.结构特点
(1)构成微粒:_________和_________。
(2)微粒间的作用力:_________。
3.常见离子晶体的结构类型
4.离子晶体的性质
【交流讨论】
以下是八种物质的熔点:
(1)①~④、⑤~⑧中物质的熔点为什么会逐渐降低?
(2)⑤~⑧中物质的熔点远高于①~④中物质的原因是什么?
【特别提示】
(1)离子晶体中不一定都含有金属元素,如NH4Cl是离子晶体。
(2)离子晶体中除离子键外不一定不含其他化学键,如NaOH晶体中还含有极性共价键,Na2O2晶体中还含有非极性共价键。
(3)由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是由金属元素Al和非金属元素Cl组成的分子晶体。
(4)含有金属离子的晶体不一定是离子晶体,如金属晶体中含有金属阳离子。
知识点三 过渡晶体和混合晶体
1.过渡晶体
(1)四种典型晶体是指_________晶体、_________晶体、_________晶体和_________晶体。
(2)过渡晶体:介于典型晶体之间的晶体。
2.混合型晶体(石墨晶体)
(1)晶体模型
(2)结构特点
①同层内,碳原子采用_________杂化,以_________相结合形成__________________结构。所有碳原子的p轨道相互平行且相互重叠,使p轨道中电子可在整个平面中运动。
②层与层之间以_________相结合。
(3)晶体类型
石墨晶体中,既有_________,又有_________,属于____________。
核心考点一:金属键和金属晶体
【例1】如图是金属晶体内部的电子气理论示意图。电子气理论可以用来解释金属的性质,其中正确的是( )
A.金属能导电是因为金属阳离子在外加电场作用下定向移动
B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导
C.金属具有延展性是因为在外力的作用下,金属中各原子层间会出现相对滑动,但自由电子可以起到润滑剂的作用,使金属不会断裂
D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合金的延展性比纯金属强,硬度比纯金属小
【归纳小结】
1.金属键
(1)金属键的特征
金属键无方向性和饱和性。晶体中的电子不专属于某一个或几个特定的金属阳离子,而几乎是均匀地分布在整块晶体中,因此晶体中存在所有金属阳离子与所有自由电子之间“弥漫”的电性作用,这就是金属键,因此金属键没有方向性和饱和性。
(2)金属键的强弱比较
一般来说,金属键的强弱主要取决于金属元素原子的半径和价电子数。原子半径越大,价电子数越少,金属键越弱;原子半径越小,价电子数越多,金属键越强。
2.金属晶体的性质
(1)金属晶体具有良好的导电性、导热性和延展性。
(2)熔、沸点:金属键越强,熔、沸点越高。
①同周期金属单质,从左到右(如Na、Mg、Al)熔、沸点升高。
②同主族金属单质,从上到下(如碱金属)熔、沸点降低。
③合金的熔、沸点一般比其各成分金属的熔、沸点低。
④金属晶体熔点差别很大,如汞常温下为液体,熔点很低;而铁常温下为固体,熔点很高。
(3)硬度:金属键越强,晶体的硬度越大。
【变式训练1】下列有关金属键的叙述中,错误的是( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
【变式训练2】根据下列晶体的相关性质,判断可能属于金属晶体的是( )
核心考点二:离子晶体
【例2】某离子晶体的晶体结构示意图如图,晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法错误的是( )
A.晶体中与每个A+距离最近的A+有12个
B.晶体中,阴离子与阳离子个数之比为1∶1
C.该离子晶体化学式为A2O2
D.晶体中,0价氧原子与-2价氧原子的数目比为3∶1
【归纳小结】常见离子晶体的晶胞结构
【变式训练1】下列有关离子晶体的数据大小比较不正确的是( )
A.离子键:NaF>NaCl>NaBr
B.硬度:MgO>CaO>BaO
C.熔点:NaF>MgF2>AlF3
D.1个阴离子周围等距离且最近的阳离子数:CsCl>NaCl>CaF2
【变式训练2】有关晶体的结构如图所示,下列说法中正确的是( )
A.在NaCl晶体中,距Na+最近的Cl-有8个
B.在CaF2晶体中,每个晶胞平均占有6个Ca2+
C.在金刚石晶体中,碳原子与碳碳键的个数比为1∶2
D.该气态团簇分子的分子式为EF或FE
核心考点三:过渡晶体和混合晶体
【例3】下列说法错误的是( )
A.Na2O中离子键的百分数为62%,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理;SiO2是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
【归纳小结】石墨晶体的结构
(1)结构特点——层状结构
①同层内碳原子采取sp2杂化,以共价键(σ键)结合,形成平面六元并环结构。
②层与层之间靠范德华力维系。
③石墨的二维平面结构内,每个碳原子的配位数为3,有一个未参与杂化的2p电子,它的原子轨道垂直于碳原子平面。
(2)晶体类型:石墨晶体中,既有共价键,又有金属键和范德华力,属于混合型晶体。
(3)性质:熔点很高、质软、易导电等。
(4)石墨的典型物理性质是导电性、润滑性和高熔、沸点,其熔点比金刚石的还高。
(5)石墨晶体中C原子数与C—C数之比为2∶3,即12 g石墨晶体中含1.5NA个C—C共价键。
【变式训练】航天飞机表层的防热瓦曾成为航天飞机能否安全着陆的制约因素,防热瓦是以石墨材料为主要成分的十分疏松的泡沫陶瓷。下列有关说法合理的是( )
A.石墨成为该泡沫陶瓷主要成分的主要原因是石墨是共价晶体
B.石墨成为该泡沫陶瓷主要成分的主要原因是石墨熔点很高
C.石墨中碳碳键之间的夹角是109°28′
D.C60也可代替石墨用作航天飞机表层的防热瓦材料
核心考点四:四种典型晶体比较
【例4】(1)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②SiO2的晶体类型为________________。
(2)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是________(填字母)。
A.SiX4难水解 B.SiX4是共价化合物
C.NaX都易水解 D.NaX的熔点一般高于SiX4
【归纳小结】
1.四种晶体类型的比较
2.晶体熔、沸点高低的比较方法
(1)不同类型晶体的熔、沸点
不同类型的晶体的熔、沸点高低,取决于组成晶体的微粒间的作用力大小,粒子间的作用力越大,晶体的熔、沸点越高;粒子间的作用力越小,晶体的熔、沸点越低。
一般共价晶体的熔、沸点最高,分子晶体的熔、沸点最低。离子晶体和金属晶体要根据物质构成粒子间的作用力大小判断,但一般介于上述两者之间。如SiO2>NaCl>干冰。
有的离子晶体熔点很高,如MgO。
有的金属晶体的熔点很高,如W、Cr等,有的金属晶体的熔点很低,如汞、Na、K等。
(2)同类晶体的熔沸点比较方法
①离子晶体:
一般地,化学组成、结构相似的晶体,离子所带电荷越多、半径越小,离子键越强,熔、沸点越高。如KF>KCl>KI;CaCl2>KCl。
②共价晶体:
共价晶体结构相似时,原子半径越小,键长越短,键能越大,熔、沸点越高。如金刚石>碳化硅>晶体硅。
③金属晶体:
金属晶体的核电荷数越多,原子半径越小,价电子数越多,则金属键越强,熔、沸点越高。如Al>Mg>Na>K。
一般合金的熔、沸点比其各成分金属的熔、沸点低。
④分子晶体:
a.分子晶体的熔沸点高、低由分子间作用力(氢键、范德华力)的强弱决定。比较分子晶体的熔、沸点,要先看是否有氢键形成,若形成分子间氢键,熔、沸点升高,若形成分子内氢键,则熔、沸点降低。
b.对于分子晶体,组成和结构相似的分子,相对分子质量越大,分子间作用力越大,晶体的熔、沸点越高。如CI4>CBr4>CCl4>CF4。
c.组成相似且相对分子质量相近的物质,分子的电荷分布越不均匀,范德华力越大,其熔、沸点就越高,如熔、沸点:CO>N2。
d.在同分异构体中,一般来说,支链越多,熔、沸点就越低,如沸点:正戊烷>异戊烷>新戊烷。
【变式训练1】下表给出几种化合物的熔点和沸点:
关于表中4种化合物有下列说法,其中正确的是( )
①AlCl3在加热时可升华
②CCl4属于分子晶体
③1 500 ℃时NaCl可形成气体分子
④AlCl3是典型的离子晶体
A.①②④ B.③④ C.①②③ D.①②③④
【变式训练2】下列物质的熔、沸点高低顺序中,正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅
C.MgO>H2O>O2>Br2
D.金刚石>生铁>纯铁>钠
【基础练】
1.金属晶体的形成是因为晶体中存在( )。
A.金属离子间的相互作用B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用D.自由电子间的相互作用
2.金属能导电的原因是( )。
A.金属晶体中金属阳离子与自由电子间的作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
3.关于晶体的下列说法中,正确的是( )。
A.共价晶体中可能含有离子键
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键,不含有共价键
D.任何晶体中,若含有阳离子就一定有阴离子
4.下列物质中,含有极性共价键的离子晶体是( )。
A.NaClB.C.D.NaOH
5.下列各物质的晶体中,晶体类型相同的是( )。
A.和B.NaCl和HCl
C.和D.和
6.下列性质中,能充分说明某晶体是离子晶体的是( )
A.具有较高的熔点B.固态不导电,水溶液能导电
C.可溶于水D.固态不导电,熔融状态能导电
7.如图所示,在氯化钠晶胞中,与每个等距离且最近的几个所围成的空间结构为( )
A.正八面体 B.十二面体C.正六面体D.正四面体
8.下列各组中的固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是( )
A.碘和碘化钠 B.金刚石和重晶石
C.冰醋酸和硬脂酸甘油酯 D.干冰和二氧化硅
9.下列说法中正确的是( )
A.C60汽化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.NaCl和HCl溶于水时,破坏的化学键都是离子键
D.常温下TiCl4是无色透明液体,熔点-23.2 ℃,沸点136.2 ℃,所以TiCl4属于离子晶体
10.表是第三周期部分元素氧化物和氟化物的熔点和摩氏硬度:
(1)两种氧化物MgO和SiO2的晶体类型分别是 、 。
(2)表格中几种氟化物熔点差异的主要原因是______________________________________。
(3)1ml SiO2中含有 mlSi﹣O键,Si和O原子配位数之比为 。
(4)NaF、MgF2、MgO、SiF4、SiO2中化学键能够代表分子真实组成的是 。
【提升练】
1.金晶体的晶胞如图所示。设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是( )
A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属原子尽可能采取密堆积
C.一个晶胞的体积是16 eq \r(2) d3
D.金晶体的密度是 eq \f(\r(2)M,d3NA)
2.下列数据是对应物质的熔点,有关的判断错误的是( )
A.含有金属阳离子的晶体不一定是离子晶体
B.同族元素的氧化物可形成不同类型的晶体
C.活泼金属元素与活泼非金属元素一定能形成离子化合物
D.金属晶体的熔点不一定比分子晶体的高
3.泽维尔研究发现,当用激光脉冲照射NaI,使Na+和I-两核间距为1.0~1.5 nm时,呈离子键;当两核靠近约距0.28 nm时,呈共价键。根据泽维尔的研究成果能得出的结论是( )
①NaI晶体是过渡晶体
②离子晶体可能含有共价键
③NaI晶体中既有离子键,又有共价键
④共价键和离子键没有明显的界线
A.①④ B.②③ C.①③ D.②④
4.如图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g·ml-1,则氯化铯晶体的密度为( )
A. eq \f(2M,NAa3) g·cm-3 B. eq \f(M,2NAa3) g·cm-3
C. eq \f(M,NAa3) g·cm-3 D. eq \f(Ma3,NA) g·cm-3
5.钾的化合物广泛存在于自然界中。回答下列问题:
(1)原子坐标参数可表示晶胞内部各原子的相对位置,金属钾是体心立方晶系,其结构如图。其中原子坐标参数A(0,0,0)、B(1,0,0),则C处原子的坐标参数为________。
(2)钾晶体的晶胞参数为a pm,阿伏加德罗常数的值为NA。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为________pm,晶体钾的密度计算式是________g·cm-3。
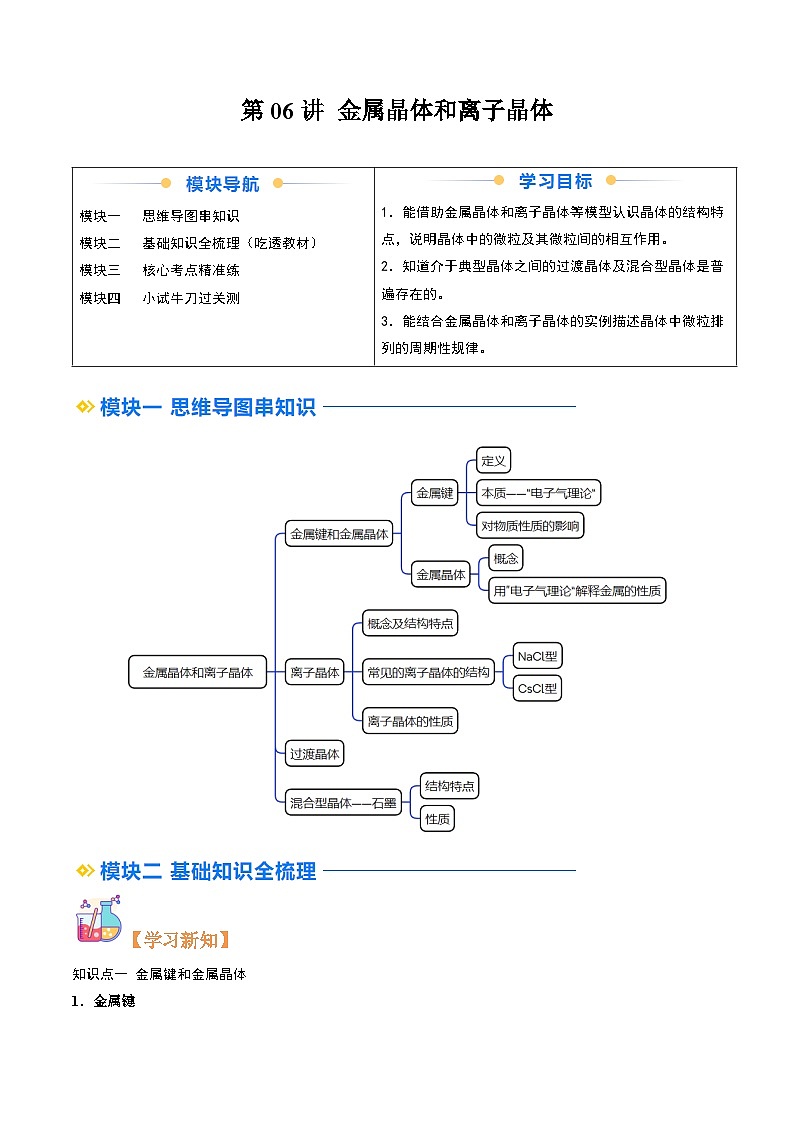
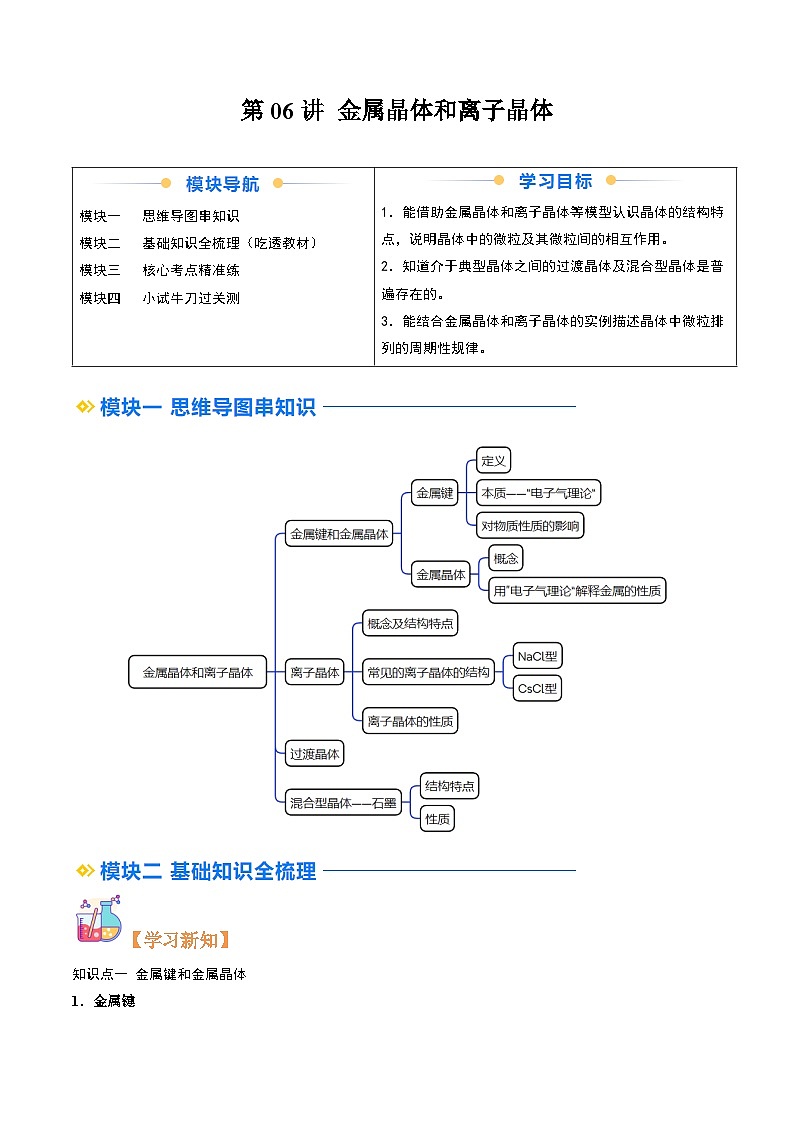
模块一 思维导图串知识
模块二 基础知识全梳理(吃透教材)
模块三 核心考点精准练
模块四 小试牛刀过关测
1.能借助金属晶体和离子晶体等模型认识晶体的结构特点,说明晶体中的微粒及其微粒间的相互作用。
2.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
3.能结合金属晶体和离子晶体的实例描述晶体中微粒排列的周期性规律。
晶体
NaCl
CsCl
晶胞
结构特点
1个Na+周围距离相等且最近的Cl-有____个;1个Cl-周围距离相等且最近的Na+有_____个
1个Cs+周围距离相等且最近的Cl-有____个;1个Cl-周围距离相等且最近的Cs+有____个
熔点
硬度
导电性
较大
不导电,但在___________或___________时导电
序号
①
②
③
④
⑤
⑥
⑦
⑧
物质
NaF
NaCl
NaBr
NaI
MgO
CaO
SrO
BaO
熔点/℃
993
801
747
661
2 852
2 614
2 430
1 918
选项
晶体的相关性质
A
由分子间作用力结合而成,熔点低
B
固态或熔融态时易导电,熔点在1 000 ℃左右
C
由共价键结合成空间网状结构,熔点高
D
固体不导电,但溶于水或熔融后能导电
晶体
晶胞
晶胞详解
NaCl
①在NaCl晶体中,Na+的配位数为6,Cl-的配位数为6
②与Na+(Cl-)等距离且最近的Na+(Cl-)有12个
③每个晶胞中有4个Na+和4个Cl-
④每个Cl-周围的Na+构成正八面体形结构
CsCl
①在CsCl晶体中,Cs+的配位数为8,Cl-的配位数为8
②每个Cs+与6个Cs+等距离且最近,每个Cs+与8个Cl-等距离且最近
类型
比较
分子晶体
共价晶体
金属晶体
离子晶体
构成粒子
分子
原子
金属阳离子和自由电子
阴、阳离子
粒子间的相互作用力
分子间作用力
共价键
金属键
离子键
硬度
较小
很大
有的很大,有的很小
较大
熔、沸点
较低
很高
有的很高,有的很低
较高
溶解性
相似相溶
难溶于任何溶剂
常见溶剂难溶
大多易溶于水等极性溶剂
导电、传热性
一般不导电,溶于水后有的导电
一般不具有导电性
电和热的良导体
晶体不导电,水溶液或熔融态导电
物质
NaCl
MgCl2
AlCl3
CCl4
熔点/℃
801
714
190
-22.9
沸点/℃
1 465
1 412
178
76.8
化合物
NaF
MgF2
MgO
SiF4
SiO2
熔点/K
1266
1534
3125
183
1983
摩氏硬度
3.2
6.0
6.5
7
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920 ℃
97.8℃
1 291℃
190 ℃
2 073℃
-107℃
-57℃
1 723℃
相关试卷
这是一份②寒假预习-第12讲 芳香烃-2025年高二化学寒假衔接讲练 (人教版),文件包含②寒假预习-第12讲芳香烃教师版-2025年高二化学寒假衔接讲练人教版docx、②寒假预习-第12讲芳香烃学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
这是一份②寒假预习-第11讲 烯烃 炔烃-2025年高二化学寒假衔接讲练 (人教版),文件包含②寒假预习-第11讲烯烃炔烃教师版-2025年高二化学寒假衔接讲练人教版docx、②寒假预习-第11讲烯烃炔烃学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
这是一份②寒假预习-第10讲 烷烃-2025年高二化学寒假衔接讲练 (人教版),文件包含②寒假预习-第10讲烷烃教师版-2025年高二化学寒假衔接讲练人教版docx、②寒假预习-第10讲烷烃学生版-2025年高二化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。









