

所属成套资源:2025年高一化学寒假衔接讲练 (人教版)
①寒假复习-专题01 物质及其变化-2025年高一化学寒假衔接讲练 (人教版)
展开
这是一份①寒假复习-专题01 物质及其变化-2025年高一化学寒假衔接讲练 (人教版),文件包含①寒假复习-专题01物质及其变化教师版-2025年高一化学寒假衔接讲练人教版docx、①寒假复习-专题01物质及其变化学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共69页, 欢迎下载使用。
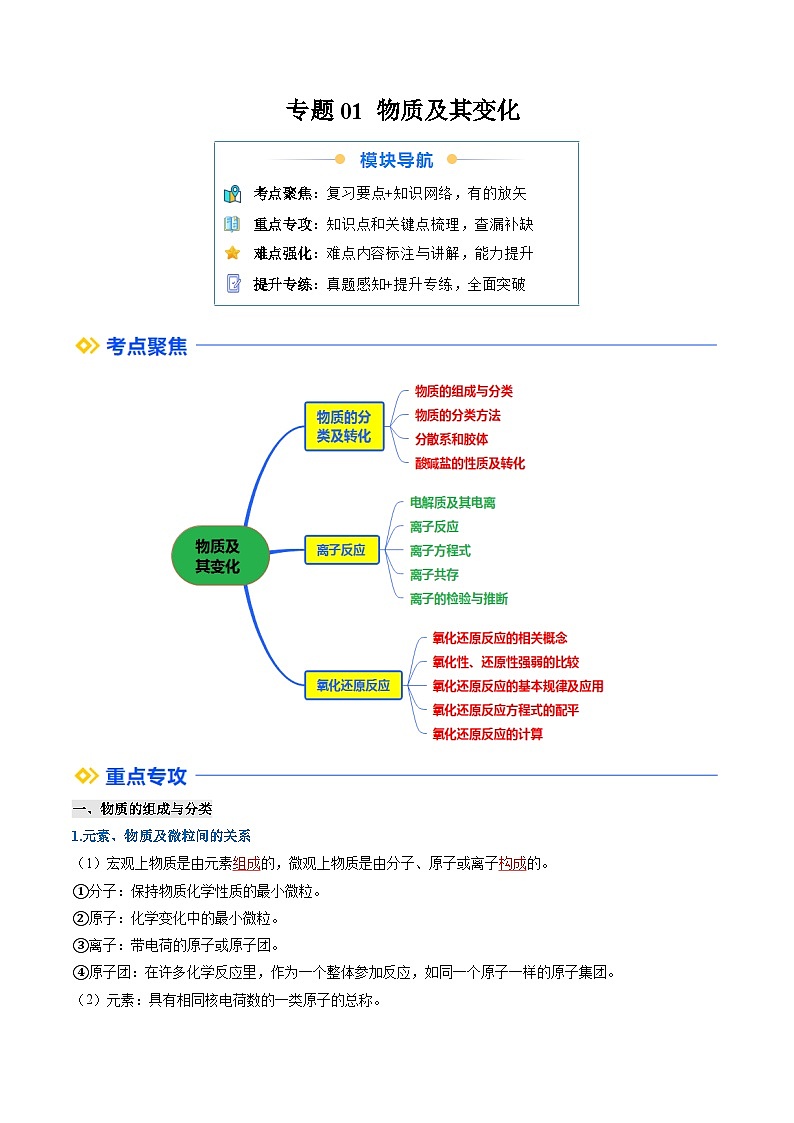
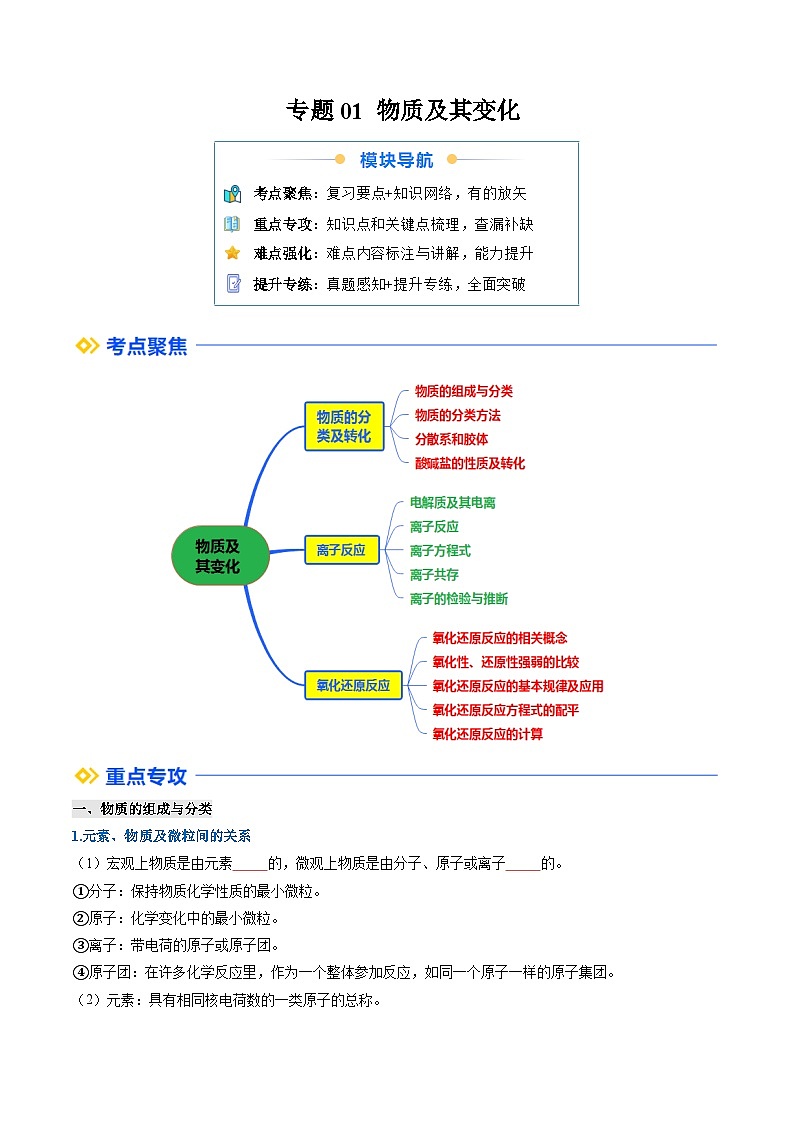
一、物质的组成与分类
1.元素、物质及微粒间的关系
(1)宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
①分子:保持物质化学性质的最小微粒。
②原子:化学变化中的最小微粒。
③离子:带电荷的原子或原子团。
④原子团:在许多化学反应里,作为一个整体参加反应,如同一个原子一样的原子集团。
(2)元素:具有相同核电荷数的一类原子的总称。
元素在自然界的存在形式有游离态和化合态。
①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
(3)元素与物质的关系
元素eq \(――→,\s\up7(组成))eq \b\lc\{\rc\ (\a\vs4\al\c1(单质:只由一种元素组成的纯净物。,化合物:由多种元素组成的纯净物。))
(4)原子与物质的关系
2.同素异形体
(1)概念:同种元素形成的不同单质叫同素异形体。
(2)形成方式
①原子个数不同,如O2和O3;
②原子排列方式不同,如金刚石和石墨。
(3)性质差异
物理性质差别较大,化学性质相似,同素异形体之间的转化属于化学变化。
3.混合物和纯净物
(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
(3)纯净物和混合物的区别
4.元素、微粒及物质间的关系图
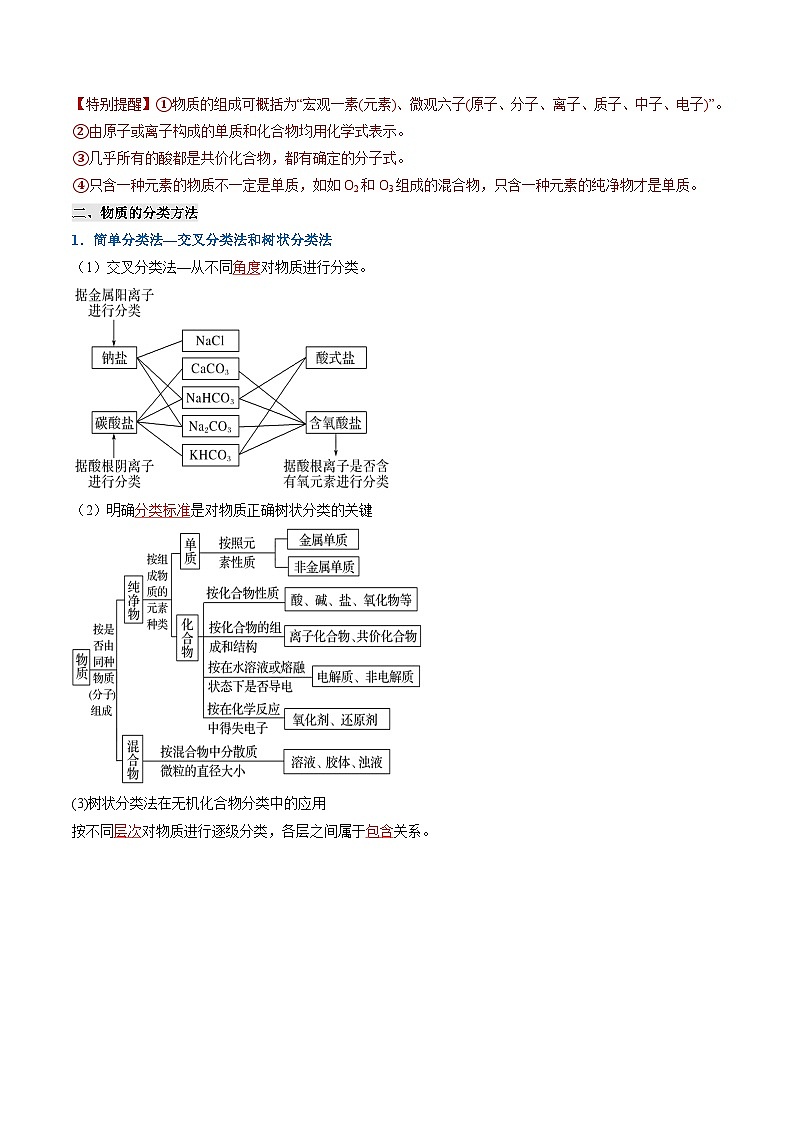
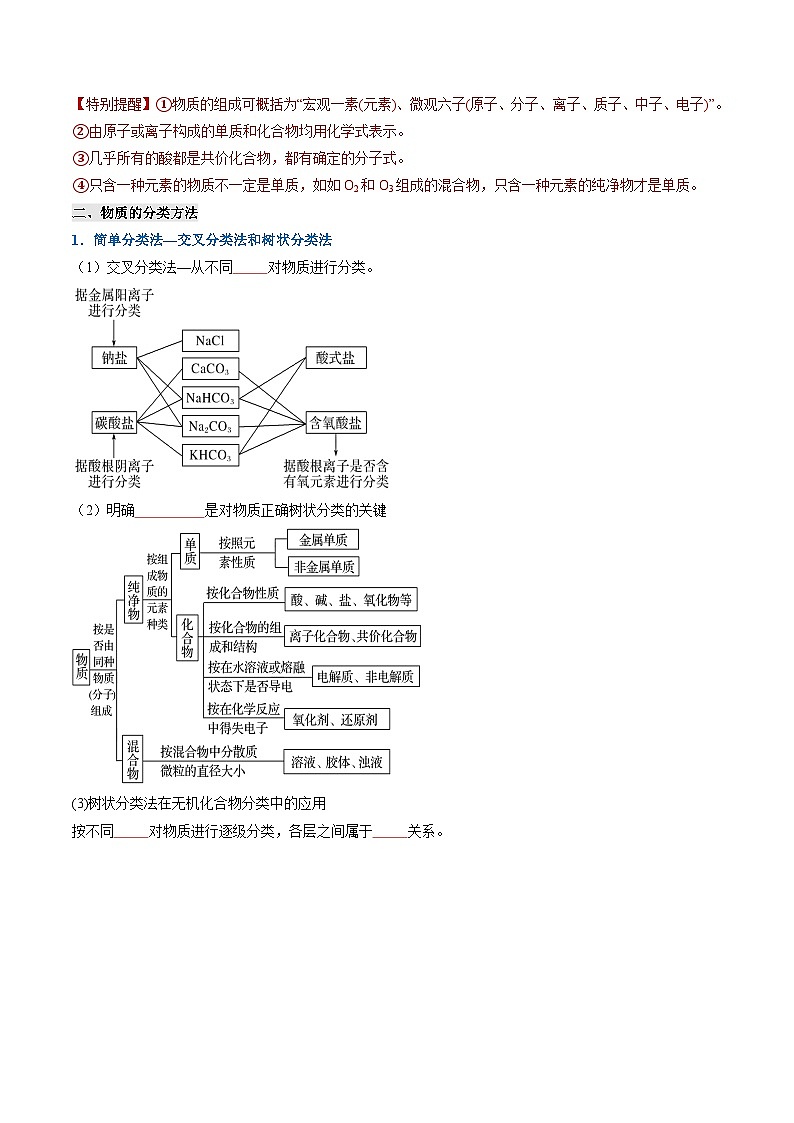
【特别提醒】①物质的组成可概括为“宏观一素(元素)、微观六子(原子、分子、离子、质子、中子、电子)”。
②由原子或离子构成的单质和化合物均用化学式表示。
③几乎所有的酸都是共价化合物,都有确定的分子式。
④只含一种元素的物质不一定是单质,如如O2和O3组成的混合物,只含一种元素的纯净物才是单质。
二、物质的分类方法
1.简单分类法—交叉分类法和树状分类法
(1)交叉分类法—从不同角度对物质进行分类。
(2)明确分类标准是对物质正确树状分类的关键
(3)树状分类法在无机化合物分类中的应用
按不同层次对物质进行逐级分类,各层之间属于包含关系。
2.正确理解几个“一定”“不一定”
(1)酸性氧化物和碱性氧化物
a.碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
b.酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
c.酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3)。
d.酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物,如乙酸酐[(CH3CO)2O]。
e.溶于水生成酸的氧化物不一定是酸性氧化物,如NO2;溶于水生成碱的氧化物不一定是碱性氧化物,如Na2O2。
(2)共价化合物和离子化合物
a.由非金属元素组成的化合物不一定是共价化合物,如铵盐。
b.由金属元素和非金属元素组成的化合物不一定是离子化合物,如AlCl3。
(3)纯净物和混合物
a.只含一种元素的物质不一定是纯净物,也可能是混合物,如O2和O3,金刚石和石墨,正交硫和单斜硫。
b.结晶水合物属于纯净物,如CuSO4·5H2O、KAl(SO4)2·12H2O等物质。
c.同位素形成的单质或化合物是纯净物,如H2与D2、H2O与D2O。
d.分子式为C5H10的物质存在多种同分异构体,可能是纯净物也可能是混合物。
3.对氧化物的深刻认识
(1)金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物。
(2)非金属氧化物不一定是酸性氧化物,如NO、CO是不成盐氧化物。
(3)酸性氧化物、碱性氧化物不一定能与水反应生成相应的酸或碱,如SiO2、Fe2O3都不溶于水,也不与水反应。
(4)与碱反应生成盐和水的氧化物不一定是酸性氧化物,如2NO2+2NaOH===NaNO3+NaNO2+H2O,NO2不是酸性氧化物。
三、分散系和胶体
1.分散系
(1)概念:一种(或多种)物质分散到另一种(或多种)物质中所得到的体系。被分散的物质称为分散质,起容纳分散质作用的物质称为分散剂,分散系都是混合物。
(2)分类:
①按照分散质粒子的大小,分为三种分散系
②按照分散质和分散剂的状态,分为9种分散系
如烟属于气固分散系;雾属于气液分散系;悬浊液属于液固分散系;合金属于固固分散系。
(3)三种分散系比较
2.胶体
(1)常见的胶体
(2)胶体的性质
①丁达尔效应:可见光束通过胶体时,在入射光侧面可看到一条光亮的通路,这是胶体粒子对光线散射而形成的,可用此性质来鉴别溶液和胶体。
②布朗运动:胶粒永不停息地做无规则运动的现象叫做布朗运动,是胶体稳定的次要原因。
③电泳:由于胶体粒子带有电荷,在电场作用下,胶体粒子在分散剂中作定向移动的现象。此性质可用于工业上的静电除尘。
(3)Fe(OH)3胶体的制备
①制备原理:FeCl3+3H2Oeq \(====,\s\up8(△))Fe(OH)3(胶体)+3HCl
②具体操作:用烧杯取少量蒸馏水,加热至沸腾;向沸水中逐滴加入适量的饱和FeCl3溶液;继续煮沸至溶液呈红褐色,停止加热,即得Fe(OH)3胶体。
③除去胶体中所含杂质
a.胶体中的悬浊液:过滤
b.胶体中的分子或离子:渗析
④实验方法证明Fe(OH)3胶体和Cl-两者已经分离完全:取最后一次渗析液与洁净的试管中,加入硝酸银溶液,若无白色沉淀产生,则说明两者已经完全分离。
四、酸、碱、盐的性质及转化
1.转化关系图
2.不同类别的无机物之间转化的一般规律
(1)金属单质及其化合物的转化
金属单质eq \(――→,\s\up7(O2))碱性氧化物eq \(――→,\s\up7(H2O))碱eq \(――→,\s\up7(酸))盐
如:Naeq \(――→,\s\up7(O2))Na2Oeq \(――→,\s\up7(H2O))NaOHeq \(――→,\s\up7(H2SO4))Na2SO4
符合上述转化关系的常见金属有Na、K、Ca、Ba等,但Mg、Fe、Al、Cu等不符合上述转化关系。
(2)非金属单质及其化合物的转化
非金属单质eq \(――→,\s\up7(O2))酸性氧化物eq \(――→,\s\up7(H2O))酸eq \(――→,\s\up7(碱))盐
如:Seq \(――→,\s\up7(O2))SO2eq \(――→,\s\up7(H2O))H2SO3eq \(――→,\s\up7(NaOH))Na2SO3
符合上述转化关系的常见非金属有C、S、P等,但N、Si等不符合上述转化关系。
五、电解质及其电离
1.电解质和非电解质
(1)电解质是在水溶液中或熔融状态下能够导电的化合物,酸、碱、盐属于电解质。
(2)非电解质是在水溶液中和熔融状态下都不能导电的化合物,如蔗糖、乙醇等。
(3)电解质与非电解质的比较
【易错警示】①电解质和非电解质均是化合物,单质和混合物既不是电解质,也不是非电解质。
②电解质不一定导电,如固态NaCl、液态HCl等;导电物质不一定是电解质,如铁、铝等金属单质。
③电解质一定是指自身电离生成离子的化合物,有些化合物的水溶液能导电,但溶液中的离子不是它自身电离产生的,不属于电解质,如CO2、SO2、NH3、SO3等非电解质。它们与水反应生成的产物H2CO3、H2SO3、NH3·H2O、H2SO4自身能电离,是电解质。
2.强电解质和弱电解质
(1)强电解质:在溶液中能够全部电离的电解质。则强电解质溶液中不存在电离平衡。
(2)弱电解质:在溶液中只是部分电离的电解质。则弱电解质溶液中存在电离平衡。
(3)强电解质与弱电解质的比较:
3.电解质的电离
(1)电离及其条件
①电离的概念:电解质在水溶液中或熔化状态下,离解成自由移动离子的过程。
②电离的条件:离子化合物溶于水或熔化或共价化合物溶于水。
③电离的结果:产生自由移动离子,具有导电性。
(2)电离方程式的书写
①强电解质:完全电离,用“===”表示。
如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为H2SO4===2H++SOeq \\al(2-,4)、NaOH===Na++OH-、(NH4)2SO4===2NHeq \\al(+,4)+SOeq \\al(2-,4)。
②弱电解质:部分电离,用“”表示。
多元弱酸分步电离 ,且电离程度逐步减弱,以第一步电离为主。
如H2S的电离方程式为H2SH++HS-;HS-H++S2-。
多元弱碱分步电离,但一步写出。如Cu(OH)2Cu2++2OH-。
③酸式盐:
强酸酸式盐完全电离,一步写出。如NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H++SOeq \\al(2-,4),
在熔融状态下的电离方程式为NaHSO4===Na++HSOeq \\al(-,4)。
多元弱酸酸式盐,第一步完全电离,其余部分电离。如NaHCO3===Na++HCOeq \\al(-,3),HCOeq \\al(-,3)H++COeq \\al(2-,3)。
4.电解质溶液的导电性
(1)电解质的导电原理
熔融电解质或电解质溶液中的导电微粒是自由移动的阴、阳离子,它们在外电场作用下能产生定向移动从而导电。
(2)电解质溶液导电能力大小的影响因素
①电解质溶液导电能力的大小取决于溶液中自由移动离子的浓度和离子的电荷数。
②温度升高时,弱电解质电离程度增大,离子浓度增大,导电性会增强;但强电解质溶液的导电性不变。
(3)电解质导电性与导电能力强弱的判断
六、离子反应
1.离子反应的概念:
凡有离子参加或生成的反应都是离子反应。
2.离子反应的本质:
溶液中某些离子的物质的量的减小或子种类发生改变。
3.离子反应发生的条件:
①复分解反应类型:
a.生成难溶的物质b.生成难电离的物质c.生成易挥发的物质
②氧化还原反应类型:
强氧化性物质+强还原性物质===弱氧化性物质+弱还原性物质。
如FeCl3溶液与Cu反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+。
③络合反应:生成稳定的络合物或络合离子。
如向FeCl3溶液中滴入KSCN溶液时反应的离子方程式为Fe3++3SCN-===Fe(SCN)3。
④盐类的水解反应:在溶液中盐电离出的离子与水电离出的H+或OH-结合生成弱电解质。
如NH4Cl水解离子方程式为NHeq \\al(+,4)+H2ONH3·H2O+H+。
⑤电化学反应:实质为氧化还原反应,但需要添加电解或通电条件。
七、离子方程式
1.离子方程式的概念:
用实际参加反应的离子符号来表示离子反应的式子.所谓实际参加反应的离子,即是在反应前后数目发生变化的离子。
2.离子方程式的意义:
离子方程式不仅表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。如:H++ OH-=H2O可以表示强酸与强碱反应生成可溶性盐的中和反应。
3.离子方程式书写步骤
书写离子方程式按照“写—拆—删—查”的步骤书写。应注意的是,第二步“拆”是关键:把易溶于水、易电离的物质拆写成离子形式,难溶、难电离、气体、单质、氧化物等仍用化学式表示。
4.离子方程式书写的基本方法(以CaCO3溶于盐酸为例)
(1)根据离子反应的实质直接写
第1步:分析反应物在溶液中电离产生的大量离子,CaCO3难溶于水,不能以大量离子的形式存在,盐酸中大量存在的离子为H+和Cl-。
第2步:分析反应的本质
CaCO3溶于盐酸的本质是CaCO3与H+反应生成CO2气体和水。
第3步:根据离子反应发生的条件或现象写出反应物和生成物的离子符号或物质(单质、氧化物、难溶物质、弱电解质、气体等)的化学式,并配平。
CaCO3+2H+===Ca2++CO2↑+H2O
第4步:检查方程式两边是否符合电荷守恒和原子守恒。
(2)根据化学方程式改写为离子方程式
八、离子共存
1.离子共存的实质
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.离子不能大量共存的原因
(1)离子之间相互结合生成难溶物质或微溶物。如Ca2+和CO32-生成CaCO3,H+和SiO32-生成H2SiO3,Cu2+和OH-生成Cu(OH)2等。
(2)离子之间相互结合生成气态物质及挥发性物质。如H+和S2-生成H2S,H+和HCO3-生成CO2等。
(3)离子之间相互结合生成弱电解质。如H+与CH3COO-、OH-、PO43-等分别结合生成弱电解质CH3COOH、H2O、H3PO4等。
(4)离子之间彼此促进水解。
①常见的因发生相互促进的水解反应而不能大量共存的离子如下:
a.Al3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-、HS-、AlOeq \\al(-,2)、SiOeq \\al(2-,3)。
b.Fe3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、AlOeq \\al(-,2)、SiOeq \\al(2-,3)。
②NHeq \\al(+,4)与CH3COO-、COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-等能发生相互促进的水解反应,但反应程度仍较小,能大量共存。
(5)离子之间发生氧化还原反应。如Fe2+、S2-、I-、SO32-分别与NO3-(H+)、ClO-因发生氧化还原反应而不能大量共存;Fe3+与S2-、I-等因发生氧化还原反应而不能大量共存。
(6)离子之间能发生络合反应。如Fe3+和SCN-不能大量共存。
3.常见的离子共存题限定条件
(1)溶液无色说明溶液中不存在大量的Cu2+、Fe2+、Fe3+、MnOeq \\al(-,4)、Cr2Oeq \\al(2-,7)、CrOeq \\al(2-,4)等。
(2)常见表示溶液呈酸性的描述
①常温下pH=1的溶液;②使pH试纸变红的溶液;③使甲基橙呈红色的溶液;④c(H+)=0.1 ml·L-1的溶液。
(3)常见表示溶液呈碱性的描述
①常温下pH=14的溶液;②使pH试纸变蓝的溶液;③使酚酞变红的溶液;④c(OH-)=0.1 ml·L-1的溶液。
(4)常见表示溶液既可能呈酸性又可能呈碱性的描述
①与铝粉反应放出氢气的溶液;②常温下,水电离出的c(OH-)=1×10-12 ml·L-1的溶液;③与NH4HCO3反应能产生气体的溶液。
九、离子的检验与推断
1.离子的检验
(1)常见离子的检验方法
根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
(2)离子检验中的常见干扰离子以及排除措施
【易错提醒】 ①向某溶液中加入BaCl2溶液后生成白色沉淀,再加入稀盐酸沉淀不消失,不能判断原溶液中一定存在SOeq \\al(2-,4),若原溶液中存在Ag+,也有相同的现象。
②向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,不能判断原溶液中一定存在COeq \\al(2-,3),若原溶液中存在SOeq \\al(2-,3)、HSOeq \\al(-,3)、HCOeq \\al(-,3)等,也有相同的现象。
③向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,不能判断原溶液中一定存在COeq \\al(2-,3),若原溶液中存在HCOeq \\al(-,3)、SOeq \\al(2-,3)、HSOeq \\al(-,3)等,也有相同的现象。
④向某溶液中滴入BaCl2溶液,产生白色沉淀,再加入稀HNO3,白色沉淀不溶解,不能确定原溶液中一定存在SOeq \\al(2-,4),若原溶液中存在SOeq \\al(2-,3)和Ag+,也有相同的现象。
⑤向某溶液中滴加氯水,再加入KSCN溶液,溶液变红色,原溶液中不一定存在Fe2+,检验Fe2+时,应先加KSCN,再加氯水,否则,Fe3+干扰结果的判断。
⑥做某溶液的焰色反应实验,火焰呈黄色,溶液中一定存在Na+,也可能存在K+,因为钾的焰色反应必须透过蓝色钴玻璃才能观察到。
2.离子的推断
(1)物质检验的一般步骤
eq \x(观察物理性质)→eq \x(取少量样品)→eq \x(加入某种试剂)→eq \x(加热、振荡等操作)→eq \x(根据现象)→eq \x(得出结论)
(2)物质检验的一般依据
任何具有明显实验现象差异的物理性质、化学性质都可作为物质检验的依据。在物质鉴定过程中常常是根据颜色的变化、是否有气体产生、能否溶解、有无沉淀、有无吸热或放热等现象来判断;还可以根据能不能产生某个现象来判断,也可以根据产生某个现象的快慢进行判断。
【特别提醒】必须注意两点:
①所加试剂引入的离子对后续实验的影响;
②用电荷守恒判断溶液中还可能含有的离子时要将定性与定量的方法相结合。
(3)电荷守恒在定量型离子推断试题中的应用
离子定量推断试题常根据离子的物质的量(或浓度)定量推断最后一种离子的存在:如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
十、氧化还原反应的相关概念及其表示方法
1.从化合价变化和电子转移的角度认识氧化还原反应
(1)氧化还原反应的本质和特征
(2)基于双线桥理解氧化还原反应概念之间的关系
(3)氧化还原反应的相关概念之间的关系
可概括为“氧、氧、得、降、还、还、还”。
(4)电子转移的表示方法
请分别用单线桥法和双线桥法表示Cu与稀硝酸反应中电子转移的方向和数目:
①双线桥法:①标变价 ②画箭头(反应物指向生成物) ③算数目 ④说变化。如铜和稀硝酸反应:
【特别提醒】a.箭头指向反应前后有元素化合价变化的同种元素的原子,且需注明“得到”或“失去”。
b.箭头的方向不代表电子转移的方向,仅表示电子转移前后的变化。
c.失去电子的总数等于得到电子的总数。
②单线桥法:①标变价 ②画箭头(由失电子原子指向得电子原子) ③算数目(线桥上只标电子转移的总数目,不标“得”“失”字样),如铜和稀硝酸反应:
【特别提醒】a.箭头从失电子元素的原子指向得电子元素的原子。
b.不标“得到”或“失去”,只标明电子转移的总数。
c.线桥只出现在反应物中。
(5)氧化还原反应与四种基本类型反应间的关系
【特别提醒】(1)有单质参与的化合反应是氧化还原反应。
(2)有单质生成的分解反应是氧化还原反应。
(3)有单质参加或生成的化学反应,不一定是氧化还原反应,如3O2eq \(=====,\s\up8(放电),\s\d3( ))2O3。
(4)所有的置换反应都是氧化还原反应。
(5)所有的复分解反应都不是氧化还原反应。
2.从元素价态和物质结构的角度认识氧化剂和还原剂
(1)常见氧化剂
常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
【特别提醒】
①O2、O3在水溶液中的还原产物,其中酸性条件下是H2O,中性、碱性条件下是OH-;而当还原产物为固态时是O2-或Oeq \\al(2-,2)。
②浓硝酸的还原产物是NO2,稀HNO3的还原产物是NO。
(2)常见还原剂
常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
(3)元素化合价处于中间价态的物质既有氧化性,又有还原性
其中:Fe2+、SOeq \\al(2-,3)主要表现还原性,H2O2主要表现氧化性。
【易错提醒】
①根据化合价的高低可判断物质是否具有氧化性或还原性,但不能判断氧化性或还原性的强弱。元素处于最高价态时只有氧化性,但不一定有强氧化性,如Na+、SOeq \\al(2-,4);同理,元素处于最低价态时也不一定具有强还原性。
②非金属阴离子不一定只具有还原性,如Oeq \\al(2-,2)既有氧化性又有还原性。金属阳离子不一定只具有氧化性,如Fe2+既有还原性又有氧化性。
3.氧化还原反应概念的“五个误区”
误区一:某元素由化合态变为游离态时,该元素不一定被还原,也不一定被氧化。因为元素处于化合态时,其化合价可能为正,也可能为负。若元素由负价变为0价,则其被氧化,若元素由正价变为0价,则其被还原。
误区二:在氧化还原反应中,非金属单质不一定只作氧化剂,大部分非金属单质往往既具有氧化性又具有还原性,只是以氧化性为主。如在反应Cl2+H2OHCl+HClO中,Cl2既表现氧化性又表现还原性。
误区三:物质的氧化性或还原性的强弱取决于元素原子得失电子的难易程度,与得失电子数目的多少无关。
误区四:氧化还原反应中的反应物不一定都是氧化剂或还原剂,有的反应物可能既不是氧化剂也不是还原剂。如Cl2+H2OHCl+HClO,H2O既不是氧化剂,也不是还原剂。
误区五:在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,也可能是同一元素既被氧化又被还原。如:2Na2O2+2H2O===4NaOH+O2↑中,Na2O2既是氧化剂又是还原剂,氧元素一部分化合价升高,一部分化合价降低。
十一、氧化性、还原性强弱的比较
1.氧化性、还原性的概念
(1)氧化性是指物质得电子的性质(或能力);还原性是指物质失电子的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。如:Na-e-===
Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,故Na比Al的还原性强。
(3)从元素的价态考虑:
最高价态——只有氧化性,如:Fe3+、H2SO4、KMnO4等;
最低价态——只有还原性,如:金属单质、Cl-、S2-等;
中间价态——既有氧化性又有还原性,如:Fe2+、S、Cl2等。
2.氧化性、还原性强弱的比较方法
(1)依据氧化还原反应方程式判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
(2)依据反应条件及反应的剧烈程度判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。如:
MnO2+4HCl(浓)eq \(=====,\s\up7(△))MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
O2+4HCl(浓)eq \(=====,\s\up11(催化剂),\s\d4(△))2Cl2+2H2O
氧化性:KMnO4>MnO2>O2
2Na+2H2O===2NaOH+H2↑ Mg+2H2Oeq \(=====,\s\up7(△))Mg(OH)2+H2↑
还原性:Na>Mg
(3)依据被氧化还原的程度判断
相同条件下:
a.不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
例如:Fe+Seq \(=====,\s\up7(△))FeS,2Fe+3Cl2eq \(=====,\s\up8(点燃))2FeCl3 ,可以得出氧化性:Cl2>S
b.不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如:
eq \b\lc\ \rc\](\a\vs4\al\c1(Cu+2Fe3+===Cu2++2Fe2+,3Zn+2Fe3+===3Zn2++2Fe))→eq \x(\a\al(还原性,Zn>Cu))
(4)依据“三表”判断
a.根据元素周期表判断
b.根据金属活动顺序表
c.根据非金属活动性顺序表判断
eq \(,\s\up7(F2 Cl2 O2 Br2 I2 S),\s\d7(得电子能力逐渐减弱,氧化性逐渐减弱))
eq \(,\s\up7(F- Cl- Br- I- S2-),\s\d7(失电子能力逐渐增强,还原性逐渐增强))
十二、氧化还原反应的基本规律及应用
1.守恒规律及其应用
(1)规律
氧化还原反应遵循以下三个守恒规律:
①质量守恒:反应前后元素的种类和质量不变。
②电子守恒:即氧化剂得电子的总数等于还原剂失电子的总数,这是配平氧化还原反应方程式的依据,也是有关氧化还原反应计算的依据。
③电荷守恒:离子方程式中,反应物中各离子的电荷总数与产物中各离子的电荷总数相等。书写氧化还原反应的离子方程式时要注意满足电荷守恒,如Fe3++Cu===Fe2++Cu2+(错误),2Fe3++Cu===2Fe2++Cu2+(正确)。
(2)应用
eq \b\lc\{\rc\ (\a\vs4\al\c1(①直接计算反应物与产物或与转移电子的数量关系。如用铜电极电解Na2SO4溶液,其阳、阴极产物及转移, 电子关系式为:Cu2+~2e-~H2~2OH-,②配平氧化还原反应方程式))
2.价态规律及其应用
(1)高低规律
元素在物质中所处的价态,决定该元素的氧化性或还原性,一般来说,元素处于最高价态时,只有氧化性(如KMnO4、HNO3等);元素处于最低价态时,只有还原性(如S2-、I-等);元素处于中间价态时,既有氧化性又有还原性(如Fe2+、SO2等)。
(2)价态归中规律
内容:同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
(3)歧化反应规律
氧化还原反应中,有元素化合价升高,必然有元素化合价降低。歧化反应时,某元素的中间价态―→高价态+低价态。
3.强弱规律及其应用
(1)物质氧化性或还原性的强弱决定于得失电子的难易程度,与得失电子的数目无关。
(2)根据氧化还原反应方程式进行判断
还原剂 + 氧化剂 = 氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。
(3)应用
①判断有氧化性和还原性的物质在一定条件下能否反应:以Zn为例,Zn可以与Fe2+、Sn2+、H+、Cu2+等发生置换反应,但不能与Mg2+、Al3+等反应。
②同一氧化剂与多种还原剂混合时,还原性强的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,氯气的量不足时首先氧化I-。
同一还原剂与多种氧化剂混合时,氧化性强的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
4.先后规律及其应用
(1)规律
①同时含有几种还原剂时eq \(――→,\s\up7(加入氧化剂))将按照还原性由强到弱的顺序依次反应。如:在FeBr2溶液中通入少量Cl2时,因为还原性Fe2+>Br-,所以Fe2+先与Cl2反应。
②同时含有几种氧化剂时eq \(――→,\s\up7(加入还原剂))将按照氧化性由强到弱的顺序依次反应。如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后依次为Cu2+、H+。
(2)应用
eq \b\lc\{\rc\ (\a\vs4\al\c1(①可判断物质发生氧化还原反应的先后顺序,②判断某氧化还原反应中物质氧化性、还原性的相对强弱,③判断某氧化还原反应能否正常进行))
(3)常见的强弱顺序
氧化性:MnOeq \\al(-,4)(H+)>Cl2>Br2>Fe3+>I2>稀H2SO4>S,还原性:Mn2+
相关试卷
这是一份③寒假提升练-专题06 物质的量-2025年高一化学寒假衔接讲练 (人教版),文件包含③寒假提升练-专题06物质的量教师版-2025年高一化学寒假衔接讲练人教版docx、③寒假提升练-专题06物质的量学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
这是一份③寒假提升练-专题03 氧化还原反应-2025年高一化学寒假衔接讲练 (人教版),文件包含③寒假提升练-专题03氧化还原反应教师版-2025年高一化学寒假衔接讲练人教版docx、③寒假提升练-专题03氧化还原反应学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共39页, 欢迎下载使用。
这是一份③寒假提升练-专题02 离子反应-2025年高一化学寒假衔接讲练 (人教版),文件包含③寒假提升练-专题02离子反应教师版-2025年高一化学寒假衔接讲练人教版docx、③寒假提升练-专题02离子反应学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共42页, 欢迎下载使用。









