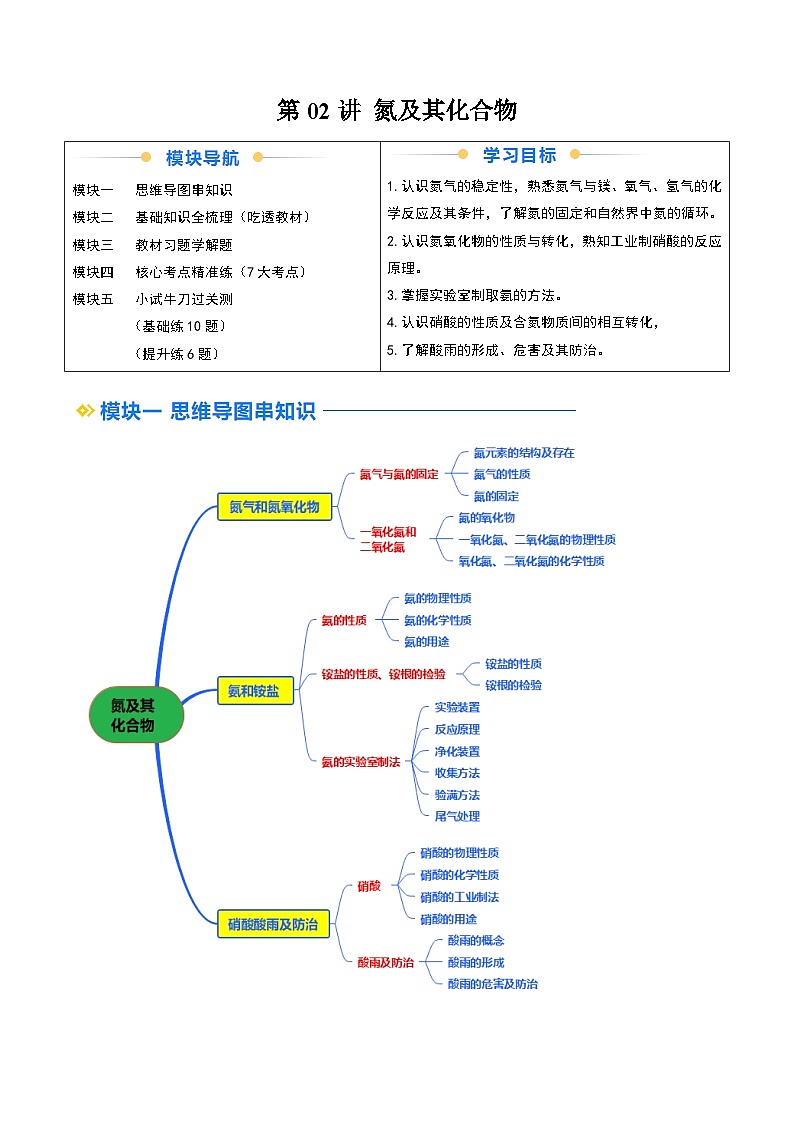

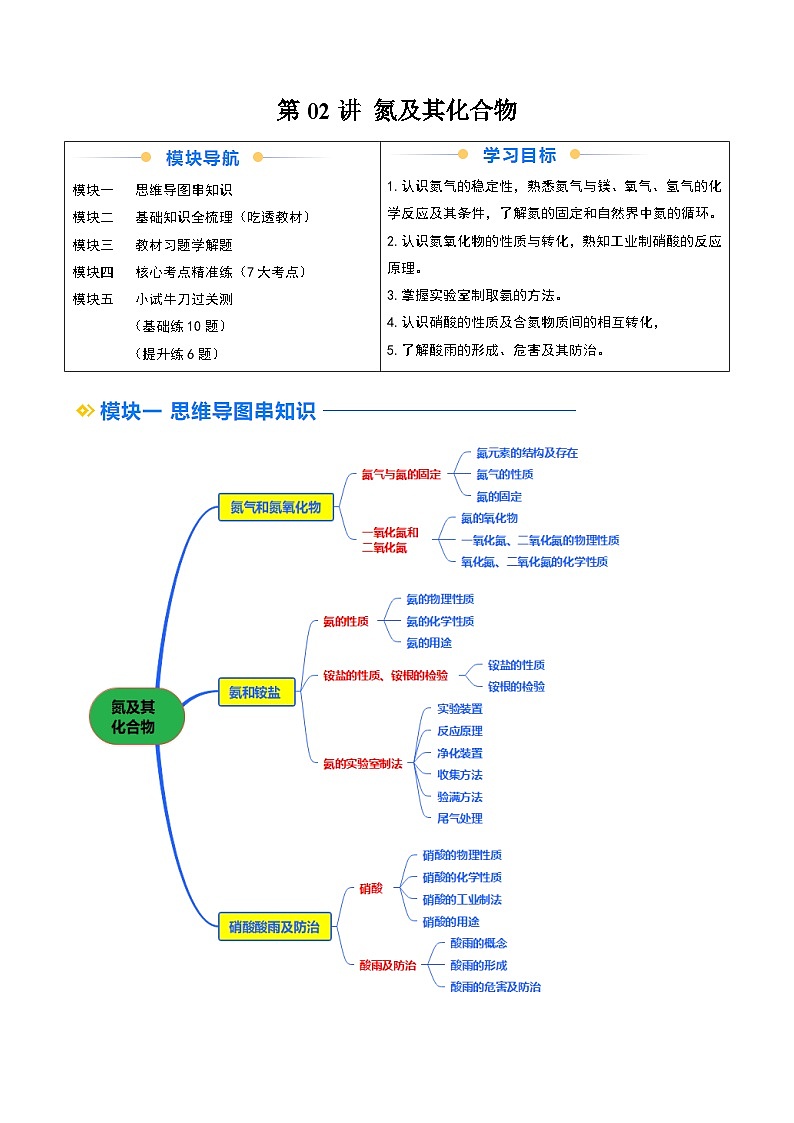

所属成套资源:2025年高一化学寒假衔接讲练 (人教版)
②寒假预习-第02讲 氮及其化合物-2025年高一化学寒假衔接讲练 (人教版)
展开
这是一份②寒假预习-第02讲 氮及其化合物-2025年高一化学寒假衔接讲练 (人教版),文件包含②寒假预习-第02讲氮及其化合物教师版-2025年高一化学寒假衔接讲练人教版docx、②寒假预习-第02讲氮及其化合物学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
第1课时 氮气和氮氧化物
一、氮气与氮的固定
1.氮元素的结构及存在
(1)氮元素位于元素周期表的第 周期、第 族。氮原子最外层有 个电子,既不容易 3个电子,也不容易 5个电子。一般通过 与其他原子相互结合成物质。
(2)氮元素在自然界中的存在
氮元素主要以 分子的形式存在于空气中,部分氮元素以化合物的形式存在于动植物体内的 中,还有部分存在于土壤、海洋里的 和 中。
2.氮气的性质
(1)物理性质
通常情况下,氮气是 、 的气体,密度比空气的 , 于水。
(2)化学性质
氮分子内两个氮原子间以共价三键(N≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很 ,通常情况下很难与其他物质发生化学反应,但在 、 等条件下,氮气也可以与镁、氧气、氢气等物质发生化合反应。写出氮气与下列物质反应的化学方程式。
①金属镁:N2+3Mgeq \(=====,\s\up7(点燃))Mg3N2,氮气表现 性;
②氢气:N2+3H2eq \(,\s\up8(高温、高压),\s\d3(催化剂))2NH3,氮气表现 性;
③氧气:N2+O2eq \(=======,\s\up7(放电或高温))2NO,氮气表现 性。
(3)用途
①氮气常用作保护气,如焊接金属、填充灯泡、保存食品等。
②氮气是合成氨、制硝酸的重要原料。
③液氮可用作制冷剂,应用于医学、科技等领域。
3.氮的固定
(1)含义:将大气中 的氮转化为 的过程。
(2)分类
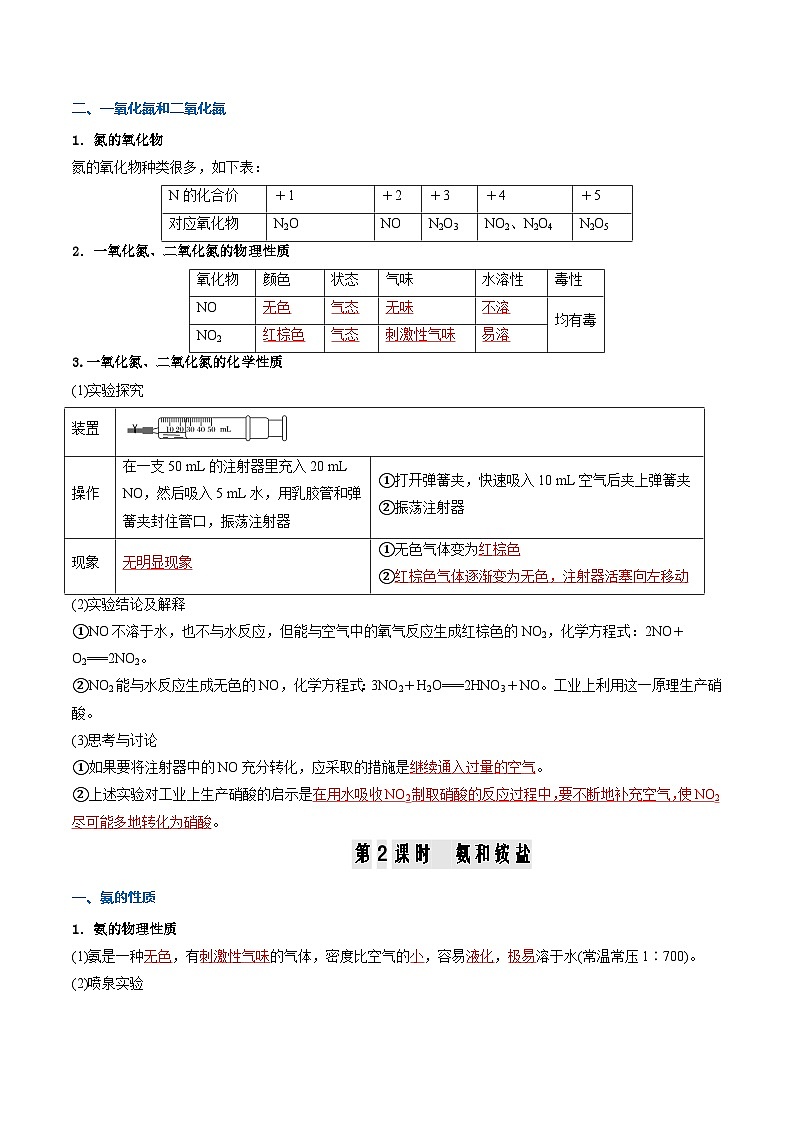
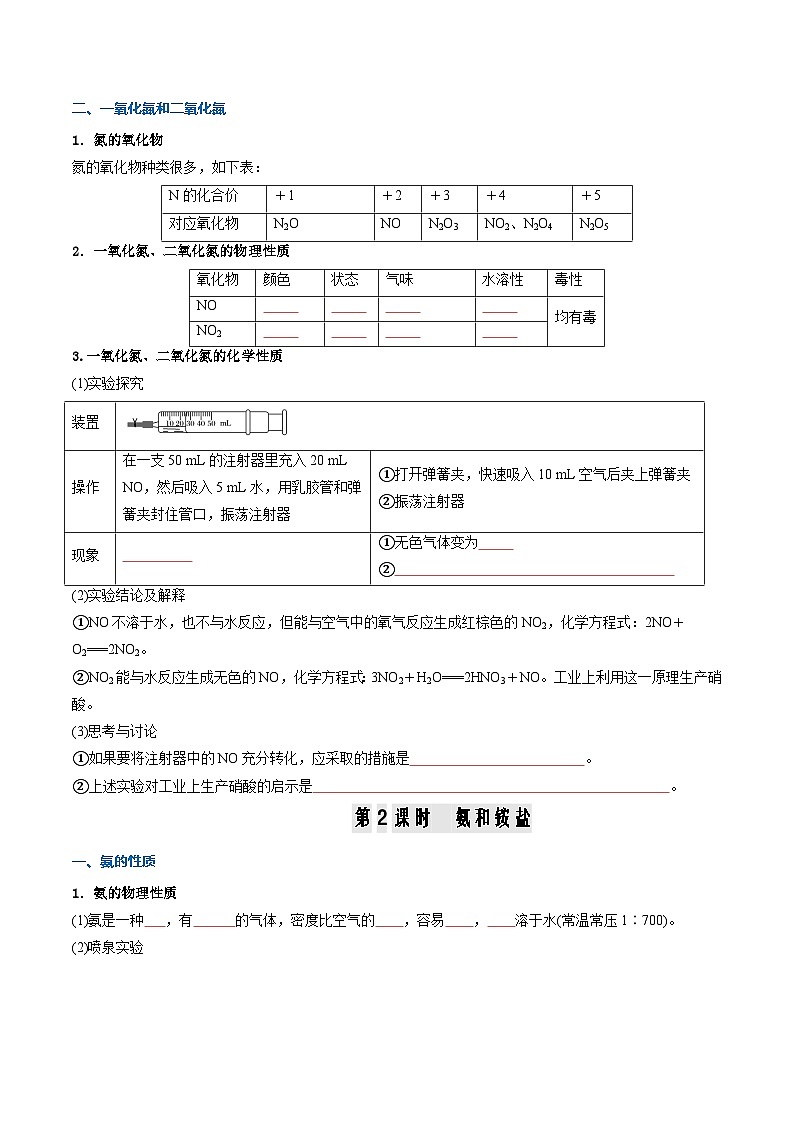
二、一氧化氮和二氧化氮
1.氮的氧化物
氮的氧化物种类很多,如下表:
2.一氧化氮、二氧化氮的物理性质
3.一氧化氮、二氧化氮的化学性质
(1)实验探究
(2)实验结论及解释
①NO不溶于水,也不与水反应,但能与空气中的氧气反应生成红棕色的NO2,化学方程式:2NO+O2===2NO2。
②NO2能与水反应生成无色的NO,化学方程式:3NO2+H2O===2HNO3+NO。工业上利用这一原理生产硝酸。
(3)思考与讨论
①如果要将注射器中的NO充分转化,应采取的措施是 。
②上述实验对工业上生产硝酸的启示是 。
第2课时 氨和铵盐
一、氨的性质
1.氨的物理性质
(1)氨是一种 ,有 的气体,密度比空气的 ,容易 , 溶于水(常温常压1∶700)。
(2)喷泉实验
实验操作:如图,打开橡胶管上的弹簧夹,挤压胶头滴管,使少量水进入烧瓶。
实验现象:烧杯中的溶液由玻璃管进入烧瓶,形成 ,烧瓶内液体颜色呈 。
实验结论:氨 溶于水,水溶液呈 。
原理解释:氨 溶于水,使烧瓶内的压强 ,导致烧杯中的水在大气压的作用下进入烧瓶。
2.氨的化学性质
(1)氨与水的反应
氨的水溶液俗称 ,显 性,反应的方程式为NH3+H2ONH3·H2ONHeq \\al(+,4)+OH-。
(2)氨与酸的反应
两根分别蘸取浓氨水和浓盐酸的玻璃棒,靠近时,产生 ,反应方程式为NH3+HCl===NH4Cl。
(3)氨具有还原性
①氨的催化氧化,反应化学方程式:4NH3+5O2eq \(=====,\s\up7(催化剂),\s\d5(△))4NO+6H2O,NH3在反应中作 。
②氨可在加热条件下和氧化铜反应生成铜和氮气,反应的化学方程式为2NH3+3CuOeq \(=====,\s\up7(△))3Cu+N2+3H2O。
3.氨的用途
(1)氨易 ,液氨常用作制冷剂。
(2)氨是氮肥工业和硝酸工业的重要原料。
二、铵盐的性质、铵根的检验
1.铵盐的性质
(1)概念:由铵根离子(NHeq \\al(+,4))和酸根离子构成的化合物,如(NH4)2SO4、NH4HCO3、NH4NO3等。铵盐是农业上常用的化肥。
(2)物理性质:绝大多数铵盐都是白色或无色晶体,且 于水。
(3)化学性质
①受热易分解
NH4Cleq \(=====,\s\up7(△))NH3↑+HCl↑(生成的NH3和HCl遇冷又结合生成NH4Cl);
NH4HCO3eq \(=====,\s\up7(△))NH3↑+H2O+CO2↑。
②与碱反应
与碱溶液在不加热条件下反应:NHeq \\al(+,4)+OH-===NH3·H2O;
与碱溶液在加热条件下反应:NHeq \\al(+,4)+OH-eq \(=====,\s\up7(△))NH3↑+H2O。
如NH4Cl和Ca(OH)2在加热条件下反应的化学方程式为2NH4Cl+Ca(OH)2eq \(=====,\s\up7(△))CaCl2+2NH3↑+2H2O。
2.铵根的检验
(1)实验探究
(2)铵盐(NHeq \\al(+,4))的检验流程
eq \x(铵盐NH\\al(+,4))eq \(――→,\s\up7(强碱),\s\d5(△))eq \x(无色气体NH3)eq \(――――→,\s\up7(湿润的红色),\s\d5(石蕊试纸))eq \x(试纸变蓝)
三、氨的实验室制法
1.实验装置
2.反应原理: 。
3.净化装置
4.收集方法: 收集。
5.验满方法
(1)把湿润的红色石蕊试纸置于试管口,试纸变 ;
(2)将蘸有浓盐酸的玻璃棒置于试管口,有 产生。
6.尾气处理
可在导管口放一团用 浸湿的棉花球。
第3课时 硝酸 酸雨及防治
一、硝酸
1.硝酸的物理性质
硝酸是 、 挥发、有 气味的液体。
2.硝酸的化学性质
(1)酸的通性
写出HNO3与下列物质反应的离子方程式
①与碱(如NaOH): 。
②与碱性氧化物(如Na2O): 。
③与弱酸盐(如CaCO3): 。
(2)不稳定性
浓硝酸见光或受热易分解,化学方程式为 ;
长期存放的浓硝酸呈黄色是因为其分解生成的NO2溶于硝酸中,实验室常将浓硝酸保存在 试剂瓶中,并放置在 处。
(3)强氧化性
①实验探究:浓HNO3和稀HNO3与铜的反应
②钝化
常温下,铁、铝的表面被浓HNO3或浓H2SO4氧化,生成一层致密的氧化物薄膜,阻止了酸与内层金属的进一步反应。所以常温下可以用铁或铝制容器来盛装浓HNO3或浓H2SO4。当加热时,铁、铝会与浓HNO3或浓H2SO4发生反应。
③浓HNO3与非金属(碳)的反应
化学方程式: 。
3.硝酸的工业制法
写出上述转化的化学方程式,并指出含氮物质发生的是氧化反应还是还原反应:
①N2+3H2eq \(,\s\up8(高温、高压),\s\d3(催化剂))2NH3,N2发生 反应。
②4NH3+5O2eq \(=====,\s\up7(催化剂),\s\d5(△))4NO+6H2O,NH3发生 反应。
③2NO+O2===2NO2,NO发生 反应。
④3NO2+H2O===2HNO3+NO,NO2既发生 反应,又发生 反应。
4.硝酸的用途
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
二、酸雨及防治
1.酸雨的概念
正常雨水的pH约为5.6,这是因为雨水中溶解了 的缘故。pH<5.6的降水称为酸雨。
2.酸雨的形成
(1)大气中的 、 及它们在大气中发生反应后的生成物溶于雨水而形成酸雨。
(2)酸雨的形成过程
Ⅰ.写出硫酸型酸雨的形成过程中转化的化学方程式:
①SO2→SO3:2SO2+O2eq \(\s\d4(△),,\s\up11(催化剂))2SO3。
②SO2→H2SO3:SO2+H2OH2SO3。
③SO3→H2SO4:SO3+H2O===H2SO4。
④H2SO3→H2SO4:2H2SO3+O2===2H2SO4。
Ⅱ.写出硝酸型酸雨形成过程中转化的化学方程式:
①NO→NO2:2NO+O2===2NO2。
②NO2→HNO3:3NO2+H2O===2HNO3+NO。
3.酸雨的危害及防治
(1)酸雨的危害
①直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化。
②加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀。
③导致地下水中重金属元素含量增加,污染水源,危害人体健康。
(2)酸雨的防治
①消除污染源,改变能源结构,开发利用清洁能源,如太阳能、风能、氢能等。
②对酸性物质的排放加以控制,如燃料脱硫处理,废气中二氧化硫回收利用、控制汽车尾气排放等。
③健全法律法规,严格规定污染物的排放标准,提高环境保护意识。
核心考点一:氮的固定
【例1】 氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料。自然界中存在如图所示的氮元素的循环过程,下列说法不正确的是( )
A.过程①“雷电作用”中发生的反应是N2+O2eq \(=====,\s\up7(放电))2NO
B.过程③“固氮作用”中,氮气被还原
C.⑤中涉及的反应可能有2NOeq \\al(-,2)+O2===2NOeq \\al(-,3)
D.⑥中涉及的反应可能有2NOeq \\al(-,3)+12H+===N2↑+6H2O
核心考点二:二氧化氮的性质
【例2】 在NO2与水的反应中( )
A.氮元素的化合价不发生变化
B.NO2只是氧化剂
C.NO2只是还原剂
D.NO2既是氧化剂又是还原剂
核心考点三:一氧化氮的性质
【例3】 下列关于一氧化氮的叙述正确的是( )
A.一氧化氮是一种红棕色气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
核心考点四:氨的性质
【例4】 下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨极易溶于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使酚酞试剂变为红色
核心考点五:铵盐的性质及铵根检验
【例5】 能把Na2SO4溶液、NH4NO3溶液、KCl溶液、(NH4)2SO4溶液这四种无色溶液区分开的一种试剂是(必要时可加热)( )
A.Ba(OH)2溶液 B.NaOH溶液
C.NaCl溶液 D.Ba(NO3)2溶液
核心考点六:氨的实验室制法
【例6】 下列装置能达到实验目的的是( )
A.用装置甲制备氨
B.用装置乙除去氨中少量水
C.用装置丙收集氨
D.用装置丁吸收多余的氨
核心考点七:硝酸的性质
【例7】 下列反应中硝酸既能表现出酸性又表现出氧化性的是( )
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
核心考点八:酸雨及防治
【例8】 下列环境问题与产生的主要原因不相符的是( )
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③
C.全部 D.只有②
【基础练】
1.(江苏省宿迁市2023-2024学年高一期末调研)在给定条件下,下列物质间所示的转化可以实现的是
A.
B.
C.
D.
2.(山东省临沂市2023-2024学年高一期中)氮及其化合物的转化具有重要应用。下列说法不正确的是
A.自然固氮、人工固氮都是将N2转化为NH3
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl
C.汽车尾气催化转化器中发生的主要反应:2NO+2CON2+2CO2
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
3.(浙江省浙东北联盟2023-2024学年高一联考)下列气体中,既能用浓硫酸又能用碱石灰干燥的是
A.B.C.D.
4.(江苏省盐城市射阳二中2023-2024学年高一期末)下列制备NH3并制取氨水的装置正确且能达到实验目的的是
A.制取NH3B.干燥NH3
C.收集NH3D.制取氨水
5.(广西柳州市2023-2024学年高一联考)硝酸是重要的化工原料,用于制化肥、农药、炸药、燃料等,工业上制硝酸的原理如下图所示,下列说法正确的是
A.反应①实现了氮的固定B.反应②中,被还原
C.不能直接被氧化生成NOD.反应④中只是还原剂
6.(四川省成都市七中2022-2023学年高一期中)“封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是
A.加热时,①中上部汇集了白色固体
B.加热时,②中溶液变红,冷却后又变为无色
C.3个反应均为可逆反应
D.加热时③中溶液逐渐变为无色
7.(辽宁省大连市二中2022-2023学年高一期末)只用一种试剂即可鉴别Na2SO4、NaCl、(NH4)2SO4、AlCl3四种溶液,这种试剂是
A.氨水B.Ba(OH)2溶液C.NaOH溶液D.AgNO3溶液
8.(湖南省株洲市2023-2024学年高一联考)有关氨水的说法正确的是
A.氨水的主要成分是NH3·H2O,无NH3
B.氨水呈碱性的原因是NH3·H2ONH+OH-
C.氨气能发生喷泉实验的原因是NH3与水发生了反应
D.将氨水加热,氨水的浓度变大
9.(四川省乐山第一中学2023-2024学年高一月考)下列说法中,正确的是
A.NO2能与水反应生成硝酸,故NO2为酸性氧化物
B.除去O2中混有的NO2,可将混合气体通过水,将NO2溶解
C.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是NO2,得橙色溶液的为溴蒸气
D.NO2是造成光化学烟雾的原因之一
10.(四川省成都第一中学2023-2024学年高一期中)下列关于硫和氮及其化合物叙述正确的是
A.空气中排放过量SO2会形成酸雨,酸雨的PH
相关试卷
这是一份③寒假提升练-专题07 铁及其化合物-2025年高一化学寒假衔接讲练 (人教版),文件包含③寒假提升练-专题07铁及其化合物教师版-2025年高一化学寒假衔接讲练人教版docx、③寒假提升练-专题07铁及其化合物学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
这是一份③寒假提升练-专题05 氯及其化合物-2025年高一化学寒假衔接讲练 (人教版),文件包含③寒假提升练-专题05氯及其化合物教师版-2025年高一化学寒假衔接讲练人教版docx、③寒假提升练-专题05氯及其化合物学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
这是一份③寒假提升练-专题04 钠及其化合物-2025年高一化学寒假衔接讲练 (人教版),文件包含③寒假提升练-专题04钠及其化合物教师版-2025年高一化学寒假衔接讲练人教版docx、③寒假提升练-专题04钠及其化合物学生版-2025年高一化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共39页, 欢迎下载使用。









