










所属成套资源:【陕青宁】2025届高三八省联考全学科真题含答案
- 【陕青宁】2025届高三八省联考历史真题答案 试卷 1 次下载
- 【陕青宁】2025届高三八省联考地理真题答案 试卷 2 次下载
- 【陕青宁】2025届高三八省联考思想政治真题答案 试卷 1 次下载
- 【陕青宁】2025届高三八省联考数学真题答案 试卷 2 次下载
- 【陕青宁】2025届高三八省联考物理真题答案 试卷 2 次下载
【陕青宁】2025届高三八省联考化学真题答案
展开
这是一份【陕青宁】2025届高三八省联考化学真题答案,文件包含2025届高三八省联考化学试题docx、2025届高三八省联考化学试题pdf、2025届高三八省联考化学答案docx、2025届高三八省联考化学答案pdf等4份试卷配套教学资源,其中试卷共71页, 欢迎下载使用。
参照机密级管理*启用前
陕西省 2025 年高考综合改革适应性演练
化学
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,
用橡皮擦干净后,再选涂其他答案标号。 回答非选择题时,将答案写在答题卡上。 写在本试 卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: H1 C12 N14 O16 Si28
一、选择题: 本题共 14 小题,每小题 3 分,共 42 分 。在每小题给出的四个选项中, 只有一
项是符合题目要求的。
1. 化学学科在创新中不断前进 ,下列说法错误的是
A. 伏打研制了第一个化学电源 ,该装置实现了电能到化学能的转化
B. 鲍林提出了甲烷的正四面体结构
C. 侯德榜改进了索尔维制碱法 ,侯氏制碱法经济环保
D. 神舟十九号载人飞船使用了国产耐烧蚀树脂,该树脂为高分子材料 【答案】AB
【解析】
【详解】A .伏打研制了第一个化学电源,该装置实现了化学能到电能的转化,A 错误;
B .范霍夫提出了甲烷的正四面体结构 ,而鲍林提出的杂化轨道理论很好地解释了甲烷的正四面体结构 ,B 错误;
C .侯德榜改进了索尔维制碱法,侯氏制碱法完美的弥补了索尔维制碱法的不足 ,不仅提高了食盐利用率, 减少了对环境的污染,还缩短了生产流程、 降低了纯碱的成本,故侯氏制碱更经济环保 ,C 正确;
D .树脂属于合成有机高分子材料 ,D 正确; 答案选 AB。
2. 下列化学用语表示正确的是
A. 氯化氢的电子式:
百师联盟
B. CO2 和SO2 的 VSEPR 模型均为:
C. 基态 Cr 原子价层电子的轨道表示式:
D. 中子数为 20 的氯原子的核素符号: Cl
【答案】D 【解析】
, A 错误;
【详解】A .氯化氢是共价化合物 ,其电子式为:
B .二氧化碳的价层电子对是 2 ,没有孤电子对,则其 VSEPR 模型是直线型 ,B 错误;
C .Cr 是 24 号元素,价电子排布式为 3d54s1 ,价电子的轨道表示式为: ,C
错误;
D . 中子数为 20 的氯原子的质量数为 37 ,可表示为: Cl ,D 正确;
故选 D。
3. 规范操作是实验安全的保障 ,下列做法错误的是
A. 不能用手直接接触试剂 , 以免危害健康和污染试剂 B. 使用浓硝酸等挥发性试剂时在通风橱中操作
C 金属钠着火,迅速用湿抹布覆盖灭火
.
D. 点燃可燃性气体前 , 需要验纯 【答案】C
【解析】
【详解】A .固体试剂一般用镊子或药匙取用 ,液体药品一般用滴管取用,不能用手直接接触试剂 , 以免危 害健康和污染试剂 ,A 正确;
B . 易挥发有毒试剂的取用一般在通风橱中操作 ,B 正确;
C .金属钠着火不能用湿抹布覆盖灭火,因为钠遇水会发生剧烈反应 ,产生氢气并可能导致爆炸 ,正确的做 法是使用干燥的细沙覆盖扑灭,C 错误;
D .可燃性气体在点燃或加热之前都要验纯 , 以免发生爆炸,D 正确; 答案选 C。
4. 下列物质在一定条件下的转化关系如图所示 。E 、G 、Q 、R 均为气体 ,其中R 为红棕色。 下列说法正确
百师联盟 的是
A. E 、G 、Q 、R 、T 所含同种元素化合价依次升高
B. E 的水溶液能导电,所以E 是电解质
C. Q 和 E 可用排水法收集
D. 铜与不同浓度的 T 溶液反应均可生成 Q 【答案】A
【解析】
【分析】 由图可知 ,E 、G 、Q 、R 、T 均为含氮化合物,故 E 为 NH3 、G 为 N2 、Q 为 NO ,R 为 NO2 ,T 为HNO3;
【详解】A . 由分析可知:E 、G 、Q 、R 、T 所含同种元素化合价依次升高,A 符合题意;
B .E 为 NH3 , NH3 是非电解质,B 不符合题意;
C .E 为 NH3 , NH3 极易溶于水,不能排水集气 ,C 不符合题意;
D .铜和浓硝酸反应的还原产物是二氧化氮 ,铜和稀硝酸反应的还原产物是一氧化氮 ,D 不符合题意; 故选A;
5. 一定温度下,恒容密闭容器中,物质 Z 发生反应 Z(g) ≈ X(g) +2Y(g) ΔH > 0 ,一段时间后开始计时, 测得各物质的浓度随时间变化如图所示。 下列说法正确的是
A. 曲线Ⅰ代表物质 X , 曲线Ⅲ代表物质 Z
B. 图中 t1 时刻的正反应速率大于 t 2 时刻
C. 若升高温度,正反应速率加快,逆反应速率减慢
百师联盟
D. 0 ~ 40 min ,用物质 Y 表示的平均反应速率为 0.3mml . L—1 . min—1
【答案】B 【解析】
【分析】结合反应方程式以及图中物质的浓度变化 ,减少的为反应物 ,增加的为生成物 ,生成物的浓度增 加量之比等于化学计量数之比,可知曲线Ⅲ代表反应物 Z , 曲线Ⅰ代表物质 Y ,曲线Ⅱ代表物质 X ,据此分析 解答。
【详解】A . 曲线Ⅰ代表物质 Y , 曲线Ⅲ代表反应物 Z ,故 A 错误;
B . t1 时刻反应物的浓度大于 t 2 时刻 ,浓度越大反应速率越快,则 t1 时刻的正反应速率大于 t 2 时刻 ,故 B 正确;
C .升高温度,正反应速率加快,逆反应速率也加快 ,故 C 错误;
D .0 ~ 40 min ,用物质 Z 表示的平均反应速率为 = 0.3mml . L—1 . min—1 ,根据
速率之比等于化学计量数之比可知物质 Y 表示的平均反应速率为 v(Y)=2v(Z)=0.6mml . L—1 . min—1 ,故 D 错误;
故选:B。
6. 物质结构决定性质。 下列物质性质差异与结构因素没有关联的是
A. A B. B C. C D. D
【答案】B 【解析】
【详解】A . BF3 是平面三角形 , PCl3 是三角锥型,极性和分子空间构型有关联 ,故 A 不符合题意;
选项
性质差异
结构因素
A
极性: BF3 < PCl3
分子空间构型
B
酸性: 二氯乙酸 S8
晶体类型
D
识别 K+ 的能力: 18-冠-6>12-冠-4
冠醚空腔直径
百师联盟
B . 由于 F 的电负性比 Cl 大, 吸引电子的能力更强,三氟乙酸羧基中的O-H 键的极性更大 ,更易电离出 H+ ,酸性更强,酸性和分子间氢键没有关联 ,故 B 符合题意;
C . NaCl 是离子晶体, S8 是分子晶体,离子晶体一般来说比分子及个体熔点高,熔点和晶体类型有关联, 故 C 不符合题意;
D .18-冠-6 空腔的直径与 K+ 的直径相当,12-冠-4 空腔的直径小于 K+ 的直径,所以识别 K+ 的能力与冠醚空 腔直径有关联 ,故 D 不符合题意;
答案选 B。
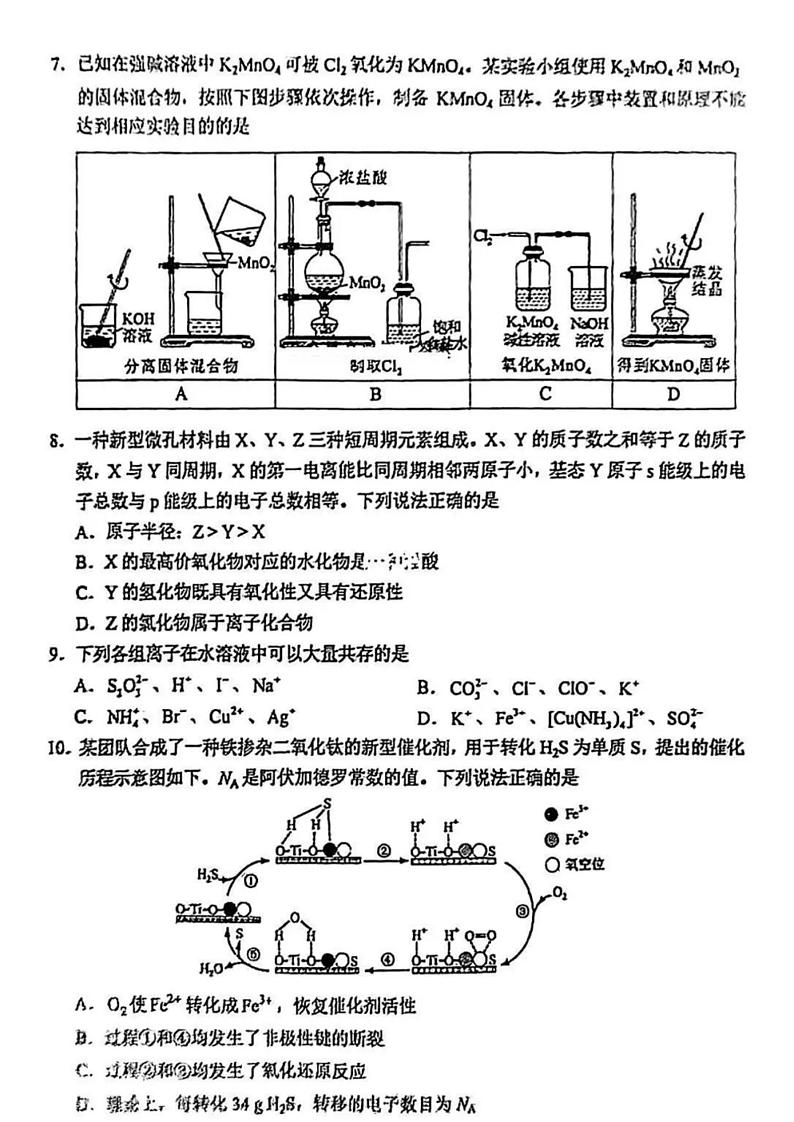
7. 已知在强碱溶液中K2MnO4 可被Cl2 氧化为KMnO4 。某实验小组使用K2MnO4 和MnO2 的固体混合 物,按照下图步骤依次操作 ,制备KMnO4 固体。 各步骤中装置和原理不能达到相应实验目的的是
A. A B. B C. C D. D
【答案】D 【解析】
【详解】A . K2MnO4 溶于 KOH 溶液中形成K2MnO4 碱性溶液 ,而 MnO2 不溶于水 ,可用过滤分离出溶 液中的 MnO2 ,A 选项正确;
B.实验室利用二氧化锰和浓盐酸加热条件下反应生成氯气,再利用饱和食盐水除去氯气中混有的 HCl 杂质, B 选项正确;
A.分离固体混合 物
B.制取 Cl2
C.氧化 K2MnO4
D.得到 KMnO4 固 体
百师联盟
C .在强碱溶液中K2MnO4 可被Cl2 氧化为KMnO4 , 因此将氯气通入到K2MnO4 碱性溶液中可制备得到 KMnO4 ,此外氯气有毒,用 NaOH 溶液进行尾气处理 ,C 选项正确;
D . KMnO4 受热易分解,应该用蒸发浓缩,冷却结晶的方式得到KMnO4 固体 ,D 选项错误; 故选 D。
8. 一种新型微孔材料由 X 、Y 、Z 三种短周期元素组成。X 、Y 的质子数之和等于 Z 的质子数 ,X 与 Y 同周 期,X 的第一电离能比同周期相邻两原子小 ,基态 Y 原子 s 能级上的电子总数与 p 能级上的电子总数相等。 下列说法正确的是
A. 原子半径: Z > Y > X B. X 的最高价氧化物对应的水化物是一种强酸
C. Y 的氢化物既具有氧化性又具有还原性 D. Z 的氯化物属于离子化合物
【答案】C 【解析】
【分析】X 、Y 、Z 三种短周期元素,X 与 Y 同周期 ,Y 原子核外 s 能级上的电子总数与 p 能级上的电子总 数相等,则 Y 可能为 1s22s22p4 或 1s22s22p63s2,为氧或镁,X、Y 的质子数之和等于 Z 的质子数,则 Y 为氧, X 的第一电离能比同周期相邻两原子小 ,X 为硼 ,那么Z 为铝;
【详解】A .电子层数越多半径越大 ,电子层数相同时,核电荷数越大,半径越小;原子半径: Al > B > O , A 错误;
B .X的最高价氧化物对应的水化物为硼酸,是一种弱酸,B 错误;
C .Y 的氢化物中过氧化氢或水,其中氢化合价能降低、 氧化合价能升高,则既具有氧化性又具有还原性, C 正确;
D .Z 的氯化物为氯化铝 ,属于共价化合物 ,D 错误; 故选 C。
9. 下列名组离子在水溶液中可以大量共存的是
A. S2 O- 、H+ 、I- 、Na + B. CO- 、 Cl- 、 ClO- 、K+
C. NH 、Br- 、 Cu2+ 、Ag+ D. K+ 、Fe3+、Cu (NH3 )4 7」2+ 、SO-
【答案】B 【解析】
【详解】A . S2 O- 、H+ 反应生成硫单质和二氧化硫 ,不能大量共存,A 错误;
B . CO- 、 Cl- 、 ClO- 、K+ 互不反应 ,可以大量共存,B 正确;
百师联盟
C . Br- 、Ag+ 会生成溴化银沉淀 ,不能大量共存,C 错误;
D . Fe3+ 在 大量存在的溶液中会生成氢氧化铁沉淀,不能大量共存 ,D 错误;
故选 B。
10. 某团队合成了一种铁掺杂二氧化钛的新型催化剂,用于转化H2S 为单质 S,提出的催化历程示意图如下。 NA 是阿伏加德罗常数的值。 下列说法正确的是
A. O2 使 Fe2+ 转化成 Fe3+ ,恢复催化剂活性
B. 过程①和④均发生了非极性键的断裂
C. 过程②和③均发生了氧化还原反应
D. 理论上,每转化34gH2S ,转移的电子数目为 NA
【答案】A 【解析】
【详解】A .根据图示③④两步历程 ,可知O2 使 Fe2+ 转化成 Fe3+ ,恢复催化剂活性 ,A 正确;
B .过程①中没有发生非极性键的断裂 ,过程④中发生了 O=O 非极性键的断裂,B 错误;
C .过程②中铁元素化合价发生变化 ,发生氧化还原反应 ,过程③中元素化合价没有变化 ,没有发生氧化还 原反应,C 错误;
催化剂
D.根据图示,该催化历程的总反应为 2H2 S+O2 = 2S+2H2 O ,可知 H2 S ~ 2e- ,理论上,每转化34gH2S 即1mlH2 S ,转移的电子数目为2NA ,D 错误;
故选 A。
11. 科研人员在高温高压条件下合成了类金刚石结构的硼碳氮化合物,其晶胞结构如图所示,立方晶胞参数
百师联盟
为apm 。 NA 是阿伏加德罗常数的值。 下列说法错误的是
A. 该化合物为共价晶体,硬度大
B. 晶体中与 B 原子距离最近且相等的 B 原子数为 4
C. 晶胞中 C — C 键与 C — N 键的数目比为 2 :1
D. 晶体的密度g . cm—3
【答案】C 【解析】
【分析】由图可知,按均摊法,N 原子数目为 = 2 ,B 原子数目为 2,C 原子数目为+ 2 = 4 ,
则 N 、B 、 C 原子数目之比为 1:1:2 ,化学式为 BC2N;
【详解】A .该晶体具有类金刚石结构,金刚石是由碳原子通过共价键形成的共价晶体 ,具有硬度大、熔沸 点高等性质,则该化合物为共价晶体 ,硬度大 ,A 正确;
B .如图所示:将晶胞平移, 以 b 点的 B 为坐标原点: ,则 B 原子距离最近且相
等的 1 个 B 原子 a 位于面心 ,其余两个面心为 C 原子 ,根据晶胞结构可知,若面心上全部都是 B ,B 原子
距离最近且相等的 B 原子数为3× 8 + = 12,但面心上的 B 只占了 ,因此 B 原子距离最近且相等的 B 原子
数为 4 ,B 正确;
百师联盟
C . 如图所示:
以 m 点的C 原子为研究对象,其形成 2 条 C — C 键,两条 C — N
键,则二者数目比为1:1 ,C 不正确;
D . 晶胞的密度=晶体的密度g. cm—3 ,D 正确;
答案选 C。
12. 化合物 M 是一种新型抗生素关键中间体的类似物,其合成路线如下(略去部分试剂和反应条件) 。已知化 合物 K 虚线圈内所有原子共平面。 下列说法错误的是
A. Q 的化学名称为 2-甲基-1-丙醇 B. 在酸性条件下 ,M 可水解生成 CO2
C. K 中氮原子的杂化方式为 sp2 D. 形成 M 时,氮原子与 L 中碳原子 a 成键
【答案】D 【解析】
【详解】A .Q 为饱和一元醇 ,命名时 ,从靠近羟基碳原子的一端开始编号 , 即羟基碳原子的位次为“1”, 则其化学名称为 2-甲基-1-丙醇 ,A 正确;
B.M 分子中,左侧环上存在酯基和酰胺基,在酸性条件下两种官能团都发生水解反应,M 可水解生成 H2CO3, H2CO3 分解生成 CO2 和水 ,B 正确;
C .题中信息显示,化合物 K 虚线圈内所有原子共平面,则 N 原子的最外层孤电子对未参与杂化,N 原子 的杂化方式为 sp2 ,C 正确;
D .对照L 和 M 的结构可以看出,形成 M 时,L 分子中 18O 与 b 碳原子之间的共价键断裂,则氮原子与 L 中碳原子 b 成键 ,D 错误;
故选 D。
13. 为了从海水中提取锂,某团队设计了图示的电解池 。保持电源正负极不变 ,每运行一段时间后 ,将电极
1 与 4 取下互换 , 电极 2 与 3 取下互换 ,实现锂的富集。 下列说法正确的是
百师联盟
A. 电路中电子的流向随着电极互换而改变
B. 电极 2 上发生的反应为: Ag - e- = Ag+
C. 理论上, 电极 1 与电极 4 的质量之和保持不变
D. 理论上, 电路通过1ml 电子时,有 0.5mlLi+ 富集在右侧电解液中
【答案】C 【解析】
【分析】为从海水中提取锂 , 电极 1 的电极反应式为:FePO4+e-+Li+=LiFePO4 ,则电极 1 为阴极 ,则电极 2 为阳极, 电极 3 为阴极 , 电极 4 为阳极,在电极 4 上发生氧化反应:LiFePO4-e-=Li++FePO4 ,实现了锂的提 取。
【详解】A .保持电源正负极不变,则电子流向不变 ,故 A 错误;
B . 由分析可知 , 电极 2 为阳极,海水中有 Cl- ,则电极 2 的电极反应式为:Ag-e-+Cl-=AgCl ,故 B 错误;
C . 由分析可知,通过相同电量 , 电极 1 上附着的 Li+ 的量和电极 4 上失去的 Li+ 的量相等 ,所以理论上, 电 极 1 与电极 4 的质量之和保持不变,故 C 正确;
D .根据电子守恒, 电路中各处的电量相等 ,所以理论上, 电路通过1ml 电子时,有 1mlLi+ 富集在右侧
电解液中 ,故 D 错误; 故答案为: C。
14. 常温下, AgIO3 和Pb(IO3 )2 的沉淀溶解平衡曲线如图所示 。纵坐标中 M 代表 Ag+ 或 Pb2+ ,物质的溶 解度以物质的量浓度表示。 下列说法正确的是
百师联盟
A. a 点有 AgIO3 沉淀生成 ,无Pb(IO3 )2 沉淀生成
B. 表示Pb(IO3 )2 在纯水中溶解度的点在线段 bc 之间
C. 向AgIO3 悬浊液中滴加AgNO3 溶液、 向Pb(IO3 )2 悬浊液中滴加Pb(NO3 )2 溶液 ,分别至 c 点时, AgIO3 和Pb(IO3 )2 的溶解度均为 10-5.09 ml .L-1
D. c (IO3-) = 0. 1ml . L-1 时, AgIO3、Pb(IO3 )2 饱和溶液中 = 10-4.09
【答案】C 【解析】
【分析】 由 Ksp(AgIO3 )=c(Ag+ )c(IO3- ) 和KspL「Pb(IO3 )2 =c(Pb2+ )c2 (IO3- ) 可知 ,本题图像斜率绝对值 大的线段为KspPb(IO3 )2 即Pb(IO3 )2 的饱和溶液 ,线段 bc 代表的是Ksp「LPb(IO3 )2 即Pb(IO3 )2 的 饱 和 溶 液 , 而 另 外 一 条 线 代 表 的 是 Ksp(AgIO3 ) 即 AgIO3 的 饱 和 溶 液 , 且 由 c 点 坐 标 值 可 知: Ksp(AgIO3 )=10-5.09 × 10-2.21=10-7.30 和ksp Pb (IO3 )2 =10-5.09 × 10-5.09 × 10-2.21=10-12.39 。
【详解】A .结合图像和分析,过 a 点作 x 轴垂线 ,a 点的 Qc 大于kspPb(IO3 )2 7」,a 点是Pb(IO3 )2 的过
饱和溶液有沉淀析出 ,a 点的 Qc 小于ksp(AgIO3 ) ,a 点是 AgIO3 的不饱和溶液 ,没有沉淀析出 ,A 不符 合题意;
百师联盟
B . Pb(IO3 )2 在纯水中溶解度的点为 2c(Pb2+ ) ≈ c(IO3- ) , 即 -lgc(Pb2+ )>-lgc(IO3- ) ,在坐标轴体现应该是一 象限角平分线的左上部 ,B 不符合题意;
C.向AgIO3 悬浊液中滴加AgNO3 溶液、向Pb(IO3 )2 悬浊液中滴加Pb(NO3 )2 溶液,分别至 c 点时,AgIO3 的溶解度为 10-5.09 ml.L-1 , Pb(IO3 )2 的溶解度为 5× 10-6.09 ml.L-1 ,C 不符合题意;
D . c(IO3- )=0. 1ml/L 时, AgIO3、Pb(IO3 )2 饱和溶液中
= 10 -5.09 所以 = 10-4.09 ,D 符合题意;
故选 D。
二、 非选择题: 本题共 4 小题,共 58 分。
15. 纳米BaTiO3 可用于光电催化。 某实验小组以钛酸四丁酯[Ti(OBu )4 ,Bu 代表正丁基; 液体]为钛源, 采用以下方法制备粒径小于 20nm 的BaTiO3 (反应装置如图 ,夹持等装置略)。
Ba(OH)2 .8H2O + Ti(OBu)4 = BaTiO 3 + 4BuOH+7H2O
Ⅰ . 在三颈烧瓶中加入8.8mmlBa(OH)2 .8H 2O, 20mL 二缩三乙二醇、少量表面活性剂 ,搅拌均匀后 ,采
用合适方式加入8.0mmlTi(OBu)4 和 20mL 氨水。 Ⅱ . 160℃回流反应 3h ,冷却至室温 ,得到溶胶。
Ⅲ . 向Ⅱ所得溶胶中加入100mL 蒸馏水,得到纳米粒子聚集体,离心分离后,沉淀经洗涤、干燥 ,得
1.4gBaTiO3 粉末。
回答下列问题:
(1)仪器 a 名称为 ,反应溶剂为 ,加热方式为 。反应结束时 ,应先停止 (填
“加热”或“通冷凝水”)。
(2) Ti(OBu )4 水解较快时,难以形成小尺寸的纳米BaTiO3 。 下列操作方式能降低Ti(OBu )4 水解速率
百师联盟
的有 (填标号)。
A .依次缓慢滴加Ti(OBu )4 和氨水
B .依次倒入Ti(OBu )4 和氨水
C . Ti(OBu )4 和氨水混合后缓慢滴加
(3)检验步骤Ⅱ所得溶胶属于胶体的实验操作与现象为 。
(4)离心分离可将沉淀紧密聚集在离心管底部(如图所示) 。将离心后的沉淀和清液分开的方法是 。
(5)本实验的BaTiO3 产率为 (保留 2 位有效数字)。
(6)为了测定BaTiO3 的晶体结构,通常使用的仪器是 。
【答案】(1) ①. 球形冷凝管 ②. 二缩三乙二醇 ③. 油浴 ④. 加热
(2)A (3)用一束强光照射步骤Ⅱ所得溶胶 ,垂直光的方向看到一条光亮的通路
(4)过滤 (5)75%
(6)X-射线衍射仪
【解析】
【分析】在三颈烧瓶中加入8.8mmlBa(OH)2 .8H2O , 20mL 二缩三乙二醇作溶剂 、 少量表面活性剂,
搅拌均匀后 ,采用合适方式加入8.0mmlTi(OBu)4 和 20mL 氨水 ,采用油浴加热到160℃回流反应 3h ,
冷却至室温,得到溶胶。 【小问 1 详解】
仪器 a 为球形冷凝管 ,起到冷凝、 回流 ,提高原料利用率; 二缩三乙二醇作溶剂,温度高于 100°C ,常采用 油浴加热 ,反应结束时 ,应先停止加热,继续通冷凝水让装置冷却,故答案为: 球形冷凝管; 二缩三乙二 醇; 油浴; 加热;
【小问2 详解】
Ti(OBu )4 与水反应发生水解 ,为了防止Ti(OBu )4 较快水解 ,应将氨水加入Ti(OBu )4 中,并缓慢滴加,
百师联盟
故依次缓慢滴加Ti(OBu )4 和氨水,故答案为:A; 【小问 3 详解】
检验步骤Ⅱ所得溶胶属于胶体的实验操作: 用一束强光照射步骤Ⅱ所得溶胶 ,垂直光的方向看到一条光亮的 通路 ,故答案为: 用一束强光照射步骤Ⅱ所得溶胶 ,垂直光的方向看到一条光亮的通路;
【小问4 详解】
离心分离可将沉淀紧密聚集在离心管底部 ,可采用过滤的方法将离心后的沉淀和清液,故答案为: 过滤; 【小问 5 详解】
加入8.8mmlBa(OH)2 .8H2O 和8.0mmlTi(OBu)4 发生反应 , 8.0mmlTi(OBu)4 少量 ,理论上生成
BaTiO3 8.0mml , BaTiO3 产率 为 × 100% ≈ 75% ,故答案为: 75%;
【小问 6 详解】
通常使用 X-射线衍射仪测定BaTiO3 的晶体结构,故答案为:X-射线衍射仪。
16. “三废”的科学治理是环境保护和资源循环利用的重要举措 。某含砷烟尘主要成分为
As2 O3、Pb5 (AsO4 )3 Cl、CuS 和 ZnS等。 一种脱砷并回收As2 O3 、铜和锌的流程如下:
已知:
①As2 O3 微溶于冷水, 易溶于热水;
②“氧化酸浸”中,金属硫化物转化成硫酸盐,难溶于热水的 Pb5(AsO4)3Cl 转化成 H3AsO4;
③萃取时,将萃取剂 HL 溶于磺化煤油中,所得溶液作为有机相,萃取和反萃取原理为
2HL + M2+ ML2 + 2H+ ,式中 M2+ 为 Cu2+ 或 Zn2+ 。 回答下列问题:
(1)“水浸”时,采用热水的目的是 。
(2)“氧化酸浸”时,CuS 发生反应的离子方程式为 ,Pb5(AsO4)3Cl 与硫酸反应的化学方程式为 。
百师联盟
(3)铜萃取剂 HL ()中的 N 、酚羟基 O 均与 Cu2+配位 ,形
成配合物 CuL2。该配合物中 Cu2+的配位数为 ,HL 分子结构中设计正壬基的作用是 。“反萃
取铜”后,“富铜液”为 相(填“水”或“有机”)。
(4)“沉砷”时,采用生石灰处理,滤渣主要成分的化学式为 。
(5)“反萃取锌”时,试剂 X 为 。
【答案】(1)将 As2O3 溶解 ,便于 As2O3 回收
(2) ①. CuS+4H2O2= SO- +Cu2++4H2O ②. Pb5(AsO4)3Cl+5H2SO4=3H3AsO4+5PbSO4+HCl
(3) ①. 4 ②. 使 HL 分子易溶于有机相 ③. 水
(4)Ca3(AsO4)2
(5)H2SO4
【解析】
【分析】含砷烟尘(As2O3 、Pb5(AsO4)3Cl 、CuS 、ZnS)用热水水浸, 由于 As2O3 易溶于热水 ,其它几种物 质都不溶于水 ,过滤后得到 As2O3 的热溶液 ,蒸发结晶后得到 As2O3; 剩余固体加 H2SO4 、H2O2 氧化酸浸,
CuS 、ZnS 被氧化,CuS+4H2O2= SO- +Cu2++4H2O 、ZnS+4H2O2= SO- +Zn2++4H2O ,Pb5(AsO4)3Cl 与 H2SO4
反应生成 H3AsO4 ,Pb5(AsO4)3Cl+5H2SO4=3H3AsO4+5PbSO4+HCl ,用铜萃取剂将 Cu2+萃取到有机相中 , 再 加酸溶液将 Cu2+反萃取到水相中 ,得到富铜液,再用锌萃取剂将 Cu2+萃取到有机相中 ,再加酸溶液将 Zn2+ 反萃取到水相中,得到富锌液,经过蒸发浓缩、冷却结晶、 过滤洗涤干燥等步骤得到 ZnSO4∙7H2O。
【小问 1 详解】
As2O3 易溶于热水,用热水可以将 As2O3 溶解 ,便于 As2O3 回收; 【小问2 详解】
根据分析 ,“氧化酸浸”时,CuS 发生反应的离子方程式为 CuS+4H2O2= SO- +Cu2++4H2O;
【小问 3 详解】
HL 中 N 、酚羟基均能与 Cu2+形成配位键,每个 HL 形成 2 配位 ,故 CuL2 中 Cu2+的配位数为4;正壬基为烷 烃基团,极性较小 ,根据相似相溶原理 ,正壬基易溶于有机物,HL 作为萃取剂,与 Cu2+形成配位化合物后 溶于有机相,从而实现萃取的目的; 根据分析 ,反萃取后 Cu2+在水相中 , 因此富铜液为水相;
【小问4 详解】
“沉砷”时,采用生石灰处理,CaO 、H2O 与 H3AsO4 反应生成 Ca3(AsO4)2 沉淀;
百师联盟
【小问 5 详解】
根据 2HL + M2+ ML2 + 2H+ 可知 ,反萃取需要加 H+使平衡逆向移动,最终得到 ZnSO4∙7H2O, 因此 X 为 H2SO4。
17. 1 ,3-丁二烯( C4 H6 ,简称丁二烯)是生产橡胶的一种重要原料 ,其制备方法不断创新。 Ⅰ . 1-丁烯(C4H8 ) 催化脱氢法是工业生产丁二烯的方法之一。
(1) 25℃时,相关物质的燃烧热数据如下表:
已知: C4H8 (g) = C4H6 (g) + H2 (g) ΔH = +110kJ .ml -1 ,则 a = 。
(2)将一定量的 1-丁烯在密闭容器中进行上述反应,测得不同温度下 1-丁烯的平衡转化率与体系压强的关 系如图所示。
①图中温度 T 由高到低的顺序为 ,判断依据为 。
②已知C4H8 (g) = C4H6 (g) + H 2(g) 的标准平衡常数 其中
pΘ = 0. 1MPa ,则T2 温度下,该反应的 kΘ = 。
Ⅱ . 电化学催化还原乙炔法条件温和 ,安全性高 。在室温下 ,某团队以 KOH 溶液为电解液 , 电催化还原乙 炔制备丁二烯。
(3)反应开始时,溶解在电解液中的C2 H2 吸附在催化剂表面,该吸附过程的熵变 ΔS 0(填 “> ” “< ”
或 “= ”) ,生成丁二烯的电极反应式为 。
(4)一定时间内,丁二烯的选择性和通过电路的总电量随相对电势变化如下图所示。
物质
C4 H8 (g)
C4H6 (g)
H2 (g)
燃烧热ΔH / (kJ . ml-1 )
a
-2542
-286
百师联盟
已知: 丁二烯的选择性 = 生量 × 100% ; 电量Q=nF ,n 表示电路中转移电子的物质
的量 , F=96500C .ml-1 。
①当相对电势为 -1.0V时,生成丁二烯的物质的量为 ml (列计算式)。
②当丁二烯选择性减小时 , 阴极产生的物质还可能有 (填标号)。
A . CO2 B . H2 C . O2 D .C3H4
【答案】(1)-2718
(2) ①. T1 >T2 >T3 ②. 反应为吸热反应,相同条件下,升高温度 ,平衡正向移动 , 1-丁烯的平衡
转化率升高 ③.
(3) ①. < ②. 2C2H2 +2e- +2H2O=CH2 =CHCH=CH2 +2OH-
ml× 70%× ②. BD
【解析】
【小问 1 详解】
燃烧热是在 101 kPa 时, 1 ml 纯物质完全燃烧生成指定产物时所放出的热量; 由表:
③C4H8 (g)+6O2 (g)=4CO2 (g)+4H 2O(l) ΔH=a
由盖斯定律,③-①-②得反应C4H8 (g) = C4H6 (g) + H2 (g) ΔH=a-ΔH1 -ΔH2 =+110kJ . ml-1 ,则 a=-2718kJ/ml;
【小问2 详解】
①反应为吸热反应,相同条件下,升高温度 ,平衡正向移动, 1-丁烯的平衡转化率升高 ,则图中温度 T 由
百师联盟
高到低的顺序为T1 >T2 >T3;
②由图 , T2 温度下,平衡时压强为 0. 1MPa , 1-丁烯的平衡转化率为 30% ,假设 1-丁烯投料为 1ml ,则:
C4H8 (g) ≈C4H6 (g)+ H2 (g)
起始(ml) 1 0 0
转化(ml) 0.3 0.3 0.3
平衡(ml) 0.7 0.3 0.3
总的物质的量为 1.3ml,则 C4 H8 、C4H6 、H2 分压分别为 0. 1MPa × 、0. 1MPa × 、0. 1MPa × ,
0. 1MPa × 1.3
该反应的
0. 1MPa
【小问 3 详解】
溶解在电解液中的C2 H2 吸附在催化剂表面 ,该吸附过程为熵减的过程 ,则熵变 ΔS
相关试卷
这是一份化学丨九师联盟陕晋青宁2025届高三10月质量检测化学试卷及答案,共8页。
这是一份化学丨青桐鸣大联考河南省2025届高三10月大联考化学试卷及答案,共14页。
这是一份化学丨“腾·云”联盟湖北省2025届高三八月开学联考化学试卷及答案,共20页。








