




吉林省松原市前郭五中2024~2025学年高二上期末考试 化学(含答题卡、答案)
展开
这是一份吉林省松原市前郭五中2024~2025学年高二上期末考试 化学(含答题卡、答案),文件包含吉林省松原市前郭五中20242025学年高二上期末考试化学含答题卡答案docx、吉林省松原市前郭五中20242025学年高二上期末考试化学含答题卡答案pdf等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
2024-2025学年高二上期末考试 化 学
考生注意:
1.本试卷满分100分,考试时间75分钟。
2.答卷前考生务必将自己的姓名、准考证号填写在答题卡上。
3.答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮 擦干净后再选涂其他答案标号。答非选择题时,将答案写在答题卡上。写在本试卷上无效。
可能用到的相对原子质量:H1 C12 016 Na 23 C135.5 Fe 56
一 、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合
题目要求!
一锅支架 外壳
1.如图是家庭燃气灶的部件图.下列说法正确的是 炉头
A. 炉头容易生锈,主要是高温下铁发生析氢腐蚀
灶脚
B. 外壳是铝合金材料,不易锈蚀是因为铝不活泼
C. 锅支架生锈的主要原因是经常沾上盐水,铁发生化学腐蚀
D. 灶脚由螺钉和外层电木(一种耐高温塑料)组成,电木可防止金属腐蚀 2.下列内容与结论相对应的是
3.下列热化学方程式或离子方程式中,不正确的是
A. 用 TiCla 制备TiO₂ 的反应:TiCl₄+(x+2)H₂O=TiO₂·xH₂OJ+4HCl
B. 泡沫灭火器的工作原理:Al³++3HCO₃=Al(OH)₃I+3CO₂t
C. 浓 CuCl₂ 溶液显绿色:[Cu(H₂O)₄]²++4Cl=[CuCl₄]²+4H₂O
D. 含氟牙膏预防龋齿:Ca₅(PO₄)₃OH(s)+F(ag)=Cas(PO₄)₃F(s)+OH(a) 4.下列关于电解质溶液的说法中正确的是
A. 常温下pH=10的某碱溶液,取1mL稀释到100mL, 稀释后pH为a, 则 a≥12
B. 某温度下纯水中c(OH)=2×10⁻⁷ml-L⁻¹, 则该温度下0.1 ml-L- ¹ 的盐酸的 pH=1
C. 常温下pH=3 的 H₂SO4与 pH=11 的氨水等体积混合后,加入酚酞溶液仍为无色
D. 用等浓度的NaOH 溶液中和等体积pH=2 与pH=3 的醋酸,所消耗的NaOH 溶液的体积前 者是后者的10倍
5.100多年来,人类首次合成了甲二醇,它的化学式为CH₂(OH)₂, 这种有机分子是形成气溶胶和
A. 甲二醇分子中有3个sp³杂化的原子
B. 甲二醇是非极性分子
c. 甲二醇的沸点高于甲醇
D. 相同物质的量的甲二醇和甲醇完全燃烧,甲二醇的耗氧量低
6.实验测得0.5 ml-L-¹CH₃COONa 溶液、0.5 ml-L⁻¹CuSO₄ 溶液以及H₂O 的 pH 随温度变化的曲
线如图所示。下列说法正确的是
9
CH,COONa
H₂O
8-
7
Cus
A.随温度升高,纯水中c(H)>c(OH)
30 40 S0 60
6- 5- 4- 3- 2+ 20
T/C
B. 随温度升高,CH₃COONa 溶液的c(OH) 减小
C. 随温度升高,CuSO4 溶液的pH 变化是Kw 改变与水解平衡移动共同作用的结果
D. 随温度升高,CH₃COONa 溶液和CuSOa 溶液的pH 均降低,是因为CH₃CO0-、Cu²+ 水解平
衡移动方向不同
7.下列应用与盐类水解无关的是
A. 用纯碱去油污时,加热可以增强去污效果
B. 用醋酸除去茶壶里的水垢
C. 草木灰与铵盐不能混合使用
D. 饱和氯化铁溶液滴入沸水中制备胶体
8.氯碱工业是高耗能产业, 一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺 中,物料传输和转化关系如图(电极均为石墨电极),下列说法错误的是
精制饱和NaCl溶液 甲
x
稀NaCI溶液
A(电解池) B(燃料电池)
乙 丙
Y
空气 (除CO₂)
a%NaOH溶液
b%NaOH 瘠液
NaOH溶液
离子膜
离子膜
丁
A.A 池 中Na+通过交换膜向乙电极移动
B.B 池中丁电极上的反应为O₂+4e+2H₂O=4OH-
C.A 池中每生成1 ml H₂,B池中会消耗标准状况下O₂ 气体11.2L
D. 若两池中所用离子膜类型相同,则a%>b%
选项
内容
结论
A
H₂O(g)变成H₂O(1)
该过程的△S>0
B
常温下,硝酸铵固体溶于水可自发进行
该过程的△S>0
C
一个反应的△H>0,△S>0
反应一定不能自发进行
D
H₂ (g)+F₂ (g)=2HF(g)的△H=271kJ ·ml-
反应在任意温度下都不能自发进行
大气臭氧层反应的关键中间物。关于甲二醇的说法错误的是 9.25℃时,通过下列实验探究NaHCO₃ 、Na₂CO₃ 溶液的性质。
实验1:用pH 试纸测量0.1 ml-L-¹NaHCO₃溶液的pH, 测得pH 约为8。
实验2:将0.1 ml-L¹NaHCO₃溶液与0.1 ml-L¹Ca(OH)₂ 溶液等体积混合,产生白色沉淀。 实验3:饱和Na₂CO₃ 溶液中通入CO₂ 产生白色沉淀,溶液pH 从12约下降到9。
实验4:向Na₂CO₃ 溶液中滴加几滴酚酞,加水稀释,溶液红色变浅。 下列说法正确的是
A. 由实验1可得出:Ka₁(H₂CO₃)·Ka₂(H₂CO₃)>10-14
B. 由实验2可推测:K(CaCO₃)>2.5×10³
C. 实验3中发生反应的离子方程式为:CO²+H₂O+CO₂=2HCO₃
D. 实验4中加水稀释后,溶液中 的值增大
10. 电池的不断推陈出新,让电动汽车安全达到一个新高度。某品牌汽车配置的磷酸铁锂“刀片电 池”,将电池包整体空间利用率由过去的40%提升到了60%,进而解决磷酸铁锂电池能量密度低 的问题。“刀片电池”放电时的总反应:LixC₆+Li-xFePO₄=6C+LiFePO₄, 工作原理如图所示。
下列说法错误的是
A. 放电时,铝箔电极反应式为Al-3e-=Al³+
隔膜
钢 烟箱
山,FePO, 锂些有机溶液
② 以
B. 放电时,电子由铜箔流向铝箔,Li'通过隔膜移向正极,使正极质量增加
C. 用充电桩给汽车电池充电的过程中,阴极质量增加
D. 充电时的阳极反应式为LiFePO₄-xe⁻=Lin-xFePO₄+xLi*
11.某公司推出了一款全新65W 双口氮化镓充电器。氮化镓是第三代半导体材料。下列说法正确 的是
A. 镓元素的简单离子半径大于其原子半径
B. 镓的电负性比氮大
C. 镓的第一电离能比同周期相邻元素的都小 D. 基态镓原子的核外电子排布式为[Ar]4s²4p¹
12. 氯化亚砜(SOCl₂)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分 子的VSEPR 模型、分子的空间结构和中心原子(S) 采取杂化方式的说法正确的是
A. 四面体形、三角锥形、sp³
B. 平面三角形、V 形 、sp²
C. 平面三角形、平面三角形、sp²
D. 四面体形、三角锥形、sp²
13.碳酸氢钠的分解反应:2NaHCO₃(s)=Na₂CO₃(s)+CO₂(g)+H₂O(g)△H>0 。 一定温度下,
在恒容密闭容器中放入NaHCO₃固体,反应达到平衡时容器中压强为4×10³Pa。下列说法正确
的是
A. 当混合气体的密度不变时,反应达到平衡状态
B. 降低温度,正反应速率减小,逆反应速率增大
C. 当容器中的气体平均摩尔质量不变时,反应达到平衡状态
D. 当固体总质量不再改变,不能说明反应已达平衡状态 14.下列实验操作能达到实验目的的是
15.常温时,在25mL0.1 ml-L⁻¹NaOH溶液中逐滴加入0.2 ml-L⁻¹醋酸溶液,曲线如图所示。
下列说法正确的是
A. 在A 、B间任一点,溶液中一定有:c(Na+)>c(CH₃CO0)>c(H+)>c(OH)
B. 在 B 点 ,ac(OH)=c(H+)
C. 在 C 点溶液中:c(CH₃CO07)>c(Na+)>c(H+)>c(OH)
D. 在 D 点溶液中:c(CH₃CO07)+c(CH₃COOH)=c(Na+)
二、非选择题:本题共4小题,共55分。 16. (12分)
选项
实验操作
实验目的
A
向BaCO₃溶液中加入饱和NazSO₄溶液
验证:
Kp(BaSO4)HCO;
D
向2mL 0.1ml-L-¹的FeCl₃溶液中加入4mL0.1ml-L-1 的KI溶液,充分反应后,分别取少量溶液于两支试管 中,向其中一支试管中滴加几滴淀粉溶液,溶液变蓝,
另一支试管中滴加几滴KSCN溶液,溶液变红
KI与FeCl₃ 的反应是可逆 反应
一种以辉钼矿(主要成分为MS₂, 含少量Ca、Fe、Cu 等元素)为原料制备多钼酸盐的生产工 艺如图所示。
已知:i.25℃时,几种难溶物的溶度积如表。
(1)“氧化焙烧”过程:加入石灰石,有利于降低焙烧温度、 (从环保角度答题)。
(2)“盐浸”过程,生成 MO²- 的离子方程式为
(3)“盐浸”过程,少量CuO 转化为Cu(NH₃), “净化”过程进一步转化为CuS除去。计 算反应 Cu(NH₃)²+(ag)+S²-(ag) CuS(s)+4NH₃(ag) 的K=
(4)“酸沉”过程中MO2 会发生聚合生成多钼酸根,可以从“滤液”中回收副产品 (填化学式)。
(5)可通过电渗析法制备八钼酸铵[(NHA)₄M₈O₂6], 工作原理如图。其中,阳膜和阴膜分别 只允许阳离子、阴离子通过;双极膜中间层中的水解离为H* 和OH, 并在直流电场作用下分别向 两极迁移。
石墨 阴职
B₂O
MHLHC)溶液 aHhMO,溶液
OH
氨水
阳极室 破室 酸化室
氨水 阴极室
双极膜
阳膜
石星
①阳极发生的电极反应为
②分析酸化室可得到MgO 的原因:
问题:
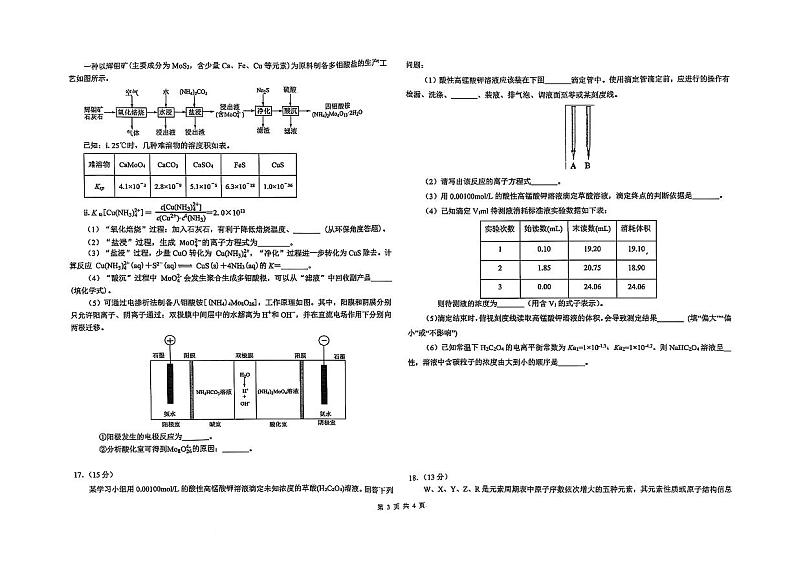
(1)酸性高锰酸钾溶液应该装在下图 滴定管中。使用滴定管滴定前,应进行的操作有 检漏、洗涤、 、装液、排气泡、调液面至零或某刻度线。
(2)请写出该反应的离子方程式
(3)用0.00100ml/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是
(4)已知滴定Viml 待测液消耗标准液实验数据如下表:
则待测液的浓度为 (用含V₁ 的式子表示)。
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果 (填“偏大”“偏 小”或“不影响”)
(6)已知常温下H₂C₂O₄的电离平衡常数为Kai=1×10-13;Kaz=1×10-⁴2。则 NaHC₂O₄ 溶液呈_ 性,溶液中含碳粒子的浓度由大到小的顺序是
难溶物
CaMO₄
CaCO₃
CaSO₄
FeS
CuS
Kp
4.1×10⁻3
2.8×10⁻9
5.1×105
6.3×10~18
1.0×10⁻36
实验次数
始读数(mL)
末读数(mL)
消耗体积
1
0.10
19.20
19.10,
2
1.85
20.75
18.90
3
0.00
24.06
24.06
17. (15分)
某学习小组用0.00100ml/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H₂C₂O4)溶液。回答下列
18. (13分)
W、X、Y、Z、R 是元素周期表中原子序数依次增大的五种元素,其元素性质或原子结构信息
超
率和CO 的选择性(CO 在含碳产物中的百分比)随温度的变化如图1、图2所示。
100
90
80
x=2
0
600 700 800
温度/C
的 轴 化 率 %
x=1/2-
900 1000
温度/C
如下: (3)在恒压条件下,按初始投料n(CO₂)/n(CH₄)=x(x=1/2,1,2) 反应达到平衡时,CHa 转化
回答下列问题: 图1 图2
元素
元素性质或原子结构信息
W
基态W原子s能级上的电子总数比p能级上的电子总数多3
X
基态X原子核外有7种运动状态不同的电子
Y
元素周期表中电负性最大
Z
第四周期元素中未成对电子数最多
R
原子序数为33
(1)写出各元素的元素符号:W X R
(2)第一电离能:X 填“>”或"
相关试卷
这是一份吉林省松原市五校2024-2025学年高二上学期期末联考化学试卷(PDF版附解析),共7页。
这是一份吉林省“BEST合作体”2024-2025学年高二上学期期末考试化学试卷(含答案),文件包含吉林省“BEST合作体”2024-2025学年高二上学期期末考试化学试卷docx、吉林省“BEST合作体”2024-2025学年高二上学期期末考试化学答案图片版pdf等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
这是一份吉林省松原市前郭五中2022级(2024~2025学年度上学期)高三第三次考试(12月) 化学试卷(含答题卡、答案),文件包含吉林省松原市前郭五中2022级20242025学年度上学期高三第三次考试12月化学试卷含答题卡答案docx、吉林省松原市前郭五中2022级20242025学年度上学期高三第三次考试12月化学试卷含答题卡答案pdf等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。








