


所属成套资源:2025年九年级化学寒假衔接讲练 (人教版)
寒假复习-专题07 化学反应的定量关系 2025年九年级化学寒假衔接讲练 (人教版)
展开
这是一份寒假复习-专题07 化学反应的定量关系 2025年九年级化学寒假衔接讲练 (人教版),文件包含寒假复习-专题07化学反应的定量关系教师版2025年九年级化学寒假衔接讲练人教版docx、寒假复习-专题07化学反应的定量关系学生版2025年九年级化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。
1.认识质量守恒定律,能说明化学反应中的质量关系。
2.形成“化学变化过程中元素不变”的观念。
3.能正确书写简单的化学方程式。
4.能根据化学反应方程式进行简单的计算。
5.认识定量研究对于化学科学发展的重大作用。
考点1 质量守恒定律
1.质量守恒定律
2.实验验证
3.质量“不守恒”的实验情况分析
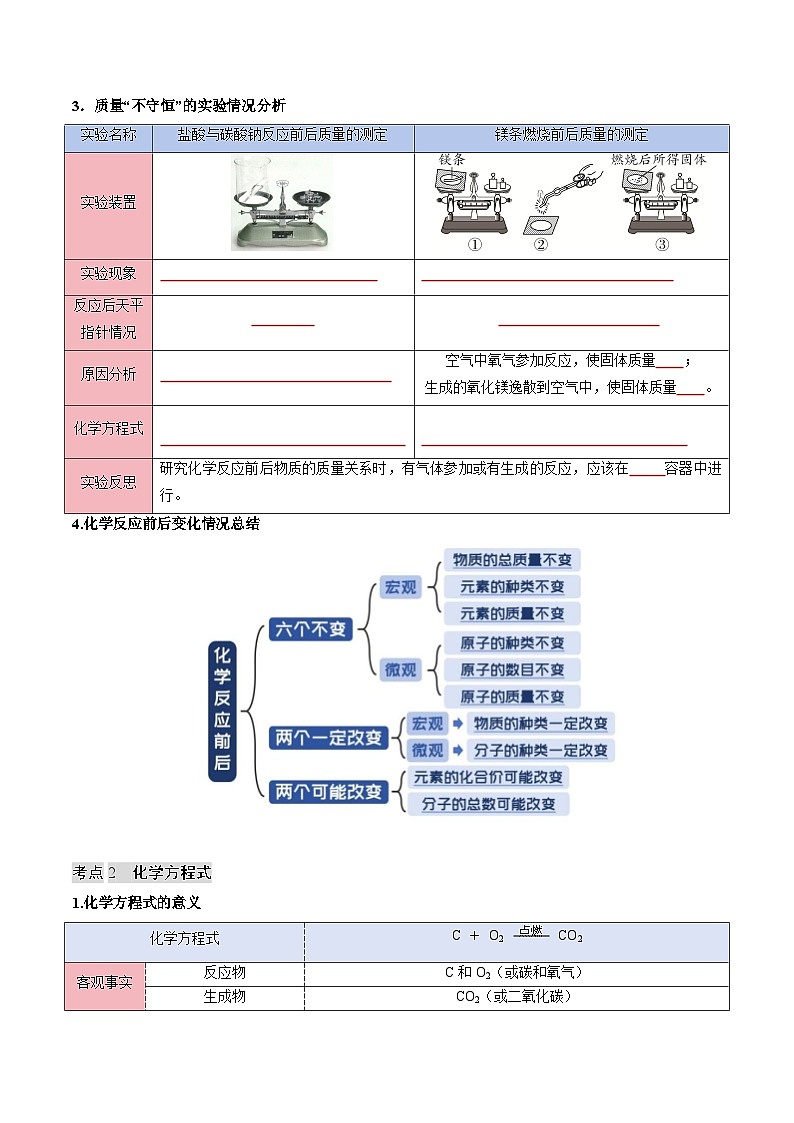
4.化学反应前后变化情况总结
考点2 化学方程式
1.化学方程式的意义
2.化学方程式的书写
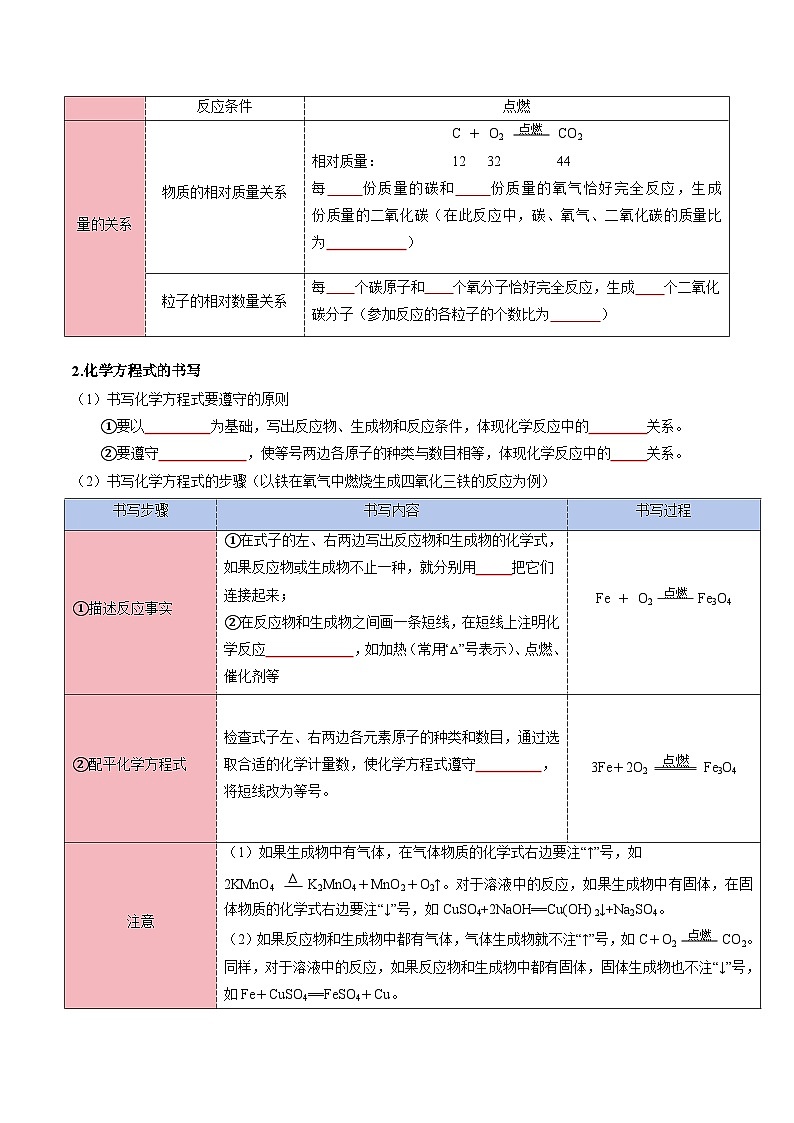
(1)书写化学方程式要遵守的原则
①要以 为基础,写出反应物、生成物和反应条件,体现化学反应中的 关系。
②要遵守 ,使等号两边各原子的种类与数目相等,体现化学反应中的 关系。
(2)书写化学方程式的步骤(以铁在氧气中燃烧生成四氧化三铁的反应为例)
3.化学方程式的配平方法
①最小公倍数法
②奇数配偶法
(1)适用范围:适用于某一元素多次出现,并且式子两边该元素的原子数目为一奇一偶的化学方程式。
(2)方法
③观察法
(1)适用范围:适用于反应物和生成物中有些物质的化学式比较复杂的化学方程式。
(2)方法
④设“1”法
(1)适用范围:主要适用于碳氢化合物(或含碳、氢、氧的化合物)与氧气的反应。
(2)方法
强化点1 根据化学方程式进行简单计算
1.根据化学方程式计算的依据
(1)理论依据:质量守恒定律。
(2)基本依据:参与化学反应的各物质间存在固定的 。
2.利用化学方程式计算的步骤及格式
例:加热分解31.6 g高锰酸钾,可以得到氧气的质量是多少?
真题感知
1.(2024·黑龙江绥化·中考真题)现将40gA和足量的B混合加热。A与B发生化学反应,40gA完全反应后生成32gC和22gD,则参加反应的B与生成的D的质量比是
A.20:7B.7:11C.5:4D.16:11
2.(2024·山东临沂·中考真题)一定条件下,甲、乙、丙、丁四种物质反应前后的质量关系如表所示。下列说法中错误的是
A.x=7
B.丙可能是该反应的催化剂
C.该反应属于化合反应
D.反应中甲和丁的质量比是9∶8
3.(2024·内蒙古呼和浩特·中考真题)N2H4(肼)和N2O4是长征系列运载火箭的推进剂之一。二者反应原理为:2N2H4+N2O4=3N2+4H2O。下列说法错误的是
A.1个肼分子由2个氮原子和4个氢原子构成
B.肼中氢元素的质量分数为12.5%
C.高于沸点肼会汽化,其分子体积会变大
D.参加反应的N2H4和N2O4的分子个数比为2:1
4.(2024·江苏徐州·中考真题)为了实现碳的资源化利用,我国科学家用纳米镍粒子作催化剂将二氧化碳合成甲烷,反应的化学方程式为CO2+4H2催化剂CH4+2X。下列说法正确的是
A.X的化学式为H2O2B.甲烷中碳、氢元素的质量比为3∶1
C.反应前后分子的数目不变D.参加反应的CO2和H2的质量比为22∶1
5.(2024·北京·中考真题)甲烷水蒸气重整制氢的反应为CH4+H2O 催化剂 高温CO+3H2,下列说法不正确的是
A.反应涉及两种氧化物B.反应前后氢原子个数不变
C.生成的CO、H2的分子个数比为1:1D.参加反应的CH4、H2O的质量比为8:9
6.(2024·四川巴中·中考真题)我国航天事业的发展突飞猛进,为载人空间站的建立奠定了坚实基础。空间站里宇航员呼吸消耗O2,产生CO2,可用如下方法处理CO2:
第①步,利用固态胺系统对CO2进行吸收与浓缩
第②步,CO2+4H2一定条件CH4+2H2O
第③步,2H2O通电2H2↑+O2↑
下列说法错误的是
A.第②步反应前后碳元素的化合价不变
B.电解水正、负两极得到的气体质量比为8∶1
C.电解水得到的H2可以循环利用
D.该方法能够实现氧气的再生
7.(2024·内蒙古通辽·中考真题)中国科学家在实验室内实现了从二氧化碳到葡萄糖(C6H12O6)的全人工合成,是目前已知的国内外人工制糖最高水平。下列说法不正确的是
A.CO2中碳元素化合价为+4价
B.葡萄糖中碳元素、氢元素、氧元素质量比为1:2:1
C.葡萄糖由三种元素组成
D.该合成过程还需要含氢元素的物质参加反应
8.(2024·山东日照·中考真题)某同学加热一定量的氯酸钾和二氧化锰固体混合物制取氧气(2KClO3MnO2Δ2KCl+3O2↑)。反应一段时间后停止加热,经实验测得反应后混合物中钾元素的质量分数为39%,则反应后混合物中氯元素的质量分数为
A.20%B.35.5%C.39%D.48%
9.(2024·江苏无锡·中考真题)可燃物R由碳、氢、氧中的一种或几种元素组成。一定质量的R和氧气在密闭容器中燃烧,反应前后各物质的质量如表。
下列叙述错误的是
A.m3=0,m5=0时,R中一定含有氢元素
B.m1+m2=m3时,R中一定含有碳元素,可能含有氧元素
C.m3:m4=11:9时,R中一定含有碳元素和氢元素,可能含有氧元素
D.811m3+89m4+47m5=m2时,R中一定含有碳、氢、氧三种元素
10.(2023·四川攀枝花·中考真题)在一定条件下,氨与氧气发生反应:aNH3+bO2催化剂4X+dH2O(其中a、b、d为化学计量数)。反应过程中NH3、H2O的质量(g)随消耗O2的质量(g)变化如下图。下列说法错误的是
A.最终生成60gX物质
B.X物质为NO2
C.a、d之比为2∶3
D.b、d之比为5∶6
11.(2024·上海·中考真题)人类对水的认识历经了不懈的探索。
(1)18世纪,科学家将制得的氢气点燃,观察到氢气燃烧时火焰呈 色,并证明了生成物为水,但他们并不知道可燃物燃烧是与氧气发生反应。根据当时的认识和实验,所能获得的结论用现在的语言可表达为“水中含 (元素符号)”。
(2)氧气的发现解释了燃烧的本质,进而揭示了水不是一种单质。
①氧气在空气中的体积分数约为 。
②氢气在空气、氧气中都能燃烧,通过 (填基本反应类型)生成水。
③从实验设计的严谨性出发,若要证明“水的元素组成”,应使氢气在 (选填“空气”或“氧气”)中燃烧。
(3)电解水实验也能证明水的组成,电解时每生成32g氧气的同时,生成 ml氢气。
(4)经大量实验最终确认了水的化学式是H2O。某课题组通过实验将水分解成了一种化合物Y和H2,欲根据该实验相关物质的数据确定Y中各原子的个数比,需获取的数据有 。
12.(2024·广东·中考真题)科研人员提出一种回收利用铝冶炼产生的废渣赤泥(含Fe2O3)的新方法,助力产业逐“绿”前行。应用新方法从赤泥中提取铁的装置示意图如图1所示。
(1)Fe2O3中铁元素的化合价是 ,铁、氧元素的质量比为 。
(2)应用新方法从赤泥中提取铁发生反应的化学方程式:3H2+Fe2O3一定条件3H2O+2Fe。
i.以该方法处理某赤泥样品的实验数据如图2所示。据图计算,反应从开始至10分钟,提取铁的质量为
g。
ii.我国每年产生赤泥约9000万吨,假设赤泥中Fe2O3的质量分数为30%,用新方法处理9000万吨赤泥,理论上可提取铁 万吨(写出计算过程)。
iii.传统方法通常使用CO还原Fe2O3,新方法能使产业更加绿色环保的原因是 (写一种)。
13.(2024·内蒙古呼和浩特·中考真题)“这里的车棚会发光”——内蒙古党政机关办公区车棚顶安装了5972块光伏板,年发绿电180万度,年减少碳排放1500吨。光伏板的核心材料是单质硅,工业制硅流程中的一步化学反应方程式为SiHCl3+H2 1100℃ 3X+Si,请回答下列问题。
(1)X的化学式为 。
(2)请根据化学方程式计算生产56吨Si,需要H2多少吨?
14.(2024·四川德阳·中考真题)某火力发电厂为防止燃煤烟气中的SO2污染环境,使用石灰石进行烟气脱硫,发生反应:2CaCO3+2SO2+O2=2CaSO4+2CO2,生成的CaSO4可用作建筑材料的原料。如果将燃煤烟气中的256kgSO2全部吸收,至少需要CaCO3的质量是多少?
15.(2024·山东淄博·中考真题)硅化镁Mg2Si在能源器件、激光和半导体制造等领域具有重要应用价值,可通过石英砂(主要成分为SiO2,杂质不含硅元素)和金属镁反应制得,反应的化学方程式为SiO2+4Mg高温Mg2Si+2X。
(1)上述化学方程式中X为 (填化学式)。
(2)用12.5kg石英砂与足量镁充分反应得到15.2kg硅化镁,计算石英砂中SiO2的质量分数(写出计算过程)。
提升专练
1.(2024·山西太原·二模)合成硝酸过程中,一个反应的化学方程式为3X+H2O=2HNO3+NO,X为
A.N2B.O2C.NO2D.N2O
2.(2023·四川攀枝花·模拟预测)在2A+B=2C反应中,已知B的相对分子质量为32,C 的相对分子质量为40,则A的相对分子质量为
A.48B.24C.8D.4
3.(2024·山东滨州·一模)在一密闭容器中,有X、Y、Z、W四种物质,充分反应后,测得反应前后各物质的质量如下表。下列说法不正确的是
A.x=3B.参加反应的X的质量为13g
C.该反应为化合反应D.Y一定是这个反应的催化剂
4.(2024·天津河西·二模)为防止人体缺碘,食盐中添加了少量的碘酸钾KIO3,使用说明中强调“不宜高温烹煮”,原因是:2KIO3Δ2KI+3O2↑,下列说法不正确的是
A.KIO3中碘元素的化合价为+5价
B.该反应属于分解反应
C.碘化钾和氧气的质量比为2:3
D.反应前后固体质量减轻
5.(2024·云南怒江·一模)下列化学方程式书写正确的是
A.CH4+O2=CO2+H2OB.H2CO3=CO+H2O
C.3Fe+4O2=Fe3O4D.CaCO3+2HCl=CaCl2+CO2↑+H2O
6.(2024·广东清远·模拟预测)下图是工业上用氨气制取尿素【CO(NH2)2】的微观示意图。下列说法错误的是
A.反应物都是化合物
B.该反应反应前后原子个数不变
C.丙中碳、氧元素的质量比为3:4
D.参加反应的甲、乙分子的个数比为1:1
7.(2024·云南昆明·一模)甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法不正确的是
A.丁是反应物B.x的值为10
C.乙可能是此反应的催化剂D.生成14g甲,需消耗60g丁
8.(2023·四川宜宾·一模)某汽车尾气净化转化器如图1所示,其内部设计为蜂窝状陶瓷结构,表面附着的催化剂能催化CO、NOx等有害气体转化为无污染的气体,其中某化学反应1的微观示意图见图2。下列说法中不正确的是
A.蜂窝状陶瓷结构能增大反应物与催化剂的接触面积
B.反应1中原子个数不变
C.反应1中两种生成物的质量比为7:11或11:7
D.反应1中有元素的化合价改变
9.(2024·山东济南·二模)模型认知是化学研究的重要科学方法。如图是工业制取硝酸第一步反应的微观模拟示意图(甲、乙、丙、丁分别代表图中对应的四种物质)。下列有关该反应的说法中,不正确的是
A.反应生成的丙和丁的分子个数比为2:3
B.参加反应的甲和乙的质量比为17:40
C.反应前后各元素的化合价均发生了改变
D.物质乙、丙、丁都属于氧化物
10.(2024·吉林长春·三模)在“碳达峰、碳中和”目标愿景下,氨气NH3作为一种零碳能源具有广泛的应用前景。
【查阅资料】氨气是一种“零碳”燃料,单位体积放热约为氢气的1.3倍。比较氨气与氢气部分性质(如表)可知,氨气在某些方面也具有一定优势。
氨气与氢气的部分性质对比表
*爆炸极限:容易导致爆炸的空气中可燃性气体的体积分数范围。
(1)每个氨气分子中氮原子与氢原子个数比为 ;
(2)氨气的理想燃烧过程微观示意图如下,该反应的化学方程式是 ;
(3)与氢气相比,氨气作为燃料的三个优点是 。
11.(2024·云南怒江·一模)利用甘蔗制白砂糖的工艺流程如下:
(1) (填“是”或“不是”)空气污染物,“SO2”中数字“2”的含义是 。
(2)榨汁机中出来的甘蔗汁液是绿色的,在硫化塔中,二氧化硫对其进行漂白可以除色,二氧化硫气体从底部缓慢通入的目的是 。
(3)生石灰搅拌池中的CaOH2溶液会吸收多余的二氧化硫,生成CaSO3沉淀和水。写出此反应的化学方程式 。
(4)过滤泵中可以将沉淀除去,滤液中主要含有蔗糖(C12H22O11)。
①蔗糖由 种元素组成。
②蔗糖中 元素的质量分数最大。
12.(2024·云南昆明·一模)硫酸是重要的化工原料,可用于生产化肥、农药、火药、燃料以及冶炼金属等。工业上以黄铁矿(FeS₂)为原料生产硫酸的主要流程如下:
(1)“粉碎”的目的是 。
(2)沸腾炉中主要的化学反应为4FeS2+11O2高温2R+8SO2,则R的化学式为 。
(3)在接触室中,SO2在催化剂(V2O5)的作用下加热转化为SO3,该反应的化学方程式为 。
13.(2024·河北保定·二模)同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取50g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如表,请计算:
(1)生成二氧化碳的总质量为 g;
(2)该石灰石样品中碳酸钙的质量分数。
14.(2023·甘肃嘉峪关·一模)二氧化碳是一种宝贵的碳氧资源。以CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,该反该反应的化学方程式为CO2+2NH3=CO(NH2)2+H2O。请计算:
(1)尿素中C、O、N、H四种元素的质量比;
(2)多少克尿素中含碳3.6克?
(3)若按上述方法生产120t尿素,可固定的CO2的质量为多少。
15.(2024·安徽亳州·一模)中国天宫空间站三名航天员每日需要2.4kgO2,固体燃料氧气发生器制氧是航天员安全可靠的供氧途径之一。向氧气发生器中加入粉末状的铁粉和氯酸钠(NaClO3);点燃铁粉,铁粉剧烈燃烧,放出大量的热,NaClO3受热分解为NaCl和O2。请回答下列问题:
(1)氯酸钠受热分解所需的能量来自于 。
(2)若要满足三名航天员4天所需的供氧量,则理论上至少需要NaClO3的质量为多少?(列出化学方程式写出完整计算过程) 考点聚焦:复习要点+知识网络,有的放矢
重点专攻:知识点和关键点梳理,查漏补缺
难点强化:难点内容标注与讲解,能力提升
提升专练:真题感知+提升专练,全面突破
内容
大量实验证明,参加 的各物质的 ,等于反应后生成的各物质的
适用范围
所有的 ,不适用于
质量范围
所有参加反应的反应物质量(不包括没有反应完的部分和催化剂的质量)和所有生成物的质量。尤其注意参加反应的气体或反应生成的 、 等不要忽略。
方案
方案一 铜与氧气反应
方案二 铁与硫酸铜反应
装置
现象
气球 ,固体 ,电子天平
铁丝 ,溶液 ,电子天平
分析
方案一实验装置中,橡胶塞的作用是 ,小气球的作用是 ;
如果没有它们,实验可能出现哪些结果? 。
实验名称
盐酸与碳酸钠反应前后质量的测定
镁条燃烧前后质量的测定
实验装置
实验现象
反应后天平指针情况
原因分析
空气中氧气参加反应,使固体质量 ;
生成的氧化镁逸散到空气中,使固体质量 。
化学方程式
实验反思
研究化学反应前后物质的质量关系时,有气体参加或有生成的反应,应该在 容器中进行。
化学方程式
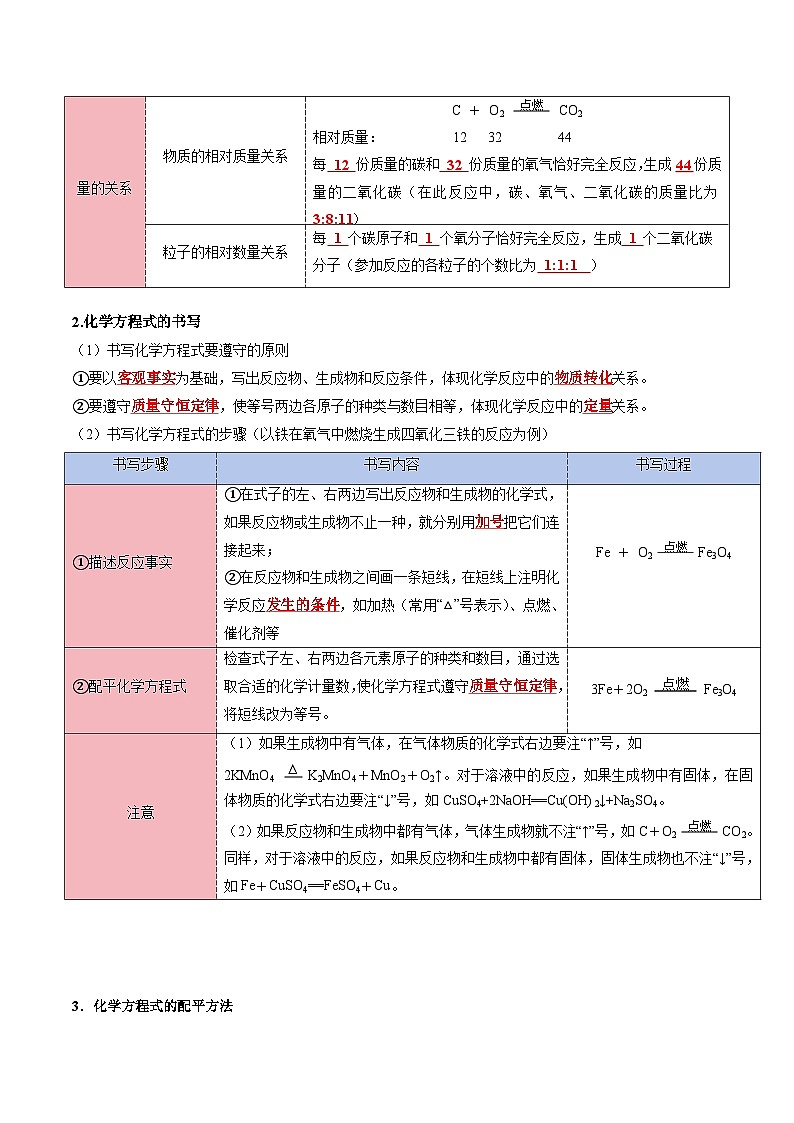
C + O2 点燃 CO2
客观事实
反应物
C和O2(或碳和氧气)
生成物
CO2(或二氧化碳)
反应条件
点燃
量的关系
物质的相对质量关系
C + O2 点燃 CO2
相对质量: 12 32 44
每 份质量的碳和 份质量的氧气恰好完全反应,生成 份质量的二氧化碳(在此反应中,碳、氧气、二氧化碳的质量比为 )
粒子的相对数量关系
每 个碳原子和 个氧分子恰好完全反应,生成 个二氧化碳分子(参加反应的各粒子的个数比为 )
书写步骤
书写内容
书写过程
①描述反应事实
①在式子的左、右两边写出反应物和生成物的化学式,如果反应物或生成物不止一种,就分别用 把它们连接起来;
②在反应物和生成物之间画一条短线,在短线上注明化学反应 ,如加热(常用“△”号表示)、点燃、催化剂等
Fe + O2 点燃 Fe3O4
②配平化学方程式
检查式子左、右两边各元素原子的种类和数目,通过选取合适的化学计量数,使化学方程式遵守 ,将短线改为等号。
3Fe+2O2 点燃 Fe3O4
注意
(1)如果生成物中有气体,在气体物质的化学式右边要注“↑”号,如
2KMnO4 ∆ K2MnO4+MnO2+O2↑。对于溶液中的反应,如果生成物中有固体,在固体物质的化学式右边要注“↓”号,如CuSO4+2NaOH==Cu(OH)2↓+Na2SO4。
(2)如果反应物和生成物中都有气体,气体生成物就不注“↑”号,如C+O2 点燃 CO2。同样,对于溶液中的反应,如果反应物和生成物中都有固体,固体生成物也不注“↓”号,如Fe+CuSO4==FeSO4+Cu。
步骤
书写过程
(1)找出式子两边出现次数较多,且原子个数不相等又相差较大的元素,求出其原子个数的最小公倍数
P + O2 点燃 P2O5
氧原子个数:
最小公倍数:
(2)用最小公倍数分别除以含有该元素的化学式中该原子的个数,所得的值就是该化学式的化学计量数(先配化合物,后配单质)
P + O2 点燃 P2O5
化学计量数:
P + O2 点燃 P2O5
(3)由已知的化学计量数,配平其他化学式的化学计量数,将短线改为等号。
P + 5O2 点燃 2P2O5
4P
P + 5O2 点燃 2P2O5
步骤
示例
①在原子个数为奇数的化学式前面配2,使其原子个数由奇数变为偶数
②以该化学式和所配化学计量数为依据,依次推求出其他化学式前的化学计量数。最后注明反应条件和“↑”“↓”符号,将短线改为等号,并检查是否配平
步骤
示例
①从化学式比较复杂的一种物质入手(可将原子团看为一个整体),推出与其有关的化学式前的化学计量数
②根据求得的化学计量数推求其他化学式前的化学计量数。最后注明反应条件和“↑”“↓”符号,将短线改为等号,并检查是否配平
步骤
示例
①将反应物或生成物中化学式比较复杂的一种物质(一般为碳氢化合物或含碳、氢、氧的化合物)的化学计量数定为1,以此化学式为基准,推求与其相关的化学式前的化学计量数
②若得出的化学计量数为暂定分数,将反应式中各化学式前的化学计量数同时乘暂定分数的分母,化分数为整数。最后注明反应条件和“↑”“↓”符号,并检查是否配平
步骤说明
完整步骤
注意以下是常见的扣分点
(1)设未知量
设未知量时,x后面加了单位
(2)写化学方程式
未配平,漏标或标错“↑”“↓”
(3)标相关量
相对质量
相对分子质量算错,漏乘化学计量数
实际质量
实际质量写错位置,漏写单位
(4)列出比例式,求解
= x=
数据位置混乱,漏单位
(5)简明地写出答案
用“略”字或用省略号作答,未表达完整
注意
①由于方程式只能反映物质间的质量比,因此代入方程式中的各个量必须是 。
②由于方程式中各物质是纯净物,因此代入的量必须是 的质量,若物质不纯,必须换算成 的质量再代入计算。
③单位必须 ,且单位要代入计算过程。
物质
甲
乙
丙
丁
反应前的质量/g
40
3
5
2
反应后的质量/g
4
x
5
34
物质
R
氧气
二氧化碳
水
一氧化碳
反应前质量/g
m1
m2
0
0
0
反应后质量/g
0
0
m3
m4
m5
物质
X
Y
Z
W
反应前的质量/g
22
6
5
4
反应后的质量/g
9
6
19
x
性质
氨气
氢气
沸点/℃
-33.35
-252.67
爆炸极限%
15.5~27.0
4.0~74.2
反应时间/s
t0
t1
t2
t3
t4
t5
反应后固体的质量/g
50
46
41
36.2
34.6
34.6
相关试卷
这是一份寒假复习-专题03 碳和碳的氧化物 2025年九年级化学寒假衔接讲练 (人教版),文件包含寒假复习-专题03碳和碳的氧化物教师版2025年九年级化学寒假衔接讲练人教版docx、寒假复习-专题03碳和碳的氧化物学生版2025年九年级化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共52页, 欢迎下载使用。
这是一份寒假复习-专题02 空气、氧气和水 2025年九年级化学寒假衔接讲练 (人教版),文件包含寒假复习-专题02空气氧气和水教师版2025年九年级化学寒假衔接讲练人教版docx、寒假复习-专题02空气氧气和水学生版2025年九年级化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
这是一份寒假复习-专题01 化学实验基本技能 2025年九年级化学寒假衔接讲练 (人教版),文件包含寒假复习-专题01化学实验基本技能教师版2025年九年级化学寒假衔接讲练人教版docx、寒假复习-专题01化学实验基本技能学生版2025年九年级化学寒假衔接讲练人教版docx等2份试卷配套教学资源,其中试卷共48页, 欢迎下载使用。









