














所属成套资源:2025年高考化学大二轮专题复习课件+讲义+专练
专题七 大题突破3 化学综合实验--2025年高考化学大二轮专题复习课件+讲义+专练
展开
这是一份专题七 大题突破3 化学综合实验--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题七大题突破3化学综合实验--2025年高考化学大二轮专题课件pptx、专题七大题突破3化学综合实验AB两练--2025年高考化学大二轮专题复习专练docx、专题七大题突破3化学综合实验--2025年高考化学大二轮专题复习教师版docx、专题七大题突破3化学综合实验--2025年高考化学大二轮专题复习学生版docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
以无机物制备为主线的综合实验
以有机物制备、提取、纯化为主线的综合实验
以物质性质探究为主的综合实验
1.有气体参与的物质制备综合题考向分析
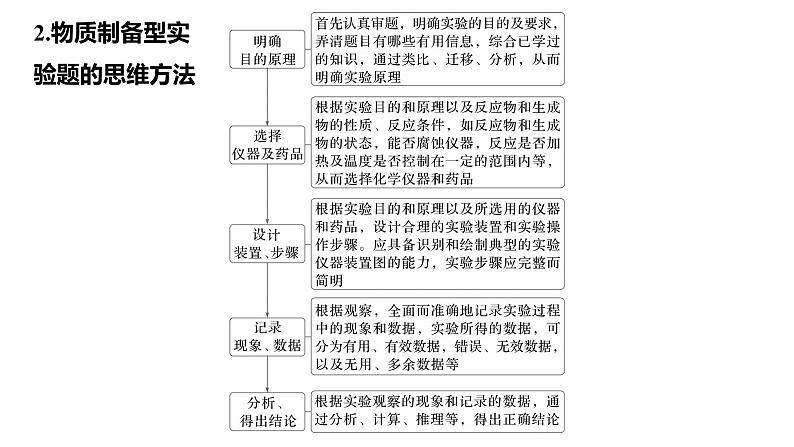
2.物质制备型实验题的思维方法
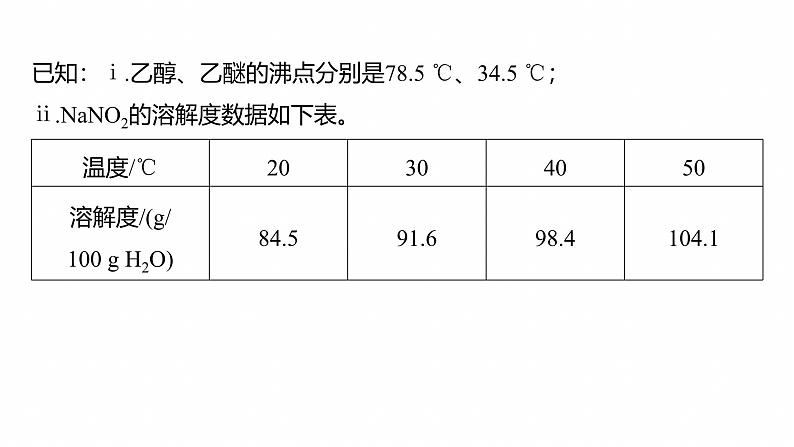
1.[2023·河北,15(1)(2)(3)(4)(5)]配合物Na3[C(NO2)6](M=404 g·ml-1)在分析化学中用于K+的鉴定,其制备装置示意图(夹持装置等略)如图,步骤如下:①向三颈烧瓶中加入15.0 g NaNO2和15.0 mL热蒸馏水,搅拌溶解。②磁力搅拌下加入5.0 g C(NO3)2·6H2O,从仪器a加入50%醋酸7.0 mL。冷却至室温后,再从仪器b缓慢滴入30%双氧水8.0 mL。待反应结束,滤去固体。③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:ⅰ.乙醇、乙醚的沸点分别是78.5 ℃、34.5 ℃;ⅱ.NaNO2的溶解度数据如下表。
12NaNO2+2C(NO3)2+H2O2+2CH3COOH===
2Na3[C(NO2)6]+4NaNO3+2CH3COONa+2H2O
增加NaNO2的溶解度
(5)已知:2K++Na++[C(NO2)6]3- K2Na[C(NO2)6]↓(亮黄色),足量KCl与1.010 g产品反应生成0.872 g亮黄色沉淀,产品纯度为 %。
解有机物制备类实验题的思维模型
2.(2024·黑吉辽,17)某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下:Ⅰ.向50 mL烧瓶中分别加入5.7 mL 乙酸(100 mml)、8.8 mL乙醇(150 mml)、1.4 g NaHSO4固体及4~6滴1‰甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。Ⅱ.加热回流50 min后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
Ⅲ.冷却后,向烧瓶中缓慢加入饱和Na2CO3溶液至无CO2逸出,分离出有机相。Ⅳ.洗涤有机相后,加入无水MgSO4,过滤。Ⅴ.蒸馏滤液,收集73~78 ℃馏分,得无色液体6.60 g,色谱检测纯度为98.0%。
回答下列问题:(1)NaHSO4在反应中起 作用,用其代替浓H2SO4的优点是_______ (答出一条即可)。
(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可___________________________________ 。(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是 (填标号)。A.无需分离B.增大该反应平衡常数C.起到沸石作用,防止暴沸D.不影响甲基紫指示反应进程
吸收生成的水,使平衡正向移动,提高
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是 (填名称)。
(5)该实验乙酸乙酯的产率为 (精确至0.1%)。
1.研究物质性质的基本方法和程序
注意事项:(1)若探究影响物质性质的因素,首先应确定变量,其次是“定多变一”,即其他因素不变,只改变一种因素,看这种因素与探究的问题存在怎样的关系。(2)多角度辩证地看问题①研究反应物中各微粒的性质(即内因)。②研究反应条件的影响(如温度、浓度、环境中的其他物质)。
2.物质性质综合实验探究题的审题思路
3.(2024·湖北,18)学习小组为探究C2+、C3+能否催化H2O2的分解及相关性质,室温下进行了实验Ⅰ~Ⅳ。
吸收产生的H+,维持pH,促进反应正
+6H2O+4CO2↑
2H2O2 2H2O+O2↑
实验Ⅲ的现象表明,C3+、C2+分别与
(4)实验Ⅳ中,A到B溶液变为蓝色,并产生气体;B到C溶液变为粉红色,并产生气体。从A到C所产生的气体的分子式分别为 、 。
(1)c(2)吡咯中含有—NH—,可以形成分子间氢键(3)(4)将环氧乙烷溶液沿烧杯壁缓缓加入,并不断用玻璃棒搅拌(5)与水解生成的OH-反应,使水解更彻底(6)球形冷凝管和分液漏斗 除去水(7)70.0%
(1)分液漏斗(2)A 用生成的氮气排尽装置中的空气(3)反应为放热反应,反应放出的热量可以维持反应的持续进行 降低温度,防止装置D加热之前锂和氮气发生反应 干燥氮气(4)Li3N+3H2O===3LiOH+NH3↑ BC(5)87.5
(1)Fe2+(2)FeCl3溶液中存在水解平衡:Fe3++3H2O Fe(OH)3+3H+,加入锌粉,H+被消耗,Fe3+的水解平衡正向移动,产生氢氧化铁沉淀(3)①0.5 ②NO2 过滤,取少量深棕色溶液,加热,溶液棕色变浅,液面上方产生红棕色气体 ③Fe2+与NO结合生成[Fe(NO)]2+,溶液中Fe2+的浓度减小,使得Fe2+与Zn反应的化学反应速率减小(4)溶剂 阴离子种类
1.(2023·河北邢台高三模拟)Na2S2O3是重要的化学试剂,遇高温分解,与酸发生反应。实验室可通过如图所示装置制备Na2S2O3。
(1)仪器A的名称为 。
(2)下列关于装置B的作用叙述错误的是 (填字母)。a.通过观察气泡可控制SO2气流速率b.防止发生倒吸c.通过长颈漏斗液面升降判断B后面 装置是否堵塞(3)C中生成产品的化学方程式为___________________________________。(4)为保证硫代硫酸钠的产率和纯度,实验中通入的SO2不能过量,原因是 。
2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2
Na2S2O3与酸反应,过量SO2会使溶液呈酸性
滴入最后半滴碘的标准溶液,溶液变为蓝色,且半分
(6)下列装置和试剂不能代替E的是 (填字母)。
2.(2023·辽宁,17)2⁃噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10 ℃,加入25 mL噻吩,反应至钠砂消失。Ⅲ.制噻吩乙醇钠。降温至-10 ℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。Ⅳ.水解。恢复室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92 g。
(1)步骤Ⅰ中液体A可以选择 。a.乙醇b.水c.甲苯d.液氨
(2)噻吩沸点低于吡咯( )的原因是_________________________________ 。
(3)步骤Ⅱ的化学方程式为 。(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是___________________________________________________。(5)步骤Ⅳ中用盐酸调节pH的目的是_________________________________。
吡咯中含有—NH—,可以形成分子间氢键
将环氧乙烷溶液沿烧杯壁缓缓加入,并不断用玻璃棒搅拌
与水解生成的OH-反应,使水解更彻底
(6)下列仪器在步骤Ⅴ中无需使用的是 (填名称);无水MgSO4的作用为 。
(7)产品的产率为 (用Na计算,精确至0.1%)。
3.(2023·广东清远高三联考)全球对锂资源的需求不断增长,从海水、盐湖中提取锂越来越受到重视。金属锂(Li)的化学性质与镁相似,在加热的条件下锂能与氮气反应生成氮化锂(Li3N,遇水剧烈反应)。某课题组设计了如图实验装置制备氮化锂(部分夹持装置省略)并测定其纯度。回答下列问题:
已知:实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵(NH4Cl)溶液经加热后反应制取氮气,该反应为放热反应。
(1)盛装NaNO2溶液的仪器名称为 。(2)实验开始先点燃 (填“A”或“D”)处酒精灯,这样做的目的是__ 。
生成的氮气排尽装置中的空气
(3)经查阅资料得知,装置A处不需要持续加热,分析可能的原因:_____ ;装置B的作用是_____________________________________________;装置C中盛装的试剂为碱石灰,其作用为 。
为放热反应,反应放出的热量可以维持反应的持续进行
降低温度,防止装置D加热之前锂和氮气发生反应
(4)测定Li3N产品纯度,装置如图:取0.04 g Li3N产品于蒸馏烧瓶中,打开止水夹,通过安全漏斗向蒸馏烧瓶中加入足量的水。Li3N遇水发生反应的化学方程式为 ;G中的液体可选择 (填字母)。A.蒸馏水B.煤油C.石蜡油D.饱和食盐水
Li3N+3H2O===3LiOH+NH3↑
(5)当反应完全后,测得NH3体积为22.4 mL(已折合成标准状况)。该Li3N产品的纯度为 %。
4.某小组同学根据Fe3+、Fe2+和Zn2+的氧化性推断溶液中Zn与Fe3+可能先后发生两个反应:2Fe3++Zn===2Fe2++Zn2+,Fe2++Zn===Fe+Zn2+,进行如下实验。
(1)实验Ⅰ结束后,Fe3+的最终还原产物为 。
(2)结合化学用语解释实验Ⅱ中产生红褐色浑浊的原因:___________________________________________________________________________________________________________________。
在水解平衡:Fe3++3H2O Fe(OH)3+3H+,加入锌粉,H+被消耗,Fe3+的水解平衡正向移动,产生氢氧化铁沉淀
(3)实验Ⅲ和Ⅳ:用Fe2(SO4)3溶液和Fe(NO3)3溶液替代实验Ⅱ中的FeCl3溶液:
资料:Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
②甲同学根据实验Ⅲ的现象,判断溶液中一定存在[Fe(NO)]2+,乙同学认为甲的结论不正确。深棕色可能是生成的 导致的现象。乙同学设计了一个实验证明了深棕色溶液中存在[Fe(NO)]2+。其实验操作和现象是____________________________________________________________________。
过滤,取少量深棕色溶液,加热,溶液棕色变浅,液面上方产生红棕色气体
③对比实验Ⅱ和Ⅲ、Ⅳ,Fe(NO3)3溶液与过量锌粉反应没有生成铁的原因可能是______________________________________________________________________________________。
Fe2+与NO结合生成[Fe(NO)]2+,溶液中Fe2+的浓度减小,使得
Fe2+与Zn反应的化学反应速率减小
(4)实验Ⅴ:将实验Ⅱ中FeCl3溶液换成FeCl3无水乙醇,加入足量锌粉,片刻后,反应放热,有大量铁产生。由实验Ⅰ~Ⅴ可知:反应足够长时间后,锌能否与Fe3+反应得到单质铁,与Zn和Fe3+的物质的量、Fe3+的浓度、 、 等有关。
(1)①Li3N+3H2O===3LiOH+NH3↑②液封,防止气体逸出(2)蓝色沉淀消失 4 8 2H2O 4 4OH-(3)打开K4,三颈烧瓶中溶液蓝色复原 催化
(1)浓氨水 除去CO2中的HCl气体 防止倒吸(2)K2 关闭K2,打开K1(3)防止碳酸氢铵分解,同时降低碳酸镧的溶解度,利于生成沉淀(4)2LaCl3+6NH4HCO3===La2(CO3)3↓+6NH4Cl+3H2O+3CO2↑ (5)La3+完全沉淀,再滴入NaHCO3溶液时,碳酸氢根离子水解使溶液的碱性增强,溶液的pH发生突跃(6)7∶1
1.贵重金属的回收利用是当今科学研究的重要课题。黄金不仅是重要的化工原料,还具有货币属性。提取金的方法之一是用硫代硫酸盐在弱碱性条件下浸金。实验室模拟工业浸取电路板中金的过程如图甲所示,金的浸取原理如图乙所示。
(1)打开K1、K3,关闭K2、K4,向A中烧瓶加水,制取NH3。①请写出A装置中发生反应的化学方程式: 。②安全漏斗的作用除加水外,还有 。
(3)为了验证图乙原理中O2的作用,进行如下实验:关闭K4,反应一段时间后,温度无明显变化,U形管内液柱左高右低,三颈烧瓶中溶液蓝色变浅。然后__________ (填操作和现象),此现象证实了上述原理中O2的作用。由上述原理可知,[Cu(NH3)4]2+在浸金过程中起 作用。
三颈烧瓶中溶液蓝色复原
2.碳酸镧[La2(CO3)3,相对分子质量为458]能抑制人体内磷酸盐的吸收,降低体内血清磷酸盐和磷酸钙的水平,常用于慢性肾衰患者高磷血症的治疗。某课外小组成员进行实验探究La2(CO3)3的制备方法。已知:①La2(CO3)3难溶于水,易溶于盐酸,溶液pH较高时易生成碱式碳酸镧[La(OH)CO3,相对分子质量为216]。②氯化镧(LaCl3)与易溶的碳酸盐或碳酸氢盐反应可制备La2(CO3)3。
Ⅰ.利用氯化镧溶液与碳酸氢铵溶液制备碳酸镧(装置如图1,其中夹持装置已略去)。
实验步骤如下:ⅰ.连接好实验装置,检查装置的气密性,关闭K1、K2、K3和K4。ⅱ.实验时应先打开活塞__________(填“K1”或“K2”)和K3,持续通入一段时间气体。ⅲ. ,继续通入一段时间另一种气体。ⅳ.……,最终制得碳酸镧沉淀。
(1)试剂b的名称是 ,试剂a的作用是____________________。装置中硬质玻璃管的作用是 。(2)将操作ⅱ空白处补充完整: ,将操作ⅲ空白处补充完整:______ 。
除去CO2中的HCl气体
(3)实验时,将三颈烧瓶放入冷水中的主要原因是_________________________________________________________。(4)氯化镧溶液与碳酸氢铵溶液反应的化学方程式为__________________ 。
同时降低碳酸镧的溶解度,利于生成沉淀
2LaCl3+6NH4HCO3
===La2(CO3)3↓+6NH4Cl+3H2O+3CO2↑
Ⅱ.利用碳酸氢钠溶液与氯化镧溶液制备碳酸镧。(5)将一定浓度的NaHCO3溶液滴入氯化镧溶液中,利用手持技术测得氯化镧溶液的pH随加入NaHCO3溶液的体积的变化如图2。试分析bc段发生pH突变的原因:_______________________________________________________________________________________。
La3+完全沉淀,再滴入NaHCO3
溶液时,碳酸氢根离子水解使溶液的碱性增强,溶液的pH发生突跃
Ⅲ.碳酸镧粗产品[设杂质只有La(OH)CO3]组成的测定。(6)准确称取6.844 g粗产品,溶于10.00 mL稀盐酸中,加入10.00 mL NH3⁃NH4Cl缓冲溶液和0.200 g紫脲酸铵混合指示剂,用0.5 ml·L-1 EDTA(Na2H2Y)标准溶液滴定至溶液呈蓝紫色(La3++H2Y2-===LaY-+2H+),消耗60.00 mL EDTA标准溶液。则产品中n(碳酸镧)∶n(碱式碳酸镧)= 。
3.(2023·河南新乡统考模拟)苯甲酸可用于医药、染料载体、增塑剂、果汁饮料的保香剂和食品防腐剂等的生产。某化学兴趣小组欲在实验室制备苯甲酸、回收二氧化锰并测定其纯度,进行如下实验:苯甲酸实验室制备原理为:
实验装置如图所示。已知:甲苯的密度是0.872 g·mL-1;苯甲酸微溶于冷水,溶于热水。实验步骤:Ⅰ.在50 mL三颈烧瓶中加入1.5 mL甲苯、20 mL水和5.0 g高锰酸钾,油浴加热至反应结束。Ⅱ.将反应液趁热减压过滤,得到滤渣1,滤液呈紫色,加入少量亚硫酸钠使紫色褪去,进行二次减压过滤,得到滤渣2;将滤液放入冰水浴中,然后加酸酸化,有晶体析出,减压过滤,洗涤、干燥,得到苯甲酸晶体。
(1)仪器A的名称为 ,该装置的作用是_____ 。(2)步骤Ⅰ中,判断反应结束的现象是__________________。(3)步骤Ⅱ中加酸酸化,加的酸可以是 (填序号)。①稀硫酸 ②盐酸滤液放入冰水浴的原因是_________________________________________ 。
回流,提高反应物的利用率
降低苯甲酸的溶解度,使苯甲酸充分析出,提
(4)滤渣2的主要成分为MnO(OH)2,请写出生成MnO(OH)2的离子方程式:___________________________________ 。(5)用高锰酸钾标准溶液滴定时,滴定终点的现象是_____________________________________________________________________,二氧化锰的纯度为 %。
加最后半滴高锰酸钾标准溶液时,溶液变为浅红色,且半分钟内不褪色
4.环己酮( )是一种重要的化工原料,一种由H2O2氧化环己醇制备环己酮的实验方法如下:
(1)FeCl3的作用是 ;加入食盐的目的是_____________________ 。(2)环己酮的产率受H2O2用量的影响,当环己酮产率达最大值后,增加H2O2的用量其产率反而下降,原因是 。
环己酮进一步被氧化,发生开环反应
(3)减压蒸馏的装置如图所示,为了便于控制温度,加热方式最好选用 (填“水浴”或“油浴”)。进行减压蒸馏时,使用磁力加热搅拌器加热,磁子的作用除搅拌使混合物均匀受热外,还有 。减压蒸馏的操作顺序为打开双通旋塞,打开真空泵,缓慢关闭双通旋塞,接通冷凝水,开启磁力加热搅拌器,进行减压蒸馏。减压蒸馏完成后,需进行下列操作,正确的操作顺序是 (填字母)。a.关闭真空泵b.关闭磁力加热搅拌器,冷却至室温c.缓慢打开双通旋塞d.停止通冷凝水
(4)本实验中环己酮的产率为 (结果保留2位有效数字)。
相关课件
这是一份专题五 大题突破1 热化学、化学反应速率与平衡的综合分析--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题五大题突破1热化学化学反应速率与平衡的综合分析--2025年高考化学大二轮专题课件pptx、专题五大题突破1热化学化学反应速率与平衡的综合分析AB两练--2025年高考化学大二轮专题复习专练docx、专题五大题突破1热化学化学反应速率与平衡的综合分析--2025年高考化学大二轮专题复习教师版docx、专题五大题突破1热化学化学反应速率与平衡的综合分析--2025年高考化学大二轮专题复习学生版docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份专题七 主观题突破4 综合大题中气体体积、固体质量的测定--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题七主观题突破4综合大题中气体体积固体质量的测定--2025年高考化学大二轮专题课件pptx、专题七主观题突破4综合大题中气体体积固体质量的测定--2025年高考化学大二轮专题复习专练docx、专题七主观题突破4综合大题中气体体积固体质量的测定--2025年高考化学大二轮专题复习教师版docx、专题七主观题突破4综合大题中气体体积固体质量的测定--2025年高考化学大二轮专题复习学生版docx等4份课件配套教学资源,其中PPT共57页, 欢迎下载使用。
这是一份专题七 主观题突破2 实验仪器连接及现象作用描述--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题七主观题突破2实验仪器连接及现象作用描述--2025年高考化学大二轮专题课件pptx、专题七主观题突破2实验仪器连接及现象作用描述--2025年高考化学大二轮专题复习专练docx、专题七主观题突破2实验仪器连接及现象作用描述--2025年高考化学大二轮专题复习教师版docx、专题七主观题突破2实验仪器连接及现象作用描述--2025年高考化学大二轮专题复习学生版docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。









