



安徽省阜阳市第一中学2024-2025学年高二上学期期中考试化学试题(Word版附解析)
展开
这是一份安徽省阜阳市第一中学2024-2025学年高二上学期期中考试化学试题(Word版附解析),文件包含安徽省阜阳市第一中学2024-2025学年高二上学期期中考试化学试题Word版含解析docx、安徽省阜阳市第一中学2024-2025学年高二上学期期中考试化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
说明:1.考试时间:75分钟 试卷满分:100分 考试时间:2024.11
2.答题前请把答题卷上的所有信息填写完整,并把所有答案填写在答题卷上。
相对原子量H:1 C:12 O:16 K:39 Fe:56
第Ⅰ卷
一、选择题(本大题共14题,每题3分,共计42分。在每小题列出的四个选项中,只有一项最符合题目要求。)
1. 下列依据热化学方程式得出的结论正确的是
A. 已知:①2②,则a>b
B. 丙烷燃烧生成水和二氧化碳所放出的热量是丙烷的燃烧热
C. 稀盐酸和稀溶液反应的中和反应反应热,则含的稀硫酸与足量氢氧化钡溶液反应放出的热量为
D. 已知,则和中化学键的总键能大于和中化学键的总键能
【答案】D
【解析】
【详解】A.H2O(g)转化成H2O(l)放出热量,则2mlH2(g)和1mlO2(g)完全反应生成2mlH2O(l)放出的热量>生成2mlH2O(g)放出的热量,即b>a,A错误;
B.燃烧热是101kpa时,1ml纯物质完全燃烧生成指定产物时所放出的热量,题中不能确定生成的是气态水还是液态水,B错误;
C.中和反应反应热是稀溶液中酸碱反应生成1mlH2O时的反应热,含的稀硫酸与足量氢氧化钡反应除生成2ml水外,还生成了硫酸钡,放出的热量大于114.6kJ,C错误;
D.△H=反应物的总键能-生成物的总键能,该反应△H为正值,所以和中化学键的总键能大于和中化学键的总键能,D正确;
答案选D。
2. 一定条件下,反应的速率可表示为,其中k为反应速率常数。该反应在不同浓度下的反应速率如下:
根据表中的测定数据判断,下列结论不正确的是
A. α、β的值分别为1、1.5
B. 表中x的值为2
C. 反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大
D. 同时减小H2(g)和HBr(g)浓度,反应速率不一定增大
【答案】B
【解析】
【详解】A.由第2、3组实验数据:当c(Br2)=0.4 ml/L,c(HBr)=2 ml/L,c(H2)由0.1 ml/L变为0.2 ml/L,H2的浓度是原来的2倍,化学反应速率就由8v变为16v,化学反应速率也是原来的2倍,说明α=1;由第1、2组实验数据:当c(H2)=0.1 ml/L,c(HBr)=2 ml/L时,c(Br2)由0.1 ml/L变为0.4 ml/L浓度是原来的4倍,化学反应速率由v变为8v,是原来的8倍,带入速率公式可得β=1.5,A正确;
B.将第一组、第四组数据带入速率公式,,解得x=1,B错误;
C.由于在化学反应速率公式中,速率与c(H2)呈正比,是c(Br2)的1.5次幂,而与c(HBr)成反比,因此反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大,C正确;
D.根据速率公式中速率大小与c(H2)、c(HBr)的关系,若c(H2)、c(HBr)减小倍数相同,则化学反应速率不变;若减小倍数不同,反应速率可能是增大,也可能是减小,D正确;
故答案选B。
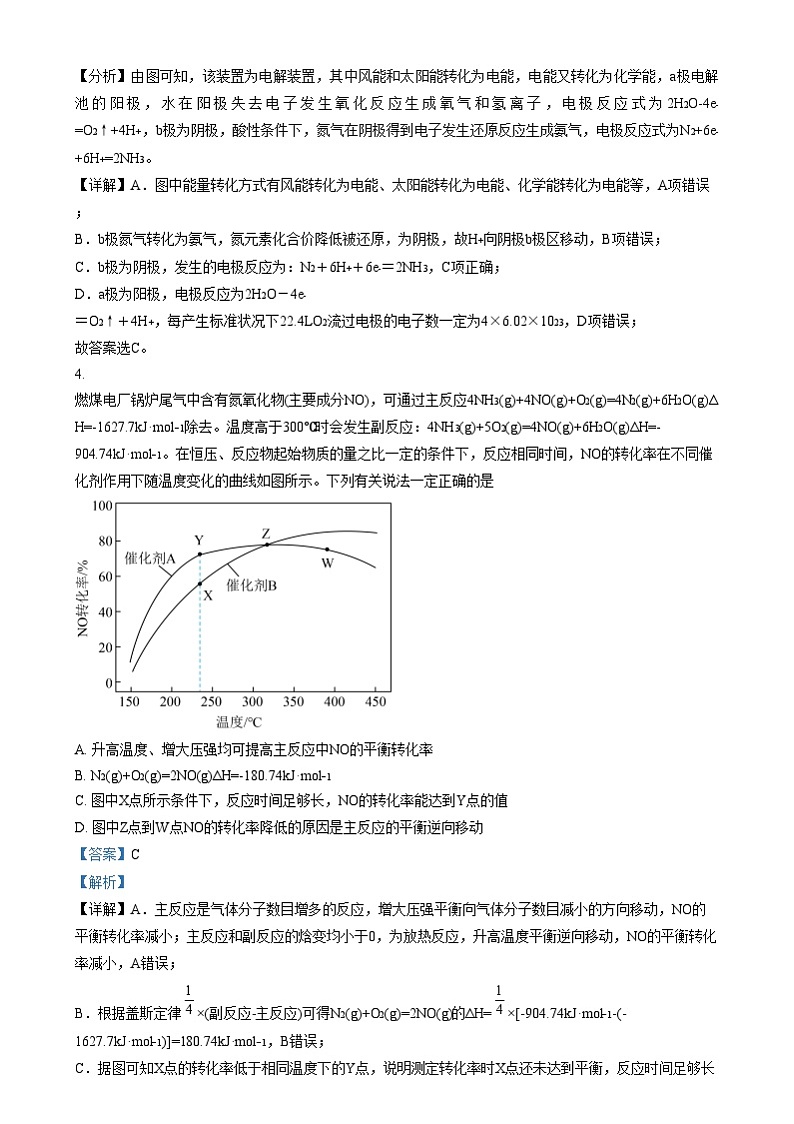
3. 研究人员成功实现在常温常压下用氮气和水生产氨气,原理如图所示。下列说法正确的是
c(H2)/(ml·L-1)
c(Br2)/(ml·L-1)
c(HBr)/(ml·L-1)
反应速率
0.1
0.1
2
v
0.1
0.4
2
8v
0.2
0.4
2
16v
0.2
0.1
x
4v
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应式为:
D. a极上每产生标况下22.4LO2转移的电子数约为2×6.02×1023
【答案】C
【解析】
【分析】由图可知,该装置为电解装置,其中风能和太阳能转化为电能,电能又转化为化学能,a极电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e-=O2↑+4H+,b极为阴极,酸性条件下,氮气在阴极得到电子发生还原反应生成氨气,电极反应式为N2+6e-+6H+=2NH3。
【详解】A.图中能量转化方式有风能转化为电能、太阳能转化为电能、化学能转化为电能等,A项错误;
B.b极氮气转化为氨气,氮元素化合价降低被还原,为阴极,故H+向阴极b极区移动,B项错误;
C.b极为阴极,发生的电极反应为:N2+6H++6e-=2NH3,C项正确;
D.a极为阳极,电极反应为2H2O-4e-=O2↑+4H+,每产生标准状况下22.4LO2流过电极的电子数一定为4×6.02×1023,D项错误;
故答案选C。
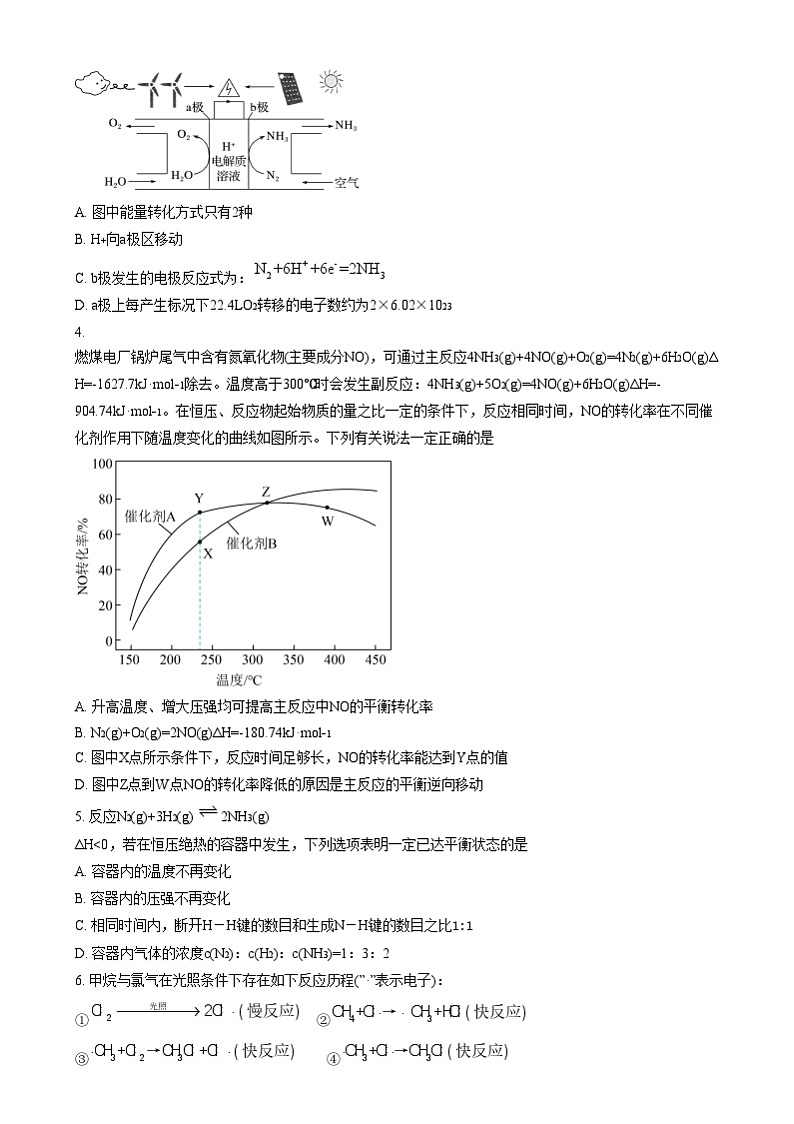
4. 燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过主反应4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)ΔH=-1627.7kJ·ml−1除去。温度高于300℃时会发生副反应:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=-904.74kJ·ml−1。在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示。下列有关说法一定正确的是
A. 升高温度、增大压强均可提高主反应中NO的平衡转化率
B. N2(g)+O2(g)=2NO(g)ΔH=-180.74kJ·ml−1
C. 图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值
D. 图中Z点到W点NO的转化率降低的原因是主反应的平衡逆向移动
【答案】C
【解析】
【详解】A.主反应是气体分子数目增多的反应,增大压强平衡向气体分子数目减小的方向移动,NO的平衡转化率减小;主反应和副反应的焓变均小于0,为放热反应,升高温度平衡逆向移动,NO的平衡转化率减小,A错误;
B.根据盖斯定律×(副反应-主反应)可得N2(g)+O2(g)=2NO(g)的ΔH=×[-904.74kJ·ml−1-(-1627.7kJ·ml−1)]=180.74kJ·ml−1,B错误;
C.据图可知X点的转化率低于相同温度下的Y点,说明测定转化率时X点还未达到平衡,反应时间足够长,NO的转化率能达到Y点的值,C正确;
D.催化剂不影响平衡转化率,而W点的转化率低于相同温度下另一催化剂条件下的转化率,说明W点并没有处于平衡状态,所以转化率降低不可能是平衡移动造成,D错误;
综上所述答案为C。
5. 反应N2(g)+3H2(g) 2NH3(g) ΔHH2CO3,则CH3COOH的Ka大于H2CO3的Ka1,能探究的与的的大小,A不符合题意;
B.CH3COONH4是弱酸弱碱盐,其溶液中铵根离子会促进醋酸根离子的水解,NaHCO3溶液中钠离子不影响碳酸氢根离子的水解,所以测定等浓度的和溶液的pH值,不能比较和的水解常数,B符合题意;
C.存在化学平衡:,当往外抽拉注射器时,管内容积增大,气体压强减小,浓度变小,混合气体的颜色先变浅又逐渐变深,颜色逐渐变深说明平衡逆向移动,即减小压强,平衡向气体分子数增大的方向移动,能探究压强对化学平衡的影响,C不符合题意;
D.向3mL浓度分别为0.1 ml·L-1NaCl和0.1 ml·L-1NaI混合溶液中滴加几滴AgNO3 溶液,出现黄色沉淀 ,说明Cl- 和I- 起始浓度相同时,先生成黄色的AgI 沉淀,说明Ksp(AgI)小于Ksp(AgCl),能比较与的大小,D不符合题意;
故选B。
11. 已知反应:X(g)+Y(g)2Z(g) ∆H<0,400℃时该反应的化学平衡常数K=1。一定条件下,分别在甲、乙、丙3个恒容密闭容器中加入X和Y,反应体系中各物质的物质的量浓度的相关数据如表:
D
向3mL浓度分别为0.1 ml·L-1NaCl和0.1 ml·L-1NaI混合溶液中滴加几滴0.1 ml·L-1溶液,出现黄色沉淀
比较与的大小
容器
温度/℃
起始时物质的浓度/(ml•L-1)
10分钟时物质的浓/(ml•L-1)
c(X)
c(Y)
c(Z)
甲
400
1
1
0.5
下列说法中,不正确的是
A. 甲中,10分钟内X的化学反应速率:v(X)=0.025ml•L-1•min-1
B. 甲中,10分钟时反应已达到化学平衡状态
C. 乙中,可能T1<400℃
D. 丙中,a>0.5
【答案】B
【解析】
【详解】A.甲中,10分钟时生成了0.5ml/L的Z,根据方程式可知,反应掉的X的浓度为0.25ml/L,则10分钟内X的化学反应速率:v(X)=0.025ml•L-1•min-1,A正确;
B.在10分钟的时,由表格知生成的Z的浓度为0.5ml/L,则X、Y都反应掉了0.25ml/L,还剩余0.75ml/L,由此算出此时的浓度熵为,即反应正向进行,平衡正向移动,B错误;
C.乙中,X、Y的起始浓度相同,但10分钟后生成物Z的浓度却比甲要小,说明乙容器中反应速率比乙容器小,则可以为降温温度导致,故C正确;
D.对比甲和丙,丙中增加了Y的浓度,则反应速率加快,相同时间之内生成的Z更多,故丙中a>0.5,D正确;
故选B。
12. 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现时(各物质均为气态),与水在铜催化剂上的反应机理和能量变化如图:
下列说法正确的是
A. 该过程的决速步骤为反应Ⅱ
乙
T1
1
1
0.4
丙
400
1
2
a
B. 和的总能量大于和的总能量
C. 反应Ⅱ的热化学方程式为
D. 选择合适的催化剂可降低反应Ⅰ和Ⅱ的活化能,改变总反应的焓变
【答案】C
【解析】
【详解】A.由图知,反应Ⅰ的活化能大于反应Ⅱ的活化能,故反应Ⅰ为该过程的决速步,A错误;
B.从能量图看1mlCH3OH(g) 和1mlH2O(g)的总能量低于1mlCO2(g)和3H2(g)的总能量,B错误;
C.催化机理看,CO(g)和H2O为该反应的中间产物,从能量图看CO(g)和H2O(g)的总能量高于H2(g)和CO2(g),所以该反应的热化学方程式为反应Ⅱ的热化学方程式为 ,C正确;
D.催化剂改变反应历程从而降低活化能,所以选择合适的催化剂可降低反应Ⅰ和反应Ⅱ的活化能,但不能改变总反应的焓变值,D错误;
故选C。
13. 下列说法正确的是
A. 室温下,向20mLpH=12的稀氨水中加入5mLpH=12氢氧化钠溶液,的电离平衡不移动
B. 向醋酸溶液中加入冰醋酸,醋酸电离度增大,氢离子浓度增大
C. 用等浓度的溶液分别中和等值的、溶液,消耗的体积大,说明酸性HFc(OH)>c(H+) ③. 酸性
(4)2×10-3 (5)4NaOH+NaClO+2NiSO4=2NiO(OH)↓+NaCl+2Na2SO4+H2O
【解析】
【分析】某NiO的废料中有FeO、Al2O3、MgO、SiO2等杂质,加入稀硫酸溶解后过滤得到滤渣1为SiO2,滤液为NiSO4、FeSO4、Al2(SO4)3、MgSO4,加入过氧化氢氧化亚铁离子为铁离子,再加入碳酸钠溶液调节溶液PH,使铁离子、铝离子全部沉淀,过滤得到滤渣2为氢氧化铁和氢氧化铝沉淀,滤液中加入NH4F沉淀Mg2+,生成沉淀滤渣3为MgF2,过滤得到的滤液,滤液中获得NiSO4•6H2O晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到晶体,失去结晶水得到硫酸镍,以此解答该题。
【小问1详解】
在酸性条件下,H2O2把Fe2+氧化为Fe3+,离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O;
【小问2详解】
由图可知,pH=5时,Al3+和Fe3+都已经完全沉淀,因此滤渣2的成分为Fe(OH)3、Al(OH)3;
【小问3详解】
NaF为强碱弱酸盐,F-水解显碱性,离子浓度关系为:c(Na+)>c(F-)>c(OH)>c(H+);
【小问4详解】
已知沉淀前溶液中c(Mg2+)=185×10-3ml•L-1,当除镁率达到99%时,c(Mg2+)=1.85×10-5ml•L-1,Ksp(MgF2)=c(Mg2+)c2(F-)=7.4×10-11,c(F-)=2.0×10-3ml/L;
故答案为:2.0×10-3ml/L;
【小问5详解】
在NaOH作用下,NaClO把NiSO4中二价Ni离子氧化为NiO(OH),自身还原为NaCl,化学方程式为:4NaOH+NaClO+2NiSO4=2NiO(OH)↓+NaCl+2Na2SO4+H2O。
17. 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白以及食品消毒、水处理、杀菌灭藻和鱼药制造。某校化学实验探究小组设计如图实验,用为原料制备亚氯酸钠。
已知:①
②饱和溶液中析出的晶体成分与温度的关系如表所示:
③极易溶于水,不与水反应,沸点11℃。
(1)漂白剂有多种类型,从漂白原理来看,与亚氯酸钠均属于同类型的漂白剂有_______。
A. B. 活性炭、C. 漂白粉、D.
(2)B中使用浓硫酸而不用稀硫酸的原因是_______。
(3)B中发生的反应,氧化剂与还原剂物质的量之比为_______。
(4)装置C的作用为_______,装置D中生成的离子方程式为_______。
(5)装置D溶液采用结晶法提取晶体,控制温度为_______℃(填写范围)减压蒸发结晶,趁热过滤,左右热水洗涤,低于条件下干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是_______。
【答案】(1)D (2)稀硫酸含水多,而ClO2极易溶于水,不利于ClO2逸出
(3)2:1 (4) ① 安全瓶,防止倒吸 ②. ClO2+2OH-+H2O2=2+2H2O+O2↑
(5) ①. 38~60 ②. NaClO3和NaCl
【解析】
【分析】本实验欲利用ClO2制备NaClO2,根据实验装置,利用装置B制备ClO2,装置C用于缓冲,防止D装置中的液体倒吸,装置D用于NaClO2的合成,装置A和E吸收废气,防止污染空气;
【小问1详解】
温度
晶体成分
分解成和NaCl
漂白剂有多种类型,从漂白原理来看,亚氯酸钠、HClO、H2O2、漂白粉都具有强氧化性,可用于漂白,二氧化硫与有色物质发生化合反应结合成无色物质,活性炭是利用吸附性漂白,故与亚氯酸钠均属于同类型的漂白剂有HClO、H2O2、漂白粉,故答案为:D;
【小问2详解】
装置B利用浓硫酸、NaClO2和Na2SO3制备ClO2,制备过程中应使用浓硫酸,若使用稀硫酸,反应过程中会带出少量水气,极易溶解生成的ClO2,影响后续的产率,故答案为:稀硫酸含水多,而ClO2极易溶于水,不利于ClO2逸出;
【小问3详解】
B中发生的反应为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,NaClO3为氧化剂,Na2SO3为还原剂,氧化剂与还原剂物质的量之比为2:1,故答案为:2:1;
【小问4详解】
装置C的作用为安全瓶,防止D中液体倒吸至B中;
装置D用于制备NaClO2,反应中H2O2氧化ClO2同时与NaOH作用生成NaClO2,反应的离子方程式为2ClO2+2OH-+H2O2=2+2H2O+O2↑,故答案为:2ClO2+2OH-+H2O2=2+2H2O+O2↑;
【小问5详解】
根据已知条件NaClO2在38~60℃之间时蒸发结晶得到纯净的NaClO2,不含有结晶水,也不会分解出杂质,因此实验中应选择38~60℃进行减压蒸发结晶,反应后,经以下步骤可从装置D的溶液获得NaClO2晶体:55℃蒸发结晶→趁热过滤→38~60℃热水洗涤→低于60℃干燥,得到成品,如果干燥温度过高可能导致产品中混有的杂质是NaClO3和NaCl,故答案为:38~60;NaClO3和NaCl。
18. 研究烟气脱硝是环境保护、促进社会可持续发展的重要课题。
(1)一种隔膜电化学法可处理燃煤烟气中的NO,装置如图所示。
①阴极区的电极反应式为_______。
②若电路中转移了1ml电子,则理论上吸收池中可处理NO_______L(标准状况)。
(2)臭氧是一种理想的烟气脱硝剂。氧化NO并通过水洗而发生化合反应生成,该反应的化学
方程式为_______。
(3)脱硝还可发生反应 。时,向2.0L恒容密闭容器中充入和,反应过程中测定的部分数据见下表:
①反应在内的平均速率_______。
②下列描述中能说明上述反应已达平衡的是_______。(填字母)
a.混合气体密度不再变化 b.单位时间内消耗的同时生成
c. d.混合气体压强不再变化
(4)将模拟烟气(一定比例和)以一定流速通过装有催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。
①温度低于350℃时,NOx转化率随温度升高而增大,其可能原因是_______。
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是_______。
【答案】(1) ①. 2+2e-+2H+=+H2O ②. 11.2
(2)O3+2NO+H2O=2HNO3
(3) ①. 0.12ml·L-1·s-1 ②. cd
(4) ①. 度升高、催化剂活性增强均使活化分子百分数增加,单位时间内活化分子有效碰撞次数增加,化学反应速率加快 ②. 温度高于450℃时,NH3与O2反应生成较多量NOx,使得流出反应管的NOx总量超过流入反应管的NOx总量
【解析】
0
3
6
12
24
0
0.36
0.60
0.80
0.80
【小问1详解】
①由装置图可知,电解池左侧为阴极,将转化为,电极反应式为:2+2e-+2H+=+H2O;
②NO吸收转化后的变为 N2,1mlNO转移2ml电子,通电时电路中转移了1mle-,说明吸收NO的物质的量为0.5ml,理论上吸收的 NO在标准状况下的体积为:0.5ml×22.4L/ml=11.2L;
【小问2详解】
O3氧化NO结合水洗可产生HNO3,O3作氧化剂,NO是还原剂,其反应方程式为:O3+2NO+H2O=2HNO3;
【小问3详解】
①0~3s内,Δn(O2)=0.36ml,Δn(NO2)=0.36ml×2=0.72ml,v(NO2)==0.12ml•L-1•s-1;
②a.根据质量守恒,混合气体的质量始终不变,容器体积不变,则气体的密度始终不变,当气体的密度不再改变,不能表明反应已达到平衡状态,故a错误;
b.单位时间内消耗2mlNO2的同时生成1mlO2,只指明正反应速率,不能说明反应达到平衡状态,故b错误;
c. v(NO2)正=2v(N2O5)逆=v(NO2)逆,说明反应达到平衡状态,故c正确;
d.该反应是气体体积减小的反应,随着反应进行,混合气体压强减小,当混合气体压强不再变化,说明反应达到平衡状态,故d正确;
故答案为:cd;
【小问4详解】
①由图可知,温度低于350℃时,NOx转化率随温度升高而增大,其可能原因温度升高、催化剂活性增强均使活化分子百分数增加,单位时间内活化分子有效碰撞次数增加,化学反应速率加快;
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是温度高于450℃时,NH3与O2反应生成NOx的速率大于NOx被NH3还原的速率,使得流出反应管的NOx总量超过流入反应管的NOx总量。
相关试卷
这是一份精品解析:安徽省阜阳市太和中学2024-2025学年高二上学期期中测试 化学试题,文件包含精品解析安徽省阜阳市太和中学2024-2025学年高二上学期期中测试化学试题原卷版docx、精品解析安徽省阜阳市太和中学2024-2025学年高二上学期期中测试化学试题解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
这是一份安徽省阜阳市临泉第一中学2024-2025学年高二上学期开学考试化学试题(解析版),共18页。试卷主要包含了请将答案正确填写在答题卡上, 下列化学用语描述不正确的是, 已知等内容,欢迎下载使用。
这是一份安徽省阜阳市临泉第一中学2024-2025学年高二上学期开学考试化学试题,文件包含高二化学pdf、高二化学答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。








