










科粤版(2024)九年级下册(2024)第八单元 常见的酸、碱、盐8.3 酸和碱反应精品教学ppt课件
展开
这是一份科粤版(2024)九年级下册(2024)第八单元 常见的酸、碱、盐8.3 酸和碱反应精品教学ppt课件,文件包含83酸和碱反应-初中化学九年级下册同步教学课件科粤版2024pptx、83酸和碱反应练习含答案解析docx、83酸和碱反应练习docx等3份课件配套教学资源,其中PPT共45页, 欢迎下载使用。
认识酸和碱的中和反应,会运用指示剂判断反应的发生;学会辨别复分解反应。
能从微观角度了解中和反应的原理,并会正确书写中和反应的化学方程式。
了解中和反应在日常生活和工农业生产中的应用。
01 酸碱指示剂与PH的检验方法
01 pH与溶液酸碱性强弱的关系
为什么要往酸性的土壤里撒熟石灰呢?
从上节学习中,你已经知道酸、碱各自有相似的化学性质,这是什么原因造成的呢?
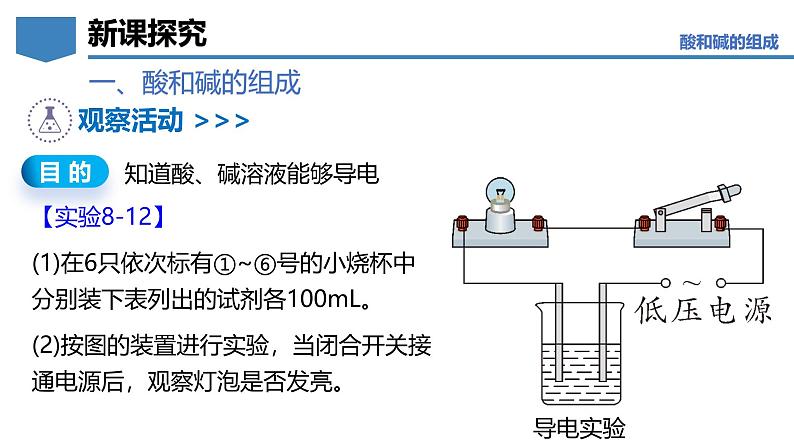
【实验8-12】(1)在6只依次标有①~⑥号的小烧杯中分别装下表列出的试剂各100mL。(2)按图的装置进行实验,当闭合开关接通电源后,观察灯泡是否发亮。
知道酸、碱溶液能够导电
蒸馏水、酒精不导电,酸溶液和碱溶液能够导电。
溶液中存在可自由移动的带电微观粒子
溶液中没有带电的微观粒子
这些带电的微观粒子是什么呢?
酸在水溶液中都能解离出H+。
HCl = H+ + Cl-
H2SO4=2H+ + SO42-
HNO3= H+ + NO3-
【思考】 为什么“酸”具有相似的化学性质呢?
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
KOH = K+ + OH-
碱在水溶液中都能解离出OH-
【思考】 为什么“碱”具有相似的化学性质呢?
思考:如果把酸溶液和碱溶液相混合, 它们之间会发生反应吗?
氢离子 + 氢氧根离子 =
【实验8-13】在烧杯中加入约5mL稀氢氧化钠溶液,用滴管慢慢滴入稀盐酸,观察到什么现象?有没有反应发生?
无明显现象;无法确定是否发生了反应;
思考:为了能观察到上述两种溶液混合后是否发生了 化学反应,应采取什么方法?
在氢氧化钠溶液中加入酸碱指示剂,观察加入稀盐酸后溶液的颜色变化。
实验用品:稀盐酸、稀硫酸、稀氢氧化钠溶液、澄清石灰水、紫色石蕊溶液、无色酚酞溶液。
在烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴无色酚酞溶液
用滴管逐滴滴入稀盐酸,并不断搅拌
在烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴无色酚酞溶液
用滴管逐滴滴入稀盐酸,并不断搅拌
溶液逐渐由红色变为无色
你还能想到哪些实验方案呢?请设计实验(2)(3)和(4)并进行验证。
5mL澄清石灰水+紫色石蕊溶液
5mL稀盐酸+紫色石蕊溶液
有白色沉淀生成,溶液由蓝色变为紫色
H2SO4+Ca(OH)2=CaSO4↓+2H2O
2HCl+Ca(OH)2=CaCl2+2H2O
指示剂颜色的变化说明酸溶液与碱溶液发生了化学反应。
酸和碱作用生成盐和水的反应,叫作中和反应。
同样是酸和碱重要的化学性质之一
酸溶液中的H+和碱溶液中的OH-结合生成 H2O,即
H++ OH- ══ H2O
凡是生成盐和水的反应就是中和反应,这个说法是否正确?
不正确,酸 + 金属氧化物 → 盐 + 水,如:2HCl+CuO==CuCl2+H2O酸 + 碱 → 盐 + 水,如:HCl+NaOH==NaCl+H2O碱 + 非金属氧化物→ 盐 + 水,如:2NaOH+CO2==Na2CO3+H2O
利用手持技术数字化实验寻找酸碱中和反应发生的证据
对于没有明显实验现象的酸碱中和反应,同学们还可以运用手持技术数字化实验,通过pH传感器定量测量反应过程中溶液的pH,通过分析 pH 变化曲线寻找酸和碱发生反应的证据。也可以通过温度传感器定量测量反应过程中温度的变化。
向稀氢氧化钠溶液中逐滴加入稀盐酸过程中 pH 和温度的变化
反应过程中会放出热量,导致溶液温度升高
参加反应的两种化合物互相交换成分生成另外两种化合物。像这种类型的反应,叫作复分解反应。
它是化学反应的四大基本类型之一
①酸+金属氧化物→盐+水 例:Fe2O3 + 6HCl =2FeCl3 + 3H2O②酸+碱→盐+水 例:HCl + NaOH = NaCl +H2O③酸+盐→新盐+新酸 例:H2SO4 + BaCl2 =BaSO4↓ + 2HCl④碱+盐→新盐+新碱 例:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH⑤盐+盐→两种新盐 例:Na2SO4 + BaCl2 =BaSO4↓ + 2NaCl
上述酸和碱的许多反应中都有这样的特点:
1.若用 AB 和 CD 分别表示两种化合物,如何表示复分解反应的通式?
AB + CD → AD + CB
2. 中和反应和复分解反应两者有什么关系?为什么?
中和反应一定是复分解反应,但复分解反应不一定是中和反应,复分解反应包含中和反应。
3.大家已经学习过化合、分解、置换、复分解这四种基本反应类型。你能归纳出它们各自的特点,并准确判断某个具体化学反应属于什么基本反应类型吗?请举例说明。
AB+CD→AD+CB
Zn+2HCl=ZnCl2+H2↑
HCl+NaOH=NaCl+H2O
从多个角度来认识一个化学反应
反应前后的物质种类和数量发生变化
分解反应、化合反应、置换反应、复分解反应等
反应过程中的吸热或放热现象
温度、压力、催化剂等因素对反应的影响
颜色变化、气体产生、沉淀生成等可见现象
能量的变化反应条件反应类型现象
HCl+NaOH =NaCl+H2O
H2SO4+2NaOH =Na2SO4+2H2O
实验8-13、8-14 :
1. 改良酸性或碱性土壤
夏天到农村去,常常看到养鱼的农户向放干的鱼塘底撒熟石灰,这是为了中和鱼塘底泥中过多的有机酸(同时达到杀菌消毒的目的),使放水后的鱼塘水达到适合鱼苗生长的pH。
另外,由于工业生产排放的酸性物质随雨水落下,形成酸雨。酸雨对工业设备、石材建筑和文物古迹的腐蚀十分严重,对农作物等植物的危害也十分明显。我们可以利用熟石灰来中和土壤和某些水源中过多的酸,以减轻酸雨的危害。
如果废水中含有酸性物质(如硫酸、盐酸等),必须先用碱性物质(如烧碱、熟石灰等)将其中和成中性以后才能排放,否则会造成水体污染。
如果你被蚊虫叮咬,皮肤会出现红肿疼痛,这是因为蚊虫向你的皮肤“注射”了蚁酸--甲酸。这时可以涂抹弱碱性的肥皂水、稀氨水或清凉油以减轻疼痛。
有胃病的人常常胃酸(主要成分是盐酸)过多,可以口服碱性胃药(某些胃药的有效成分是氢氧化铝),以中和胃中过多的胃酸。
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
不可以。因为NaOH的碱性太强,具有强的腐蚀性。
部分非金属氧化物能跟水化合生成酸,例如:
煤和石油燃烧后所产生的烟气中,含有二氧化硫和氮氧化物,排放到空气中被云层吸收,并经过化学作用形成酸雾,随同雨水下降便成为显酸性的雨水,若pH小于5.6,称为酸雨。
SO2+H2O=H2SO3
SO3+H2O=H2SO4
④使名胜古迹、建筑物腐蚀损坏等
②使湖水酸化、鱼类死亡
③使农作物生长受到影响而减产
【检测题1】如图所示是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是( )A.反应结束时溶液的pH=7B.反应前后元素的种类没有变化C.氢氧化钠溶液中存在的微粒只有H+和OH-D.该反应的实质是H+和OH-结合生成水分子
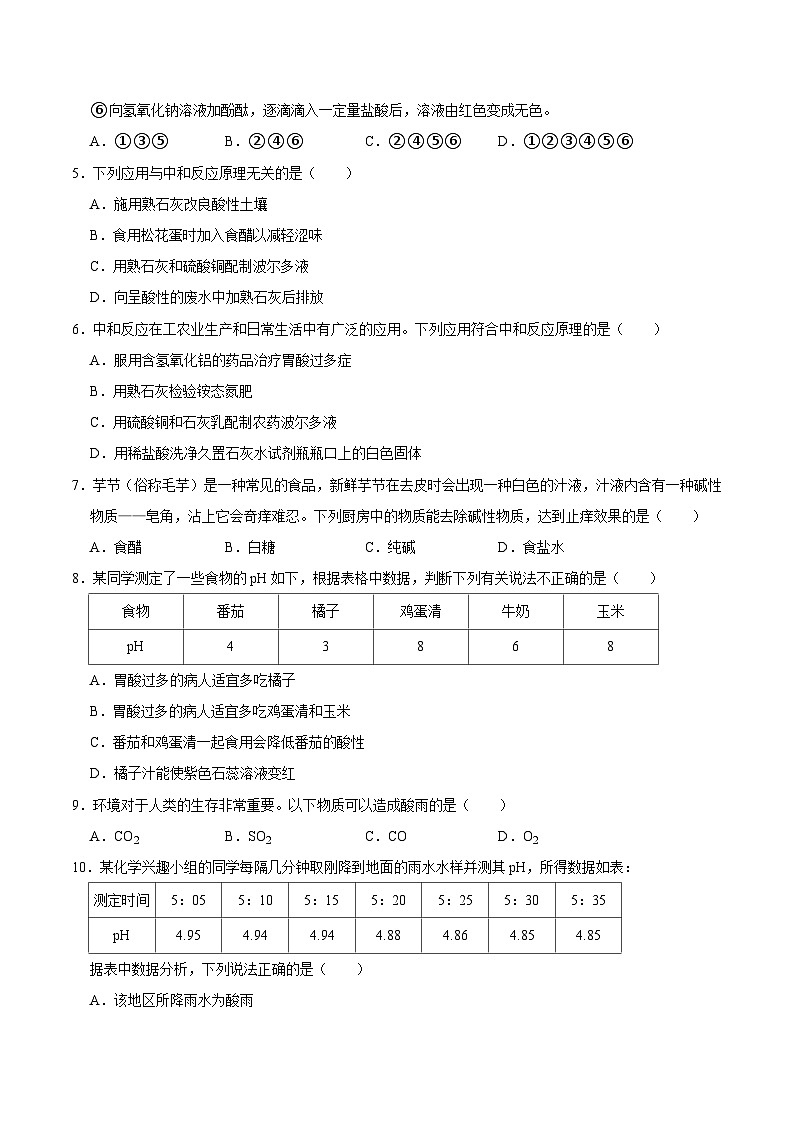
【检测题2】下列关于中和反应的说法错误的是( )A.中和反应一定是复分解反应B.中和反应一定有盐和水生成C.生成盐和水的反应一定是中和反应D.酸碱中和恰好完全反应后溶液的pH=7
【检测题3】下列反应既属于复分解反应又属于中和反应的是( )A.MgO+2HCl═MgCl2+H2OB.H2CO3═CO2↑+H2OC.Ba(OH)2+2HCl═BaCl2+2H2OD.Ba(OH)2+CuSO4═BaSO4↓+Cu(OH)2↓
【检测题4】下列实际应用中不属于中和反应的是( )A.用氢氧化钠溶液洗涤石油产品中的残余硫酸B.用熟石灰改良酸性土壤C.用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒D.用碳酸氢钠治疗胃酸过多
【检测题5】下列反应不属于复分解反应的是( )A.HCl+NaOH═NaCl+H2OB.HCl+AgNO3═AgCl↓+HNO3C.H2SO4+Cu(OH)2═CuSO4+2H2OD.CO2+2KOH═K2CO3+H2O
相关课件
这是一份初中化学沪教版(2024)九年级下册(2024)第3节 中和反应完美版教学课件ppt,文件包含83中和反应-初中化学九年级下册同步教学课件沪教版2024pptx、83中和反应练习含答案解析docx、83中和反应练习docx等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
这是一份初中化学科粤版九年级下册8.3 酸和碱的反应授课课件ppt,共24页。PPT课件主要包含了学习目标,新知学习,溶于水生成,OH-,阳离子都是___离子,阴离子都是酸根离子,阳离子都是金属离子,氢氧根,中和反应,酸碱发生的反应等内容,欢迎下载使用。
这是一份2021学年8.3 酸和碱的反应图文ppt课件,文件包含83酸和碱的反应ppt、83酸和碱的反应教案doc、溶液导电性mp4、酸碱中和mp4等4份课件配套教学资源,其中PPT共23页, 欢迎下载使用。









