




高中化学人教版 (2019)必修 第二册第二节 氮及其化合物背景图ppt课件
展开
这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物背景图ppt课件,共42页。PPT课件主要包含了1不稳定性,实验室应如何保存,棕色瓶阴凉处密封保存,通入一定量的氧气,酸雨的危害等内容,欢迎下载使用。
(1)色 态:无色透明的液体
(2)气 味:刺激性气味
(3)溶解性:能以任意比溶于水
(4)密 度:比水大(1.5g·cm-3)
(5)沸 点:83℃,易挥发
浓硝酸不稳定,见光或受热分解生成的NO2溶解在硝酸中
提问:为什么工业硝酸呈黄色?
有什么办法去除浓硝酸中的黄色吗?
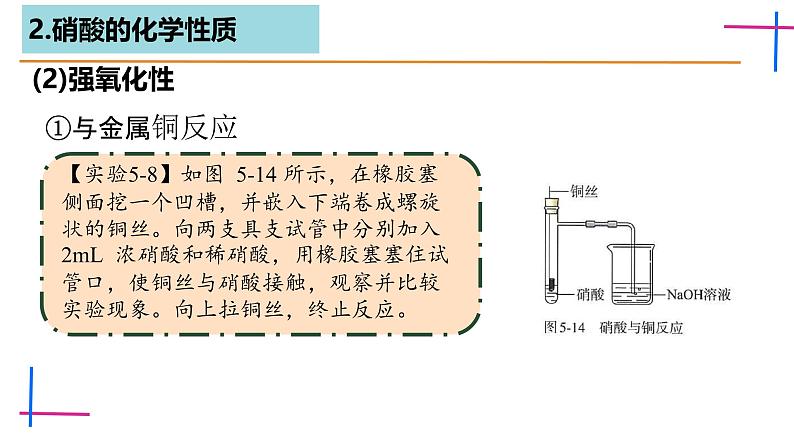
观看硝酸与金属铜反应视频,并描述实验现象。
(2)强氧化性①与金属铜反应
Cu+4HNO₃(浓)=Cu(NO₃)₂+2NO₂↑+2H₂O
HNO₃的作用:氧化剂和酸性
3Cu+8HNO₃(稀)=3Cu(NO₃)₂+2NO↑+4H₂O
硝酸浓度不同,氧化能力不同,还原产物不同
银与浓、稀硝酸也能反应,请你分别写出对应的化学方程式.
Ag+2HNO3(浓)=AgNO3+NO2↑+H2O
3Ag+4HNO3(稀) =3AgNO3+NO↑+2H2O
你发现金属与硝酸反应有何规律?
金属+HNO₃(浓)=硝酸盐+NO2↑+H2O
金属+HNO₃(稀)=硝酸盐+NO↑+H2O
思考1:铁与稀硝酸反应的产物是什么?
思考2:工厂采用铁槽车盛装浓硝酸,请问它们之间会发生反应吗?
思考3:硝酸能够氧化所有的金属吗?
HNO3中+5价N有很强的得电子能力。不论浓、稀HNO3都具有强氧化性,能氧化除Pt和Au以外绝大部分金属。
加热下,浓硝酸与非金属 ( C、S ) 反应
③硝酸还能与 H2S、SO2、Na2SO3、I-、Fe2+ 等还原性物 质反应
(3)强酸性---一元强酸
硝酸具有酸的通性,请举例。
思考:将浓硝酸滴入紫色石蕊溶液,有什么现象?
能与金属、碱性氧化物、碱、某些盐、指示剂反应
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
硝酸,在实验室里它是一种化学试剂,工业上是一种重要的化工原料,可以用于制染料,化肥,农药,硝酸盐等。
纯硝酸是无色、有刺激性气味、易挥发,与水以任意比混溶的液体,比水重,沸点低。
质量分数为69%的硝酸为浓硝酸;
质量分数为98%以上的硝酸为发烟硝酸。
硝酸越浓,越容易分解,分解放出的NO2溶于硝酸而使硝酸呈黄色
总 结:1、硝酸几乎能氧化除金、铂等少数几种金属外的所有金属,通常不产生H2 。
2、有些金属如,Fe、Al与冷、浓硝酸发生钝化现象。故浓硝酸可用Fe、Al罐盛装。
3、王水---浓硝酸、浓盐酸体积比1 :3配成的混合液,可氧化金、铂
讨论:试写出铁与稀硝酸反应的化学方程式
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
浓硝酸能氧化 C、S、P 等非金属
(3)与还原性化合物反应
3SO2 + 2H2O + 2NO3- = 3SO42- + 2NO↑ + 4H+
3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O
注意:NO3-在酸性条件下,就相当于硝酸溶液,具有强氧化性,因此,在强酸性条件下NO3-与Fe2+(I-、Br-、S2-、SO32-等)不能大量共存。
浓硝酸 使Fe、 Al 钝化
Cu+2H2SO4 (浓)===CuSO4+SO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
4HNO3(浓)+C=4NO2↑+CO2↑+2H2O
2H2SO4(浓)+C==2SO2↑+CO2↑+2H2O
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
(1) 写出每一步反应的化学方程式。(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
写出有关化学方程式:N2→NH3: ________________________________。NH3→NO: _______________________________。NO→NO2: _______________________________。NO2→HNO3: _____________________________。
2NO+O2 = 2NO2
3NO2+H2O = 2HNO3+NO
4NH3+5O2 4NO+6H2O
2、取三张蓝色石蕊试纸,放在表面皿上,然后按顺序分别滴加69%的HNO3,98.3%的H2SO4和新制的氯水,三张试纸最后呈现的颜色是( ) A、白、红、白 B、红、黑、红 C、红、红、红 D、白、黑、白
3. 下述实验中均有红棕色气体产生,分析所得结论错误的是 ( )
A. 由①中的红棕色气体,推断产生的气体一定是混合气体B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
4、等质量的铜分别与足量的下列各种酸反应,生成的气体在相同条件下体积最大的是( ) A、浓HNO3 B、稀HNO3 C、浓H2SO4 D、稀H2SO4
方法一:根据方程式计算
5、铜与1ml/L的硝酸反应,如果NO3-浓度下降0.2ml/L。则溶液 中,氢离子的物质的量浓度同时下降( )A、0.2ml/L B、0.4ml/L C、0.6ml/L D、0.8ml/L
3Cu + 8H++2NO3- = 3Cu2+ + 2NO↑+ 4H2O
6、38.4g铜与适量浓硝酸反应,铜完全溶解,共收集到气体标准状况下22.4L。反应中耗硝酸物质的量可能是( ) A 1.0 ml B 1.6 ml C 2.2 ml D 2.4 ml
若38.4 g铜与硝酸恰好完全反应,未被还原的硝酸物质的量为?
7. 铜和镁的合金4.6 g完全溶解于浓硝酸中,若反应中硝酸被还原只产生4.48 L的NO2气体和0.224 L的NO气体(气体体积已折算到标准状况),在反应后的溶液中,加入足量的NaOH溶液,生成沉淀的质量为( )A 9.02 g B 8.51 g C 8.26 g D 7.04 g
解法一:质量守恒和得失电子守恒
m(氢氧化物)=m(金属)+ m(OH-)
n(OH-)=n(金属失电子)
=n(HNO3得电子)
解法二:关系式法(得失电子守恒)
8. 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:(1)NO的体积为_________L,NO2的体积为_________L。(2)待产生的气体全部释放后,向溶液中加入VmLaml/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为____________________(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水_________g。
酸 性:与非还原性的碱、碱性氧化物、盐
酸性和氧化性:与金属、还原性的碱、 碱性氧化物、盐等(难点)
方法:两个守恒----元素守恒、得失电子守恒
这些气体对空气和我们的生活环境能造成什么影响呢?
①定义:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
②成因:二氧化硫、氮氧化物及它们在大气中发生反应后的生成物溶于雨水会形成酸雨。正常雨水因溶解了CO2,其pH约为5.6,而酸雨的pH小于5.6。
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
与水反应生成硝酸和亚硝酸
破坏土壤成分使农作物减产甚至死亡
①消除污染源,改变能源结构,开发利用清洁能源
②研究煤的脱硫、燃烧技术,减少SO2排放
SO2 +CaO=CaSO3
2CaSO3+O2=2CaSO4(生产石膏)
(2)氨水法
③改进汽车尾气的处理技术,控制尾气排放
2NO(g)+2CO(g)====2CO2(g)+N2(g)
④加强工业废气的回收处理
⑤健全法律法规,严格规定污染物的排放标准,提高环境保护意识
相关课件
这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物评课课件ppt,文件包含新教材精创523硝酸酸雨及防治课件2pptx、硝酸与铜的反应演示实验mp4等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物课堂教学课件ppt,共20页。PPT课件主要包含了强氧化性,什么是酸雨呢,酸雨是怎样形成的呢,催化剂,硫酸型酸雨,硝酸型酸雨等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物教课ppt课件,共17页。PPT课件主要包含了物理性质,有刺激性气味,挥发性,化学性质,②使指示剂变色,先变红后褪色微热,2不稳定性,阴暗避光处,3强氧化性,NO2等内容,欢迎下载使用。









