






高中化学人教版 (2019)选择性必修2第一节 原子结构说课课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构说课课件ppt,共33页。PPT课件主要包含了化学核心素养等内容,欢迎下载使用。
1.了解元素、核素和同位素的含义;了解原子序数、核电荷数、质子数、中子数、核外电子数,以及它们之间的关系,培养宏观辨识与微观探析的能力。2.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价层电子的排布式和轨道表达式,体现证据推理与模型认知能力。
(2022·全国乙卷,35)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:(1)氟原子激发态的电子排布式有 ,其中能量较高的是 。(填标号) a.1s22s22p43s1 d.1s22s22p33p2
1.电子自旋与泡利原理(1)电子自旋自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性,电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋相反的电子。(2)泡利原理(泡利不相容原理)在一个原子轨道里,最多只容纳 个电子,它们的自旋 。(在同一原子中不可能有运动状态完全相同的电子存在)
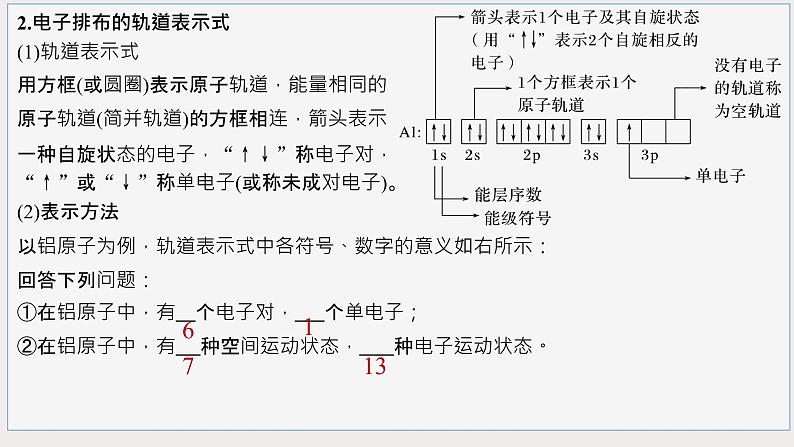
2.电子排布的轨道表示式(1)轨道表示式用方框(或圆圈)表示原子轨道,能量相同的原子轨道(简并轨道)的方框相连,箭头表示一种自旋状态的电子,“↑↓”称电子对,“↑”或“↓”称单电子(或称未成对电子)。(2)表示方法以铝原子为例,轨道表示式中各符号、数字的意义如右所示:回答下列问题:①在铝原子中,有 个电子对, 个单电子;②在铝原子中,有 种空间运动状态, 种电子运动状态。
3.洪特规则(1)内容:基态原子中,填入 的电子总是先单独分占,且自旋平行。(2)特例在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有_____的能量和 的稳定性。如24Cr的电子排布式为 ,为半充满状态,易错写为 ;如29Cu的电子排布式为 ,为全充满状态,易错写为
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
1s22s22p63s23p63d44s2
1s22s22p63s23p63d94s2
3.洪特规则(1)内容:基态原子中,填入 的电子总是先单独分占,且自旋平行。(2)特例在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有____的能量和 的稳定性。如24Cr的电子排布式为 ,为半充满状态,易错写为 。如29Cu的电子排布式为 ,为全充满状态,易错写为 。
4.能量最低原理(1)内容:在构建基态原子时,电子将尽可能地占据 的原子轨道,使整个原子的能量最低。(因为能量越低越稳定)(2)因素:整个原子的能量由 、 和 三个因素共同决定。
(2)互为同素异形体的微粒是___________。
(4)上述9种微粒中有________种核素,含有________种元素。
1.核外电子运动状态核外电子按能量不同分成能层,同一能层的电子,还被分成不同能级。量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
回答下列问题:(1)填写下表,熟悉原子核外能层、能级、原子轨道之间的关系。
K L M N
(2)常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
能量:1s
相关课件
这是一份高中化学沪科技版(2020)必修第一册核外电子排布的规律精品课件ppt,共18页。PPT课件主要包含了学习要点,课堂导入,知识梳理,电子层,由近到远,由低到高,结构示意图,电子式,由1到8,逐渐减小等内容,欢迎下载使用。
这是一份沪科技版(2020)必修第一册核外电子排布的规律完美版ppt课件,文件包含43核外电子排布同步课件pptx、43核外电子排布分层练习原卷版docx、43核外电子排布分层练习解析版docx等3份课件配套教学资源,其中PPT共16页, 欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表优秀课件ppt,共38页。PPT课件主要包含了原子结构,现代原子结构,认识原子结构,核外电子排布,第一层,第二层,第三层等内容,欢迎下载使用。










