

人教版 (2019)选择性必修2第一节 共价键课文配套ppt课件
展开
这是一份人教版 (2019)选择性必修2第一节 共价键课文配套ppt课件,共48页。PPT课件主要包含了共价键的形成与特征,共价键,深度思考,应用体验,课时对点练等内容,欢迎下载使用。
一、共价键的形成与特征
二、共价键类型(按成键原子的原子轨道的重叠方式分类)
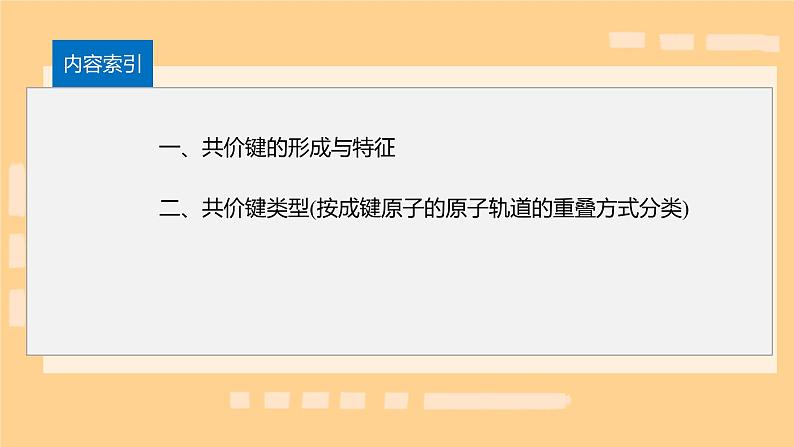
用原子轨道描述氢原子形成氢分子的过程:
形成氢分子的共价键(H—H)
变形结果:电子出现在核间的概率增大
原子核带正电,电子带负电,核间电子好比在核间架起一座“带负电的桥梁”,把带正电的两个原子核“黏结”在一起。
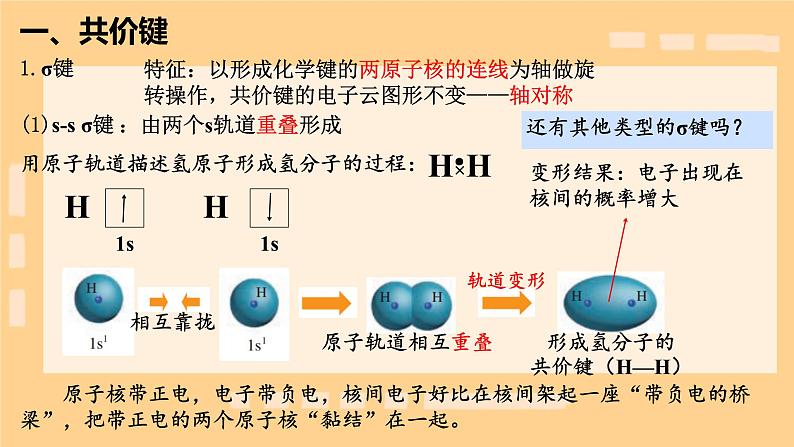
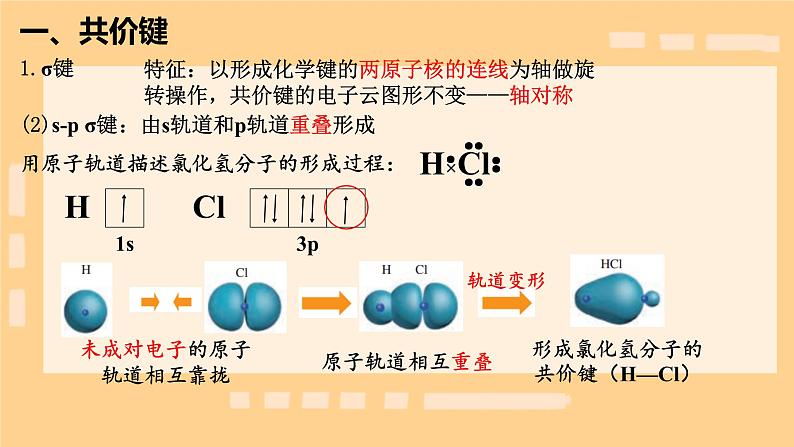
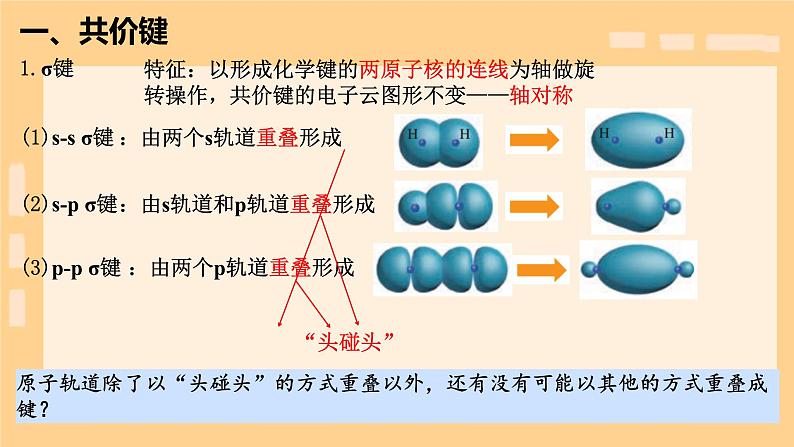
特征:以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云图形不变——轴对称
:由两个s轨道重叠形成
用原子轨道描述氯化氢分子的形成过程:
未成对电子的原子轨道相互靠拢
形成氯化氢分子的共价键(H—Cl)
:由s轨道和p轨道重叠形成
用原子轨道描述氯气分子的形成过程:
形成氯气分子的共价键(Cl—Cl)
:由两个p轨道重叠形成
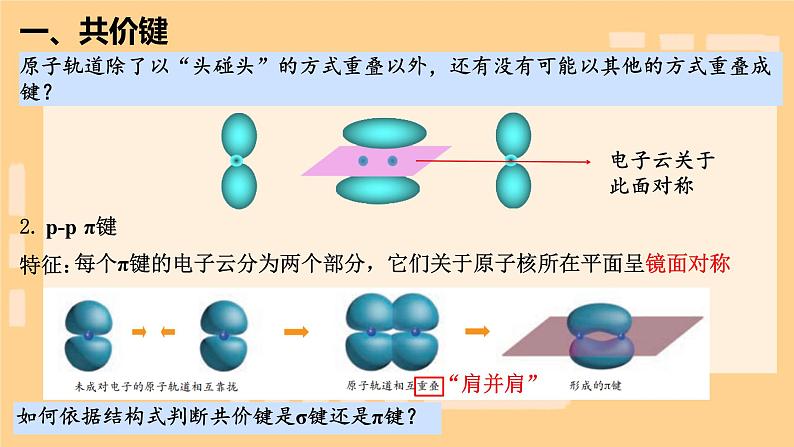
每个π键的电子云分为两个部分,它们关于原子核所在平面呈镜面对称
一般规律:共价单键是σ键;共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键构成。
即:π键必须依附于σ键存在
在乙烯和乙炔分子中,π键不如σ键牢固。但并不是π键都不如σ键牢固,例如氮氮间的π键比σ键牢固。
π键不能单独存在,故断裂的都是π键
两个氮原子相互靠近,电子云相互重叠
一个氮原子的一个p轨道与另一个氮原子的一个p轨道“头碰头”形成一个σ键
一个氮原子的两个p轨道分别与另一个氮原子的两个p轨道“肩并肩”形成两个π键
1.水分子中的共价键是哪些原子形成的?为什么水分子中的三个原子不在一条直线上?
提示 水分子中的共价键是由O原子和H原子形成的单键;共价键的方向性导致水分子中的三个原子不在一条直线上。
2.NH3分子中为什么N原子是1个,而H原子为3个?
3.从原子轨道重叠角度,当两原子相互靠近时,随着核间距减小,电子在两原子核间距出现的机会增大,体系能量逐渐下降达到能量最低状态。氢分子的能量与核间距的关系如图所示,请思考:(1)自旋状态______(填“相同”或“相反”)的未成对电子形成共用电子对。(2)曲线____(填“a”或“b”)所示变化中氢原子靠近到一定程度可能形成氢分子。(3)当氢原子形成氢分子时,氢分子的能量_______(填“最高”或“最低”)。
4.从电负性的角度理解共价键、离子键的形成条件,完成表中内容。结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是______键;而______键是元素的电负性相差不大的原子之间形成的化学键。
1.正误判断(1)共价键的饱和性是由成键原子的未成对电子数决定的(2)共价键的饱和性决定了分子内部原子的数量关系(3)共价键的方向性是由成键原子轨道的方向性决定的
对于共价键的错误认识(1)共价键不仅存在于共价化合物中,也可以存在于离子化合物中,如NaOH、NH4Cl中都含有共价键,还可以存在于非金属单质中,如H2、O3等。(2)非金属元素之间并不是只形成共价键,也可以形成离子键,如NH4NO3只由非金属元素组成,但是含有离子键。(3)活泼的金属元素和非金属元素之间也可以形成共价键,如AlCl3中只有共价键(4)所有共价键都有饱和性,但并不是所有的共价键都有方向性,如s-s σ键就没有方向性。
共价键类型(按成键原子的原子轨道的重叠方式分类)
3.σ键和π键的一般判断规律
键参数——键能、键长与键角
气态分子中1ml化学键解离成气态原子所吸收的能量,通常是298.15K、101kPa条件下的标准值。可以通过实验测定,更多是通过推算获得。
例如:断开CH4中的4个C—H,所需能量并不相等,因此,CH4中的C—H键能只是平均值,而表2-1中的C—H键能是更多分子中的C—H键能的平均值。
键能还可以估算化学反应的热效应(ΔH)
ΔH=反应物化学键键能之和-生成物化学键键能之和
键能可以判断化学键的稳定性,
键能越大,破坏化学键所需能量越多,化学键越稳定。
二、键参数——键能、键长与键角
不存在,因为碳碳单键是σ键,碳碳双键是一个σ键一个π键,碳碳三键是一个σ键两个π键。
氮氮单键、双键和三键的键能关系及原因亦是如此
键长是构成化学键的两个原子(处于震动平衡位置)的核间距。
化学键的键长和键能是相关的,一般来说,键长越小,键能越大。
F原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
原子半径越大,形成的化学键键长越长。
多原子分子中,两个相邻共价键之间的夹角称为键角。
CO2键角为180°,是一种直线形分子;H2O分子中的H—O—H键角是105°,是一种V形(或称角形)分子;NH3分子中的H—N—H键角是107.3°。多原子分子中的键角是一定的,表明共价键具有方向性。
键长和键角的数值可以通过晶体的X射线衍射实验获得
1.画出氮原子的轨道表示式,并说明氮分子中的N≡N是由哪些类型的共价键构成的?
提示 ,在2p能级上有三个未成对电子,分别占据2px、2py、2pz三个原子轨道,当两个氮原子结合成氮分子时,两个氮原子的2px轨道沿x轴方向以“头碰头”的方式发生重叠,形成一个σ键;同时2py-2py和2pz-2pz轨道只能以相互平行的“肩并肩”的方式发生重叠,形成两个π键。
2.观察如图乙烷、乙烯和乙炔分子的结构,并回答下列问题。(1)它们的分子中的共价键分别由几个σ键和几个π键构成?(2)乙烯和乙炔的化学性质为什么比乙烷活泼?(3)在气体单质分子中,一定含有σ键,可能含有π键吗?
提示 乙烷:7个σ键;乙烯:5个σ键和1个π键;乙炔:3个σ键和2个π键。
提示 乙烯的碳碳双键和乙炔的碳碳三键中分别含1个和2个π键,π键原子轨道重叠程度小,不牢固,容易断裂;而乙烷中没有π键,σ键牢固,不易断裂。
提示 稀有气体的单质分子中不含化学键;多原子分子中一定含有σ键,可能含有π键。
1.下列说法对σ键和π键的认识不正确的是A.分子中只要含有共价键,则至少含有一个σ键B.s-s σ键、p-p σ键与s-p σ键都是轴对称的C.p-p σ键和p-p π键的重叠方式是相同的D.含有π键的分子在反应时,π键是化学反应的积极参与者
2.(1)1 ml丙酮( )分子中含有σ键的数目为______________。(2)N2分子中含有_____个σ键和_____个π键。(3)丁烯二酸(HOOCCH==CHCOOH)分子结构中含有_____个σ键和_____个π键。(4)在N2F2分子中,所有原子均满足8电子稳定结构,则该分子中两个N原子间的共价键组成为_____个σ键和_____个π键。
9×6.02×1023
共价单键——σ键共价双键——1个σ键、1个π键共价三键——1个σ键、2个π键
题组一 共价键的形成与特征1.从电负性的角度来判断下列元素的原子之间易形成共价键的是A.K和Cl B.H和FC.K和F D.Ca和O
2.下列分子的结构式与共价键的饱和性不相符的是A.H2O2(过氧化氢):H—O==O—H B.N2H4(肼):C.C2H5SH(乙硫醇): D.SiHCl3(三氯氢硅):
3.下列说法正确的是A.若把H2S写成H3S,则违背了共价键的饱和性B.H3O+的存在说明共价键不应有饱和性C.原子轨道在空间都具有方向性D.两个原子轨道发生重叠后,两核中的电子不仅存在于两核之间,还会绕两核运动
4.下列说法正确的是A.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性B.某原子跟其他原子形成共价键时,其共价键数目一定等于该元素原子的价电子数C.基态C原子有两个未成对电子,所以最多只能形成2个共价键D.1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
题组二 共价键的类型及判断5.下列有关σ键和π键的说法错误的是A.H只能形成σ键,O可以形成σ键和π键B.两个原子间可以只形成σ键,但不能只形成π键C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键D.在分子中,化学键可能只有π键而没有σ键
6.π键上的π电子在吸收紫外光后会被激发,从而可以阻挡紫外光。下列物质可能成为防晒霜的有效成分的是A.甘油 B.过氧化氢C.重水 D.对氨基苯甲酸
7.下列关于σ键和π键的理解不正确的是A.σ键可以绕键轴旋转,π键不能绕键轴旋转B.H2分子中的σ键是s-s σ键,HClO分子中的σ键都是p-p σ键C.C2H4分子和N2H4分子中都含有5个σ键D.σ键以“头碰头”方式重叠,π键以“肩并肩”方式重叠
8.下列物质的分子中既有σ键又有π键,并含有非极性键的是①NH3 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2A.②⑤⑥ B.①②⑤⑥C.②③④ D.②④⑥
10.(2023·辽宁营口高二期末)NA代表阿伏加德罗常数的值,下列说法正确的是A.标况下,22.4 L HF中含有的极性键数目为NAB.常温下,1 L pH=2的甲酸溶液中,含有氢离子数为0.01NAC.密闭容器中,1 ml N2和3 ml H2催化反应后分子总数为2NAD.1 ml甲醛(HCHO)中所含σ键总数为4NA
11. N2的结构可以表示为 ,CO的结构可以表示为 ,其中椭圆框表示π键,·表示对应原子提供的电子。下列说法错误的是A.N2分子与CO分子中都含σ键和π键B.N2分子与CO分子中的π键不完全相同C.电负性:C
相关课件
这是一份高中第二章 分子结构与性质第一节 共价键集体备课课件ppt,共37页。PPT课件主要包含了共价键的特点,饱和性,方向性,头碰头p-pσ键,肩并肩p-pΠ键,个σ键2个Π键,特点镜面对称,对比研究等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键集体备课课件ppt,共46页。PPT课件主要包含了化学键,第三章再介绍,共价键,成键元素,一般为非金属与非金属,共价键类型,1σ键的形成,共价键的方向性,轴对称,④σ键的特征等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修2第1节 共价键模型课文配套课件ppt,共18页。PPT课件主要包含了共价键的本质,共价键的本质是,共价键的形成,氢分子的形成过程,共价键的特征,饱和性,方向性,共价键的类型,相互靠拢,原子轨道相互重叠等内容,欢迎下载使用。










