






第8讲 化学计算的常用方法 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件
展开
这是一份第8讲 化学计算的常用方法 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共47页。PPT课件主要包含了复习目标,利用差量法计算,考点一,必备知识,专项突破,利用关系式法计算,考点二,利用守恒法计算,考点三,热点强化等内容,欢迎下载使用。
1.进一步理解物质的量在化学计算中的“桥梁”作用。2.了解化学计算的常用方法。3.初步建立化学计算的思维模型。
1.所谓“差量”就是指反应过程中反应物的某种物理量之和(始态量)与同一状态下生成物的相同物理量之和(终态量)的差,这种物理量可以是质量、物质的量、气体体积、气体压强、反应过程中的热效应等。根据化学方程式求出理论上的差值(理论差量),结合题中的条件求出或表示出实际的差值(实际差量),根据比例关系建立方程式并求出结果。2.差量法的解题关键是找准研究对象。通常有:①固体的质量差,研究对象是固体。②气体的质量差,研究对象是气体。③液体的质量差,研究对象是液体。
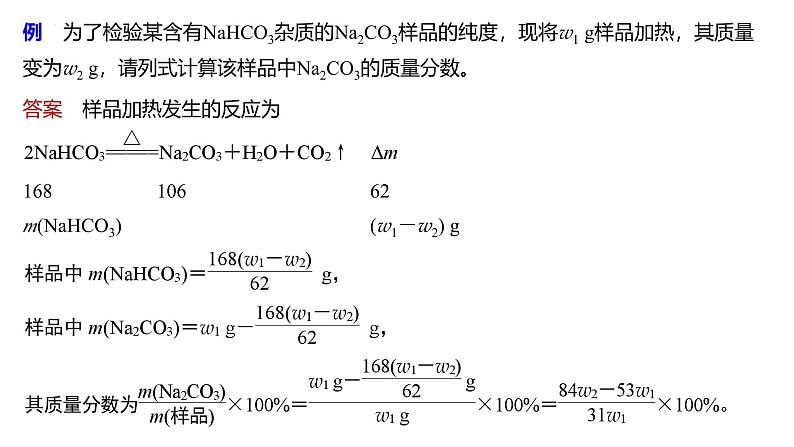
例 为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,请列式计算该样品中Na2CO3的质量分数。
答案 样品加热发生的反应为
168 106 62m(NaHCO3) (w1-w2) g
1.标准状况下,将20 L CO2和CO的混合气体全部通过足量的Na2O2粉末,在相同状况下,气体体积减少到16 L,则原混合气体中CO的体积为A.4 L B.8 L C.12 L D.16 L
混合气体中只有CO2和Na2O2反应,设二氧化碳的体积为V(CO2),2CO2+2Na2O2===2Na2CO3+O2 ΔV44.8 L 22.4 LV(CO2) (20-16) L44.8 L∶22.4 L=V(CO2)∶(20-16) L,解得V(CO2)=8 L,则V(CO)=(20-8) L=12 L。
2.16 mL由NO与NH3组成的混合气体在催化剂作用下于400 ℃左右可发生反应:6NO+4NH3 5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5 mL,计算原混合气体中NO与NH3的物质的量之比。
6NO + 4NH3 5N2+6H2O(g) ΔV6 4 5 6 1V(NO) V(NH3) 1.5 mL
由此可知共消耗15 mL气体,还剩余1 mL气体,假设剩余的气体全部是NO,则V(NO)∶V(NH3)=(9 mL+1 mL)∶6 mL=5∶3,假设剩余的气体全部是NH3,则V(NO)∶V(NH3)=9 mL∶(6 mL+1 mL)=9∶7,但因该反应是可逆反应,剩余气体实际上是NO、NH3的混合气体,故 。
1.关系式法是一种巧妙利用已知量与未知量之间的关系进行解题的一种方法,一般适用于多步进行的连续反应,因前一个反应的产物是后一个反应的反应物,可以根据中间物质的传递关系,找出原料和最终产物的相应关系式。2.应用关系式法的思维模型
一、关系式法的基本应用1.200吨含硫40%的黄铁矿,用接触法可以制得95%的硫酸(不考虑中间过程的损耗)的质量为多少吨?
根据反应前后硫原子数不变,可得关系式:2S~FeS2~2H2SO4即:S ~ H2SO432 98200 t×40% 95%·x32∶98=(200 t×40%)∶(95%·x)x≈257.9 t。
2.由NH3氧化制NO的转化率为96%,NO转化为HNO3的转化率为92%,现有10 t NH3,总共可以制得63%的HNO3多少吨?
3.用黄铁矿可以制取H2SO4,再用H2SO4可以制取化肥(NH4)2SO4。煅烧含FeS2 80.2% 的黄铁矿75.0 t,最终生产出79.2 t (NH4)2SO4。已知 NH3 的利用率为92.6%,H2SO4的利用率为89.8%,试求黄铁矿制取H2SO4时的损失率为________。
设黄铁矿的利用率为x,FeS2 ~2H2SO4 ~ 2(NH4)2SO4120 26475.0 t×80.2%×89.8%·x 79.2 t可得x≈66.6%,则黄铁矿的损失率为1.00-66.6%=33.4%。
二、关系式法在滴定计算中的应用4.硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·ml-1)可用作定影剂、还原剂。回答下列问题:利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在_______中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至__________________________。
溶液的凹液面与刻度线相切
配制一定物质的量浓度的溶液,应该在烧杯中溶解,冷却至室温后,转移至100 mL的容量瓶中,加水至距刻度线1~2 cm处,改用胶头滴管滴加至溶液的凹液面与刻度线相切。
(2)滴定:取0.009 50 ml·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: +6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定,发生反应:I2+ === +2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液________________________________________,即为滴定终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(结果保留1位小数)。
蓝色褪去,且半分钟内不恢复成原来的颜色
加入淀粉作指示剂,淀粉遇I2变蓝色,加入的Na2S2O3样品与I2反应,当I2消耗完后,溶液蓝色褪去,且半分钟内不恢复成原来的颜色,即为滴定终点。
1 60.009 50 ml·L-1 0.009 50 ml·L-1×0.02 L ×0.02 L×6
5.金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为Sn+2HCl===SnCl2+H2↑,再加入过量的FeCl3溶液,发生如下反应:SnCl2+2FeCl3===SnCl4+2FeCl2,最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+,反应的化学方程式为6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O。现有金属锡试样0.613 g,经上述反应后,共用去0.100 ml·L-1 K2Cr2O7溶液16.0 mL。求试样中锡的百分含量(假定杂质不参加反应,锡的相对原子质量为119)。
Sn与K2Cr2O7物质的量的关系:3Sn~3SnCl2~6FeCl2~K2Cr2O73×119 g 1 mlx 0.100×0.016 ml
6.称取2.0 g制得的K2FeO4样品溶于适量KOH溶液中,加入足量KCrO2溶液,充分反应后过滤,将滤液转移到250 mL容量瓶定容。取25.00 mL定容后的溶液于锥形瓶,加入稀硫酸酸化,滴加几滴二苯胺磺酸钠作指示剂,用0.10 ml·L-1(NH4)2Fe(SO4)2标准溶液滴定,终点由紫色变为绿色,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为26.00 mL。发生的反应有:
则标准溶液应选用________(填“酸式”或“碱式”)滴定管盛放,该K2FeO4样品的纯度为________%。
1 ml 3 mln 0.10 ml·L-1×0.026 L
守恒法是一种整合的思维方法,运用守恒定律,不纠缠过程细节,只考虑反应体系中研究对象化学量的始态和终态(如反应中的原子守恒、得失电子守恒、电荷守恒、化合价升降守恒、能量守恒等)或相互间的关系(如化合物中的化合价规则、电解质溶液中的电中性原则等),从而达到速解、巧解化学试题的目的。1.质量守恒(原子守恒)依据化学反应的实质是原子的重新组合,反应前后各原子的种类和数目保持不变。
例1 28 g铁粉溶于稀盐酸中,然后加入足量的Na2O2固体,充分反应后过滤,将滤渣加强热,列式计算最终得到的固体质量。
答案 经过一系列反应后,最终得到的固体为Fe2O3,根据铁原子守恒:
例2 C(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290 ℃时已完全脱水。计算并分析A、B、C点物质的化学式。
答案 C(OH)2在加热分解过程中,C原子的数目不变。设有1 ml C(OH)2,质量为93 g。则固体中C的物质的量为1 ml,质量为59 g。设290 ℃后固体的化学式为COx,A点固体的相对分子质量为93×89.25%≈83,此时x=1.5,即该固体为C2O3;
C点固体的相对分子质量为93×80.65%≈75,此时x=1,即该固体为CO。
2.电荷守恒在离子方程式中,反应前后的阴、阳离子所带的电荷总数相等。例3 将a g Fe2O3、Al2O3样品溶解在过量的200 mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液,使Fe3+ 、Al3+刚好沉淀完全,用去NaOH溶液100 mL,则NaOH溶液的浓度为_____________。
(1)电子守恒法计算的原理氧化剂得电子总数=还原剂失电子总数。(2)电子守恒法计算的流程①找出氧化剂、还原剂及相应的还原产物和氧化产物。②找准一个原子或离子得失电子数(注意化学式中粒子的个数)。③根据题中物质的物质的量和得失电子守恒列出等式。n(氧化剂)×变价原子个数×化合价变化值(高价-低价)=n(还原剂)×变价原子个数×化合价变化值(高价-低价)。
题组一 确定元素价态或物质组成1.现有24 mL浓度为0.05 ml·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 ml·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为______。
题目中指出被还原的元素是Cr,则得电子的物质是K2Cr2O7,失电子的物质是Na2SO3,其中S元素的化合价从+4→+6,Cr元素的化合价将从+6→+n。根据氧化还原反应中得失电子守恒规律,有0.05 ml·L-1×0.024 L×(6-4)=0.02 ml·L-1×0.020 L×2×(6-n),解得n=3。
2.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为______。
题组二 电子守恒在未配平方程式中的应用3.在P+CuSO4+H2O―→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 ml CuSO4可氧化P的物质的量为________ml。生成1 ml Cu3P时,参加反应的P的物质的量为________ml。
设7.5 ml CuSO4氧化P的物质的量为x;生成1 ml Cu3P时,被氧化的P的物质的量为y,根据得失电子守恒得:7.5 ml×(2-1)=x×(5-0),x=1.5 ml;1 ml×3×(2-1)+1 ml×[0-(-3)]=y×(5-0),y=1.2 ml,所以参加反应的P的物质的量为1.2 ml+1 ml=2.2 ml。
题组三 多步反应得失电子守恒问题4.取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL的N2O4气体(均已折算为标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为17.02 g。则x等于________。
x g=17.02 g-m(OH-),而OH-的物质的量等于镁、铜失去电子的物质的量,等于浓HNO3得电子的物质的量,即:
5.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 ml·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是________mL。
题组四 氧化还原滴定中的计算
+6Fe2++14H+===2Cr3++6Fe3++7H2O,5Fe2++ +8H+===5Fe3++Mn2++4H2O。利用得失电子守恒列等式:c1 ml·L-1×V1 mL×10-3 L ·mL-1=20 mL×10-3 L·mL-1×6c( )+5c2 ml·L-1×V2 mL×10-3 L·mL-1,解得:c( )= ml·L-1。
化学计算方法在热重分析中的应用
(1)设晶体为1 ml。(2)失重一般是先失水,再失非金属氧化物。(3)计算每步的m(剩余), ×100%=固体残留率。(4)晶体中金属质量不减少,仍在m(剩余)中。(5)失重最后一般为金属氧化物,由质量守恒得m(O),由n(金属)∶n(O),即可求出失重后物质的化学式。
1.将8.34 g FeSO4·7H2O样品隔绝空气加热,升温过程中固体的质量变化如图。下列说法正确的是A.FeSO4·7H2O晶体中有4种不同结合力的 水分子B.在100 ℃时,M的化学式为FeSO4·6H2OC.在200 ℃时,N的化学式为FeSO4·3H2OD.380 ℃的P加热至650 ℃的化学方程式为 2FeSO4 Fe2O3+SO2↑+SO3↑
从图中可以看出,FeSO4·7H2O晶体受热后发生4次分解反应,通常情况下,晶体先分多次失去结晶水,然后所得无水盐再分解。FeSO4·7H2O晶体中,水分子的结合力都是相同的,A不正确;
当固体残留率为70.3%时,所得固体可能为______(填字母)。A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4
404×70.3%≈284,A的相对分子质量为332,B的相对分子质量为568,C的相对分子质量为252;根据质量守恒,404×2×70.3%≈568。
3.[2019·全国卷Ⅰ,27(5)]采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为___________________。
NH4Fe(SO4)2·12H2O
4.PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值。
5.在空气中加热10.98 g草酸钴晶体(CC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
(1)加热到210 ℃时,固体物质的化学式为_________。
n(CC2O4·2H2O)=0.06 ml,Δm=(10.98-8.82) g=2.16 g=m(H2O),故210 ℃时固体为CC2O4。
相关课件
这是一份第47讲 化学平衡常数的计算 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共45页。PPT课件主要包含了复习目标,考点一,压强平衡常数Kp,考点二,考点三等内容,欢迎下载使用。
这是一份第38讲 反应热的测定与计算 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共41页。PPT课件主要包含了复习目标,中和反应反应热的测定,考点一,必备知识,易错辨析,专项突破,盖斯定律及其应用,考点二,反应热大小的比较,考点三等内容,欢迎下载使用。
这是一份第34讲 晶胞结构分析与计算 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共54页。PPT课件主要包含了复习目标,晶胞模型与均摊法计算,考点一,必备知识,专项突破,晶胞参数计算,考点二,投影图等内容,欢迎下载使用。









