



第11讲 纯碱的制备与含量的测定 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件
展开
这是一份第11讲 纯碱的制备与含量的测定 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共30页。PPT课件主要包含了复习目标,侯氏制碱法,考点一,制备原料,工艺流程,必备知识,CO2,NaCl,NH3,专项突破等内容,欢迎下载使用。
1.了解侯氏制碱法的原理。2.掌握Na2CO3含量的测定方法。
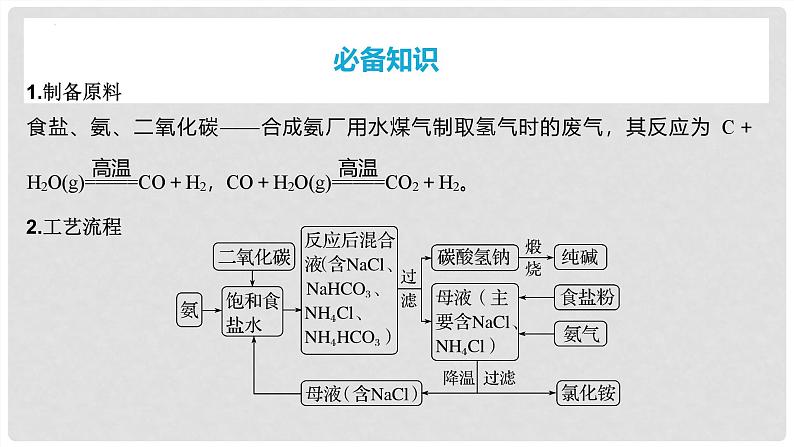
3.反应原理(1)产生NaHCO3的反应: 。(2)产生Na2CO3的反应: 。4.绿色思想循环使用的物质为 、 。
NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl
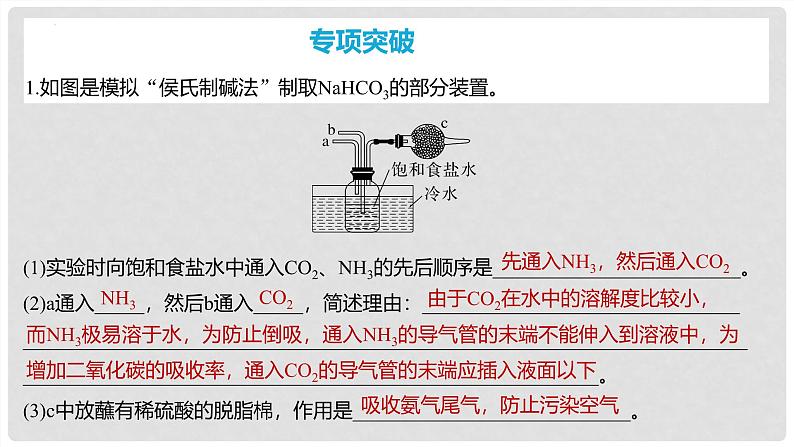
1.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。
(1)实验时向饱和食盐水中通入CO2、NH3的先后顺序是_________________________。(2)a通入_____,然后b通入_____,简述理由:___________________________________________________________________________________________________________________________________________________________________。(3)c中放蘸有稀硫酸的脱脂棉,作用是____________________________。
先通入NH3,然后通入CO2
由于CO2在水中的溶解度比较小,
而NH3极易溶于水,为防止倒吸,通入NH3的导气管的末端不能伸入到溶液中,为增加二氧化碳的吸收率,通入CO2的导气管的末端应插入液面以下
吸收氨气尾气,防止污染空气
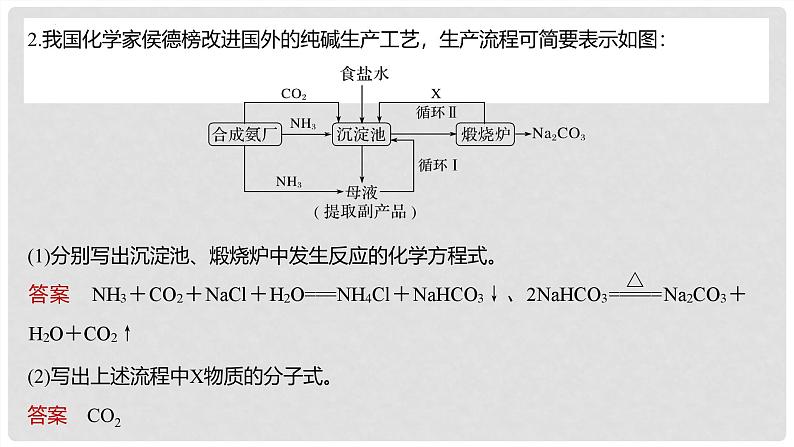
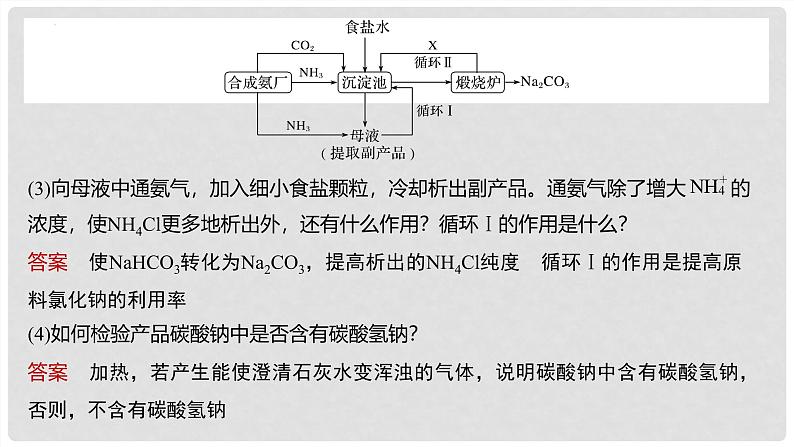
2.我国化学家侯德榜改进国外的纯碱生产工艺,生产流程可简要表示如图:
(1)分别写出沉淀池、煅烧炉中发生反应的化学方程式。
(2)写出上述流程中X物质的分子式。
(3)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气除了增大 的浓度,使NH4Cl更多地析出外,还有什么作用?循环Ⅰ的作用是什么?
答案 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 循环Ⅰ的作用是提高原料氯化钠的利用率
(4)如何检验产品碳酸钠中是否含有碳酸氢钠?
答案 加热,若产生能使澄清石灰水变浑浊的气体,说明碳酸钠中含有碳酸氢钠,否则,不含有碳酸氢钠
Na2CO3含量的测定方法
1.气体法(1)测定原理:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑。依据CO2的体积确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的含量。(2)实验操作:向m g纯碱样品中加入足量的稀硫酸,准确测量产生的CO2气体的体积为V mL(已折算为标准状况)。
2.沉淀法(1)测定原理:Na2CO3+BaCl2===BaCO3↓+2NaCl。依据BaCO3沉淀的质量确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的含量。(2)实验操作:先将m g纯碱样品溶于水配成溶液,向溶液中加入过量的BaCl2溶液,经过滤、洗涤、干燥得BaCO3沉淀的质量为n g。
3.滴定法测定原理(用酚酞作指示剂,用盐酸滴定):当指示剂变色时,发生的反应为Na2CO3+2HCl===2NaCl+H2O+CO2↑,根据消耗标准盐酸的体积,求出Na2CO3的物质的量,进一步求其含量。
实验室欲测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0 g,溶于水中,配成250 mL溶液。方案一:沉淀法。利用化学反应把 完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w(Na2CO3)。(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中 完全转化为沉淀,应选用的试剂是_____(填字母)。A.CaCl2溶液 B.MgSO4溶液C.NaCl溶液 D.Ba(OH)2溶液
Ba(OH)2溶液与两种离子都可以形成沉淀,D正确。
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法是_____________________________________________________________________________________。
取少量最后一次洗涤液于试管中,
滴加Na2SO4溶液,如无沉淀,则沉淀已洗净,反之则未洗净
判断沉淀是否洗净的方法是检验洗涤液中是否含有Ba2+。
(3)将所得沉淀充分干燥,称量沉淀的质量为m g,由此可以计算w(Na2CO3)。如果此步中,沉淀未充分干燥就称量,则测得w(Na2CO3)_______(填“偏大”“偏小”或“无影响”)。
所得沉淀未充分干燥就称量,则产生的沉淀质量偏大。由于等质量时NaHCO3产生的沉淀质量大,因此测得w(Na2CO3)偏小。
方案二:气体法。某同学用下列实验流程测定。
按如图所示装置进行实验:
(1)在装置C中装碱石灰来吸收净化后的气体,装置D的作用是______________________________________________。(2)有的同学认为,为了减小实验误差,应在反应前后都通入N2,反应后通入N2的目的是_______________________________________。
和二氧化碳,减小实验误差
将装置A、B中残留的CO2全部赶入装置C中
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞溶液,摇匀,用0.200 0 ml·L-1盐酸滴定到终点(已知终点时反应H++ === 恰好反应完全)。重复此操作2次,消耗盐酸的平均体积为20.00 mL。(1)量取25.00 mL配制好的溶液,应选择_____________________仪器来完成。
碱式滴定管(或移液管)
Na2CO3、NaHCO3的溶液显碱性,应选择碱式滴定管或移液管。
(2)判断滴定终点的依据是__________________________________________________________________。
滴入最后半滴盐酸时,溶液由红色变为浅红(接近无色),
加酚酞溶液显红色,恰好反应时溶液为NaHCO3。
(3)此法测得w(Na2CO3)=________。
1.[2021·河北,14(1)(2)(3)(4)]化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
回答下列问题:(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是_________(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或____________________________________。
将玻璃塞上的凹槽对准漏斗颈部的小孔
要制备NaHCO3,需先选用装置A制备二氧化碳,然后通入饱和碳酸氢钠溶液中除去二氧化碳中的HCl,后与饱和氨盐水充分接触来制备NaHCO3,其中过量的二氧化碳可被氢氧化钠溶液吸收,所以按气流方向正确的连接顺序应为aefbcgh;为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或将玻璃塞上的凹槽对准漏斗颈部的小孔。
(2)B中使用雾化装置的优点是________________________________________________________________________。(3)生成NaHCO3的总反应的化学方程式为_______________________________________________。
使氨盐水雾化,可增大与二氧化碳的接触面积,从而
提高产率(或其他合理答案)
NH3·H2O+NaCl+CO2===NH4Cl+
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.14 g,则固体NaHCO3的质量为______g。
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)―→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为__________、______、洗涤、干燥。
根据溶解度随温度的变化曲线可以看出,氯化铵的溶解度随着温度的升高而不断增大,而氯化钠的溶解度随着温度的升高变化并不明显,所以要想使NH4Cl沉淀充分析出并分离,需采用的操作为冷却结晶、过滤、洗涤、干燥。
2.(2021·湖南,15)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:步骤Ⅰ.Na2CO3的制备步骤Ⅱ.产品中NaHCO3含量测定①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;②移取25.00 mL上述溶液于锥形瓶中,加入2滴指示剂M,用0.100 0 ml·L-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1 mL;
③在题述锥形瓶中再加入2滴指示剂N,继续用0.100 0 ml·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2 mL;
④平行测定三次,V1平均值为22.45,V2平均值为23.51。已知:(i)当温度超过35 ℃时,NH4HCO3开始分解。(ii)相关盐在不同温度下的溶解度表(g/100 g H2O)
回答下列问题:(1)步骤Ⅰ中晶体A的化学式为__________,晶体A能够析出的原因是_________________________________________________。
NaHCO3的溶解度最小(答案合理即可)
(2)步骤Ⅰ中“300 ℃加热”所选用的仪器是_____(填标号)。
(3)指示剂N为_________,描述第二滴定终点前后颜色变化:__________________________________。
由题给信息分析可知,第二次滴定时,使用的指示剂N为甲基橙,滴定达到终点前溶液的溶质为碳酸氢钠和氯化钠,滴定达到终点后溶液的溶质为氯化钠,所以溶液的颜色变化为由黄色变为橙色,且半分钟内不变色。
(4)产品中NaHCO3的质量分数为________(保留三位有效数字)。
第一滴定发生的反应是Na2CO3+HCl===NaHCO3+NaCl,则n(Na2CO3)=n生成(NaHCO3)=n(HCl)=0.100 0 ml·L-1×22.45×10-3 L=2.245×10-3 ml,第二滴定消耗的盐酸的体积为23.51 mL,则根据化学方程式:NaHCO3+HCl=== NaCl+H2O+CO2↑可知,消耗的NaHCO3的物质的量n总(NaHCO3)=0.100 0 ml·L-1×23.51×10-3 L=2.351×10-3 ml,则原溶液中的NaHCO3的物质的量n(NaHCO3)=n总(NaHCO3)-n生成(NaHCO3)=2.351×10-3 ml-2.245×10-3 ml=1.06×10-4 ml,则原产品中NaHCO3的物质的量为 ×1.06×10-4 ml=1.06×10-3 ml,故产品中NaHCO3的质量分数为×100%≈3.56%。
相关课件
这是一份第74讲 以物质含量或组成测定为主的综合实验-2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共49页。PPT课件主要包含了复习目标,物质含量的测定,考点一,必备知识,专项突破,物质组成的测定,考点二,真题演练等内容,欢迎下载使用。
这是一份第64讲 卤代烃 醇 酚-2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共60页。PPT课件主要包含了复习目标,卤代烃,考点一,必备知识,易错辨析,专项突破,乙醇及醇类,考点二,苯酚及酚类,考点三等内容,欢迎下载使用。
这是一份第38讲 反应热的测定与计算 2024高考化学一轮复习高频考点精讲(新教材新高考) 课件,共41页。PPT课件主要包含了复习目标,中和反应反应热的测定,考点一,必备知识,易错辨析,专项突破,盖斯定律及其应用,考点二,反应热大小的比较,考点三等内容,欢迎下载使用。









