






第68讲 创新探究类综合实验 (讲义+课件 2份打包)2025年高考化学总复习
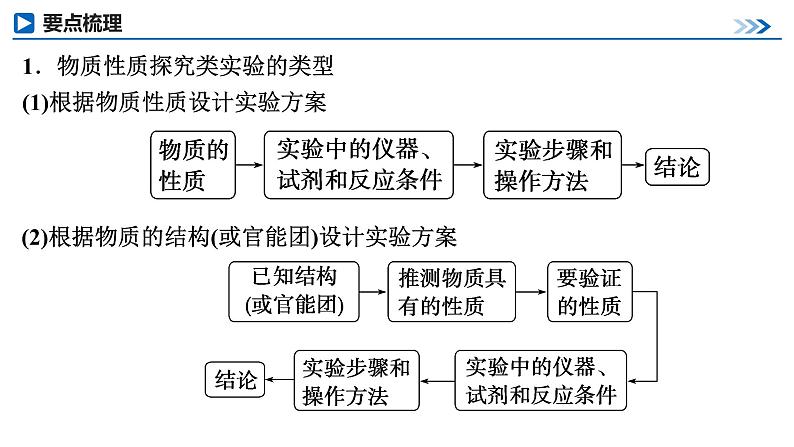
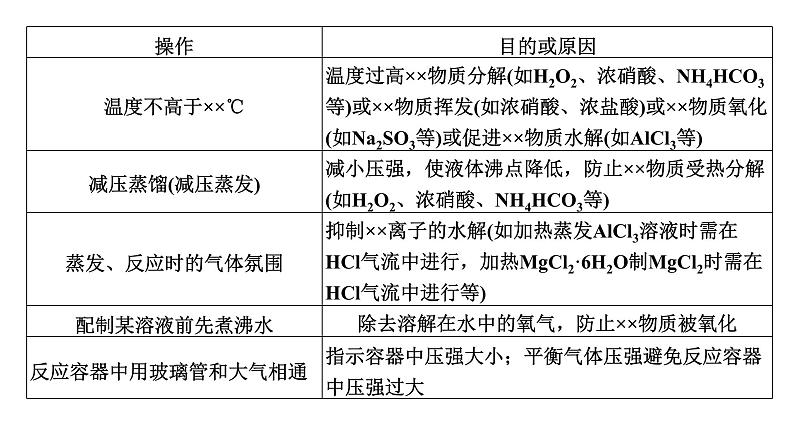
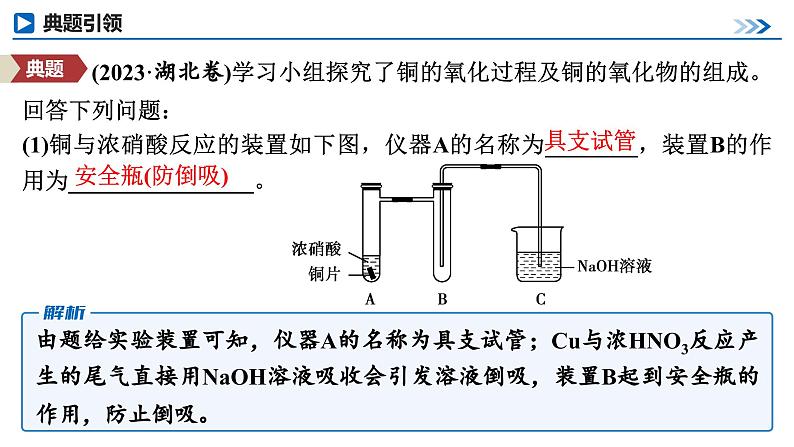
展开第68讲 创新探究类综合实验第十章 化学实验基础课程标准1.能根据不同情景、不同类型实验特点评价或设计解决问题的简单方案。2.建立解答探究类综合实验的思维模型。类型一 物质性质的探究类型二 反应产物、反应机理的探究课时测评物质性质的探究类型一1.物质性质探究类实验的类型(1)根据物质性质设计实验方案(2)根据物质的结构(或官能团)设计实验方案2.探究实验中常见操作及原因 (2023·湖北卷)学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:(1)铜与浓硝酸反应的装置如下图,仪器A的名称为________,装置B的作用为________________。具支试管安全瓶(防倒吸) 由题给实验装置可知,仪器A的名称为具支试管;Cu与浓HNO3反应产生的尾气直接用NaOH溶液吸收会引发溶液倒吸,装置B起到安全瓶的作用,防止倒吸。(2)铜与过量H2O2反应的探究如下:实验②中Cu溶解的离子方程式为__________________________________;产生的气体为_____。比较实验①和②,从氧化还原角度说明H+的作用是__________________。Cu+ H2O2 +2H+===Cu2++2H2OO2增强H2O2的氧化性Cu在稀H2SO4作用下,被H2O2氧化生成Cu2+和H2O,溶液变蓝。Cu2+作用下,H2O2会被催化分解生成O2。在Na2SO4溶液中H2O2不能氧化Cu,在稀H2SO4中H2O2能氧化Cu,说明H+使得H2O2的氧化性增强。(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y, 。X的化学式为________。CuO2X为铜的氧化物,设X的化学式为CuOx,其在惰性氛围下分解生成黑色氧化物(CuO),则:CuOx CuO+ O2↑64+16x 80m n(4)取含X粗品0.050 0 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液15.00 mL。(已知:2Cu2++4I-===2CuI↓+I2,I2+2S2O ===2I-+S4O )标志滴定终点的现象是_________________________________________________________________________,粗品中X的相对含量为________。滴入最后半滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不变色96.0%CuO2在酸性条件下生成Cu2+,Cu2+与KI反应生成I2,I2遇淀粉变蓝,用Na2S2O3标准溶液滴定I2,当滴入最后半滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不变色时,表明I2已完全反应,达到滴定终点。CuO2中Cu为+2价、O为-1价,结合已知反应可知,CuO2在酸性条件下与KI发生反应2CuO2+ 8I-+8H+===2CuI)+3I2 +4H2O,则2CuO2 ~3I2~6Na2S2O3,则样品中m(CuO2)=1.某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证Fe3+、Cl2、SO2氧化性的强弱。根据题目要求回答下列问题:(1)检查装置气密性后,关闭K1、K3、K4,打开K2,旋开旋塞a,加热A,则B中发生反应的离子方程式为_______________________________。Cl2+2Fe2+===2Fe3++2Cl-(2)B中溶液变黄时,停止加热A,关闭K2。打开旋塞b,使约2 mL的溶液流入试管D中,关闭旋塞b,检验B中生成离子的方法是_________________________________________________。向试管D中滴加KSCN溶液,试管D中溶液变红色(3)若要继续证明Fe3+和SO2氧化性的强弱,需要进行的操作是______________________________________________________________________________________________________________________________________。打开K3,打开旋塞c,向C中加入70%硫酸,一段时间后关闭K3。更换试管D,打开旋塞b,使少量溶液流入D中,检验D溶液中的SO 和Fe2+(4)甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序:Cl2>Fe3+>SO2的是________(填“甲”“乙”或“丙”)。甲、丙(5)验证结束后,将D换成盛有NaOH溶液的烧杯,打开K1、K2、K3和K4,关闭旋塞a、c,打开旋塞b,从两端鼓入N2,这样做的目的是_____________________________________________________。除去A和C中分别产生的氯气和二氧化硫,防止污染大气A中二氧化锰和浓盐酸在加热条件下反应制取氯气,C中亚硫酸钠与70%硫酸反应生成二氧化硫,通过控制止水夹可以实现实验探究:将氯气通入B中可以验证Fe3+、Cl2的氧化性;将氯气通入C中可以验证Cl2、SO2的氧化性,将二氧化硫通入B中可以验证Fe3+、SO2的氧化性。2.某研究性学习小组通过下列实验验证AgI沉淀的生成会使I2的氧化能力增强,可将Fe2+氧化。回答下列问题:(1)由AgNO3固体配制0.1 mol·L-1的AgNO3溶液50 mL,下列仪器中不需要使用的有____________________ (填名称),配制好的溶液应转移到____________(填试剂瓶的名称)中保存。蒸馏烧瓶、分液漏斗棕色细口瓶(2)步骤1的实验现象是_____________;步骤2无明显现象;步骤3最终的实验现象是溶液中生成黄色沉淀,____________。由此可知,步骤3反应的离子方程式为___________________________________。棕色细口瓶溶液蓝色褪去I2+2Fe2++2Ag+===2AgI↓+2Fe3+(3)为了确证AgI的生成使I2的氧化能力增强而将Fe2+氧化,学习小组在上述实验基础上进行补充实验:分别取少量的________________和步骤3试管中的上层清液于试管a和试管b中,向两支试管中加入适量的__________,观察到的现象为_________________________________。步骤2中的溶液KSCN溶液试管a溶液不变红,试管b溶液变红由于步骤2的溶液中有亚铁离子而没有铁离子,要确证AgI的生成使I2的氧化能力增强而将Fe2+氧化,只要证明步骤3的溶液中存在氧化产物铁离子即可。返回反应产物、反应机理的探究类型二1.解答产物确定题的思路分析由性质确定反应产物是解此类题目的根本思路,而题目中所涉及的物质,一般分为两类。2.寻求反应机理类探究性实验解题流程3.文字表述题的各种答题规范(1)沉淀洗涤是否完全的检验答题模板取少许最后一次洗涤液,滴入少量……溶液(试剂),若……(现象),表示已经洗涤完全。解答此类题目要注意四个得分点:取样+试剂+现象+结论。(2)实验操作的原因、目的、作用的答题要点(3)实验现象的准确、全面描述(4)试剂的作用的答题模板 (2022·广东卷)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25 ℃时,HAc的Ka=1.75×10-5=10-4.76。(1)配制250 mL 0.1 mol·L-1的HAc溶液,需5 mol·L-1 HAc溶液的体积为______mL。5.0溶液稀释过程中,溶质的物质的量不变,因此250×10-3 L×0.1 mol·L-1=V×5 mol·L-1,解得V=5×10-3 L=5.0 mL。(2)下列关于250 mL容量瓶的操作,正确的是___(填字母)。 C振荡时应用瓶塞塞住容量瓶口,不可用手指压住容量瓶口,故A错误;定容时平视,视线、溶液凹液面和刻度线应“三线相切”,不能仰视或俯视,且胶头滴管不能插入到容量瓶中,故B错误;向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶瓶口,故C正确;定容完成后,盖上瓶塞,左手食指抵住瓶塞,右手扶住容量瓶底部,将容量瓶反复上下颠倒,摇匀,故D错误。(3)某小组研究25 ℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。①根据表中信息,补充数据:a=______,b=______。3.0033.00实验Ⅶ的溶液中n(NaAc)∶n(HAc)=3∶4,V(HAc)=4.00 mL,因此V(NaAc)=3.00 mL,即a=3.00,由实验Ⅰ可知,溶液总体积为40.00 mL,因此V(H2O)=40.00 mL-4.00 mL-3.00 mL=33.00 mL,即b=33.00。②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡___(填“正”或“逆”)向移动;结合表中数据,给出判断理由:___________________________________________________________________________________________________________。③由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。实验结论:假设成立。正实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1,说明稀释HAc溶液时,电离平衡正向移动实验Ⅰ所得溶液的pH=2.86,实验Ⅱ的溶液中c(HAc)为实验Ⅰ的 ,稀释过程中,若不考虑电离平衡移动,则实验Ⅱ所得溶液的pH=2.86+1=3.86,但实际溶液的pH=3.36





