
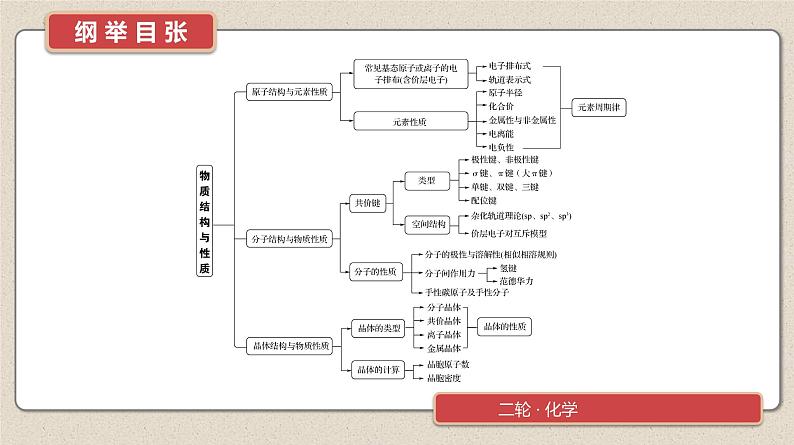






所属成套资源:2025年高考化学二轮复习 讲义+课件
微专题1 物质的结构与性质 元素周期律 (讲义+课件 2份打包)2025年高考化学二轮复习
展开
这是一份微专题1 物质的结构与性质 元素周期律 (讲义+课件 2份打包)2025年高考化学二轮复习,文件包含专题1微专题1物质的结构与性质元素周期律pptx、主题1微专题1物质的结构与性质元素周期律DOC等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
[常见基态原子、离子的电子排布式]1. 完成下列填空。(1)(2020·江苏卷)基态Fe的电子排布式为_______________________________。(2)(2017·江苏卷)基态Fe3+的电子排布式为______________________________。(3)(2018·江苏卷)基态Fe2+的电子排布式为______________________________。(4)(2019·江苏卷)基态Cu2+的电子排布式为______________________________。(5)(2016·江苏卷)基态Zn2+的电子排布式为______________________________。(6)(2015·江苏卷)基态Cr3+的电子排布式为______________________________。
1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d5或[Ar]3d5
1s22s22p63s23p63d6或[Ar]3d6
1s22s22p63s23p63d9或[Ar]3d9
1s22s22p63s23p63d10或[Ar]3d10
1s22s22p63s23p63d3或[Ar]3d3
[元素的性质]2. 比较元素的相关性质。(1)(2020·江苏卷)C、N、O元素的第一电离能由大到小的顺序为__________。(2)(2017·江苏卷)C、H、O三种元素的电负性由小到大的顺序为__________。
[共价键]3. 完成下列填空。(1)(2020·江苏卷)柠檬酸的结构简式如下图,1 ml柠檬酸分子中碳原子与氧原子形成的σ键的物质的量为__________。(2)(2018·江苏卷)N2分子中σ键与π键的物质的量之比n(σ)∶n(π)=________。
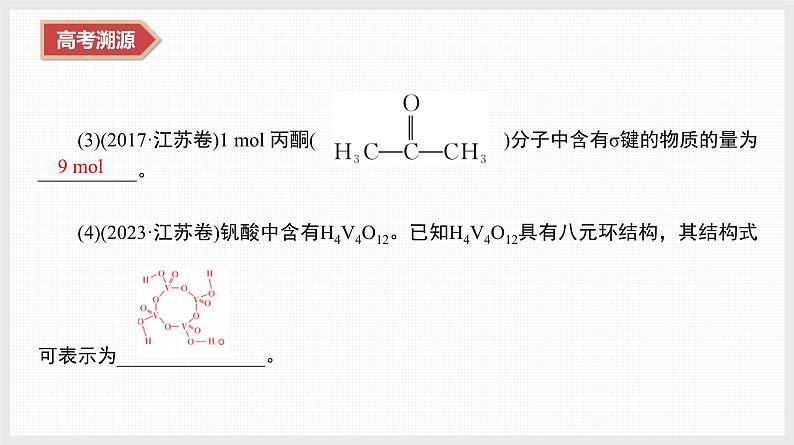
(3)(2017·江苏卷)1 ml 丙酮( )分子中含有σ键的物质的量为__________。(4)(2023·江苏卷)钒酸中含有H4V4O12。已知H4V4O12具有八元环结构,其结构式
可表示为_______________。
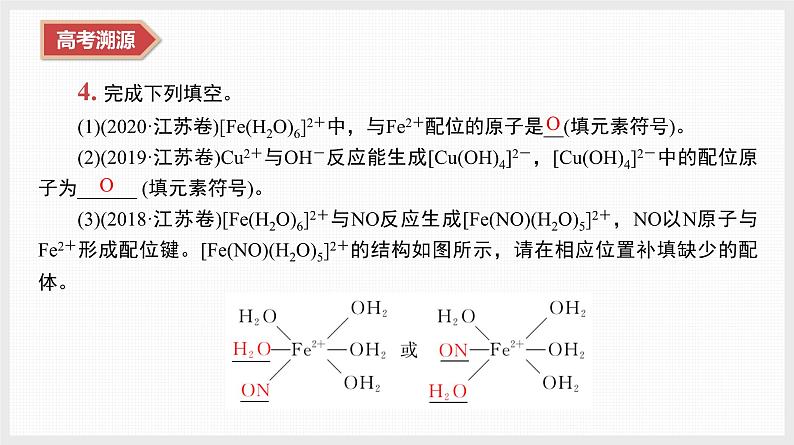
4. 完成下列填空。(1)(2020·江苏卷)[Fe(H2O)6]2+中,与Fe2+配位的原子是__(填元素符号)。(2)(2019·江苏卷)Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为______ (填元素符号)。(3)(2018·江苏卷)[Fe(H2O)6]2+与NO反应生成[Fe(NO)(H2O)5]2+,NO以N原子与Fe2+形成配位键。[Fe(NO)(H2O)5]2+的结构如图所示,请在相应位置补填缺少的配体。
(4)(2016·江苏卷)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间结
构,[Zn(CN)4]2-的结构可用示意图表示为_________________________________。
[分子的空间结构]5. Ⅰ. 原子的轨道杂化类型。(1)(2020·江苏卷)NH3分子中氮原子的轨道杂化类型为________。(3)(2017·江苏卷)丙酮( )分子中碳原子轨道的杂化类型为________。
(4)(2016·江苏卷)HOCH2CN的结构式为 ,该分子中碳原子轨道的杂化类型为__________。(5)(2013·江苏卷)在S的氢化物(H2S)分子中,S原子轨道的杂化类型为_____。(6)(2012·江苏卷)H2O 分子中O原子轨道的杂化类型为_____。Ⅱ. 分子或离子的空间结构。
[分子的物理性质]7. 完成下列填空。(1)(2019·江苏卷)推测抗坏血酸( )在水中的溶解度:________(填“难溶于水”或“易溶于水”)。(2)(2017·江苏卷)乙醇的沸点高于丙酮,这是因为____________________。(3)(2015·江苏卷)H2O与CH3CH2OH可以任意比例互溶,除了因为它们都是极性分子外,还因为______________________________________。(4)(2013·江苏卷)H2O在乙醇中的溶解度大于H2S,其原因是_________________
____________________。
水分子与乙醇分子之间可以形成氢键
8. (1)(2024·江苏卷)铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目之比N(Fe)∶N(Bi)=_______。
(3)(2021·江苏卷)1个AgI晶胞(如图)中含有__个I-。(4)(2019·江苏卷)1个Cu2O晶胞(如图)中,Cu原子的数目为__。
(5)(2014·江苏卷)Cu2O在稀硫酸中生成Cu和CuSO4,铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为____。
9. (2024·江苏卷)下列有关反应描述正确的是( )A. CH3CH2OH催化氧化为CH3CHO,CH3CH2OH断裂C—OB. 氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变O3分解的历程C. 丁烷催化裂解为乙烷和乙烯,丁烷断裂σ键和π键D. 石墨转化为金刚石,碳原子轨道的杂化类型由sp3转变为sp2
【解析】 CH3CH2OH催化氧化为CH3CHO,断裂CH3CH2OH分子中的C—H和O—H生成醛基,A错误;氟氯烃产生的氯自由基是催化剂,催化剂可以改变O3分解的历程,B正确;丁烷分子中没有π键,丁烷催化裂解为乙烷和乙烯,断裂丁烷分子中的碳碳σ键, C错误;石墨中碳原子轨道的杂化类型为sp2,金刚石中碳原子轨道的杂化类型为sp3,石墨转化为金刚石,碳原子轨道的杂化类型由sp2转变为sp3,D错误。
10. (2023·江苏卷)下列说法正确的是( )C. H2O2分子中的化学键均为极性共价键D. CaH2晶体中存在Ca与H2之间的强烈相互作用
11. (2023·江苏卷)下列物质结构与性质或物质性质与用途具有对应关系的是( )A. H2具有还原性,可作为氢氧燃料电池的燃料B. 氨极易溶于水,液氨可用作制冷剂C. H2O分子之间形成氢键,H2O(g)的热稳定性比H2S(g)的高D. N2H4中的N原子与H+形成配位键,N2H4具有还原性
【解析】 液氨汽化时会吸收大量的热,故液氨可用作制冷剂,与氨极易溶于水无关,B错误;氢键影响的是物质的物理性质,热稳定性是物质的化学性质,热稳定性与氢键无关,C错误;N2H4中不存在配位键,N2H4中N元素的化合价为-2,处于中间价态,可失去电子,故N2H4具有还原性,D错误。
12. (2022·江苏卷)下列说法正确的是( )A. 金刚石与石墨烯中的C—C—C夹角都为120°B. SiH4、SiCl4都是由极性键构成的非极性分子C. 锗原子(32Ge)基态核外电子排布式为4s24p2D. ⅣA族元素单质的晶体类型相同
【解析】 金刚石中碳原子为sp3杂化,键角为109°28′,石墨烯中碳原子为sp2杂化,键角为120°,A错误;SiH4、SiCl4为均正四面体形结构,结构对称,正、负电荷中心重合,Si—H、Si—Cl均为极性键,均是由极性键构成的非极性分子,B正确;锗是32号元素,锗原子核外有32个电子,基态锗原子核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,C错误;ⅣA族C、Si元素的单质的晶体类型不一定相同,C元素的单质有共价晶体,如金刚石,也有混合型晶体,如石墨,Si元素的单质为共价晶体,该族的其他元素的单质为金属晶体,D错误。
13. (2024·江苏卷)反应PbS+4H2O2===PbSO4+4H2O可用于壁画修复。下列说法正确的是( )A. S2-的结构示意图为 B. H2O2分子中既含离子键又含共价键D. H2O的空间结构为直线形
【解析】 S2-的结构示意图为 ,A错误;H2O2分子中只含共价键,B
错误;H2O分子中的O原子的轨道杂化类型为sp3, H2O的空间结构为V形,D错误。
14. (2023·江苏卷)反应NH4Cl+NaNO2===NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是( )C. N2分子中存在N≡N键D. H2O为非极性分子
15. (2022·江苏卷)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是 ( )A. Na2O2的电子式为 B. H2O的空间结构为直线形C. H2O2中O元素的化合价为-1D. NaOH仅含离子键
【解析】 过氧化钠是离子化合物,电子式是 ,A
错误;H2O分子空间结构为V形,B错误;NaOH的OH-中,O原子和H原子之间是共价键,D错误。
16. (2021·江苏卷)反应Cl2+2NaOH===NaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是( )A. Cl2是极性分子B. NaOH的电子式为 C. NaClO既含离子键又含共价键D. Cl-与Na+具有相同的电子层结构
【解析】 Cl2分子正、负电荷中心重合,为非极性分子,A错误;NaOH的电子
式为 ,B错误;NaClO中,Na+和ClO-之间存在离子
键,ClO-内部的Cl—O是共价键,该物质中含有离子键和共价键,C正确;Cl-核外有3个电子层,Na+核外有2个电子层,二者电子层结构不同,D错误。
17. (2024·江苏卷)我国探月工程取得重大进展。月壤中含有Ca、Fe等元素的磷酸盐,下列元素位于元素周期表中第二周期的是( )A. O B. P C. Ca D. Fe
18. (2024·江苏卷)KAl(SO4)2·12H2O(明矾)可用作净水剂。下列说法正确的是( )A. 半径:r(Al3+)>r(K+)B. 电负性:χ(O)>χ(S)C. 沸点:H2S>H2OD. 碱性:Al(OH)3>KOH
【解析】 Al3+有2个电子层,而K+有3个电子层,半径:r(Al3+)<r(K+),A错误;H2O分子间可形成氢键,沸点:H2S<H2O,C错误;元素的金属性越强,其最高价的氧化物的水化物的碱性越强,碱性:Al(OH)3<KOH,D错误。
19. (2023·江苏卷)元素C、Si、Ge位于周期表中ⅣA族。下列说法正确的是( )A. 原子半径:r(C)>r(Si)>r(Ge)B. 电离能:I1(C)<I1(Si)<I1(Ge)C. 碳单质、晶体硅、SiC均为共价晶体D. 可在周期表中元素Si附近寻找新半导体材料
【解析】 同主族元素从上到下,原子半径逐渐增大,A错误;同主族元素从上到下,第一电离能逐渐减小,B错误;C元素有多种同素异形体,其中,金刚石是共价晶体,C60是分子晶体,石墨是混合型晶体,C错误。
20. (2022·江苏卷)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是( )A. 半径:r(Al3+)<r(Na+)B. 电负性:χ(F)<χ(O)C. 电离能:I1(O)<I1(Na)D. 碱性:NaOH<Al(OH)3
【解析】 核外电子数相同时,核电荷数越大,半径越小,故半径:r(Al3+)<r(Na+),A正确;同周期主族元素核电荷数越大,电负性越大,故电负性:χ(F)>χ(O),B错误;同周期从左到右,元素的第一电离能呈增大趋势,同主族从上到下第一电离能逐渐减小,故电离能:I1(O)>I1(Na),C错误;元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,故碱性:NaOH>Al(OH)3,D错误。
21. (2021·江苏卷)前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同个主族。下列说法正确的是( )A. 原子半径:r(X)<r(Y)<r(Z)<r(W)B. X的第一电离能比同周期相邻元素的大C. Y的最高价氧化物对应的水化物的酸性比Z的强D. Z的简单气态氢化物的热稳定性比W的弱
【解析】 由题给信息推知,X、Y、Z、W分别为N元素、Al元素、Cl元素、Br元素。同周期主族元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径:r(N)<r(Cl)<r(Al)<r(Br),A错误;氮原子的2p轨道处于半满稳定状态,氮元素的第一电离能比同周期相邻元素的大,B正确;非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性:Al<Cl,则Al的最高价氧化物对应的水化物的酸性比Cl的弱,C错误;非金属性越强,简单气态氢化物的热稳定性越强,非金属性:Cl>Br,则热稳定性:HCl>HBr,D错误。
1. 常见基态原子(或离子)的简化电子排布式(或价层电子排布式)
[Ar]3d104s1
[Ar]3d104s2
[Ar]3d104s24p3
[Ar]3d104s24p5
2. 元素周期律与元素性质(1)第一电离能说明:①同周期元素从左到右,第一电离能总体呈增大趋势,但由于全充满或半充满的原因,ⅡA、ⅤA出现了反常;②同主族元素从上到下,第一电离能减小。
(2)电负性①同周期主族元素从左到右,电负性增大;②同主族元素从上到下,电负性减小。(3)主族元素性质(填“增强”或“减弱”)
化学键的类型:离子键、共价键、金属键。1. 离子键(1)带相反电荷离子之间的相互作用叫作离子键。(2)由离子键构成的化合物为离子化合物。(3)离子键的强弱判断:一般,阴、阳离子所带的电荷数越多、半径越小,离子键越强。如熔、沸点:MgO>NaCl>CsCl。
2. 共价键(1)原子间通过共用电子对形成的相互作用叫作共价键。(2)共价键的键参数
1. 价层电子对互斥模型和空间结构
2. 杂化类型与分子的空间结构
3. 键角大小的比较(1)杂化类型相同情况下,孤电子对数越多,键角越小,如键角:CH4>NH3>H2O。(2)空间结构相同情况下:①中心原子的电负性越大,键角越大,如键角:NH3>PH3;②中心原子相同,配位原子的电负性越大,键角越小,如键角:NF3<NCl3、OF2<H2O。
1. 极性分子与非极性分子
极性分子与非极性分子 超分子
2. 超分子(1)定义:超分子是由____________________的分子通过__________________形成的分子聚集体。(2)超分子定义中的分子是广义的,包括离子;超分子有的是有限的,有的是无限伸展的;超分子的重 要特征是________和______。
1. 范德华力与氢键的比较
分子间作用力(范德华力与氢键)
2. 同主族氢化物的沸点比较
3. 氢键对物质性质的影响
1. 常见的几种典型晶体的晶胞结构图及其主要性质
晶体类型与性质(学用P9)
2. 晶胞中粒子数目的计算
3. 晶体密度的计算(3)晶胞的体积:V=a3(立方体)或abc(长方体)。
4. 晶体熔、沸点高低的判断规律(1)不同类型晶体熔、沸点的高低判断一般来说,熔、沸点高低顺序:共价晶体>离子晶体>分子晶体;金属晶体有高、有低。(2)同种类型晶体的熔、沸点的判断
例1 (1)基态Sc原子的电子排布式为________________________________。(2)基态Cu原子的电子排布式为_______________________________________。(3)基态Cr原子的电子排布式为_______________________________________。(4)基态Br-的价层电子排布式为_____________。
常见基态原子、离子的电子排布式
1s22s22p63s23p63d14s2(或[Ar]3d14s2)
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
1s22s22p63s23p63d54s1(或[Ar]3d54s1)
例2 写出下列物质(或离子)的电子式,并指出其中的化学键类型。(1)氮气:___________________;水:___________________;氯化氢:___________________;二氧化碳:________________________;次氯酸:______________________;肼(N2H4):______________________。
(2)氯化钠:_________________________;氯化镁:________________________________;氧化钠:________________________________;过氧化钠:_____________________________________________;氯化铵:________________________________________;氢氧化钠:__________________________________________。
(3)羟基:_______________________;醛基:___________________;铵根离子:__________________________。
例3 (1)碳化钙(CaC2)中含有化学键的类型:________________;属于______化合物。(2)Na2O2中含有的化学键的类型:________________。(3)1 ml CH3COOH分子中含有σ键的物质的量为____________。(4)甲醛(HCHO)分子中π键和σ键的个数之比为___________。(5)1 ml二甲醚(H3C—O—CH3)分子中含有σ键的物质的量为____________。(6)1 ml乙醛分子中含有σ键的物质的量为____________。(7)AlCl3在178 ℃时升华,属于________晶体,其蒸气的相对分子质量约为
267(Al—27,Cl—35.5),蒸气分子的结构式为_________________ (标明配位键)。
(8)平面形分子 中的大π键应表示为______。(9)一种钴的配合物(乙二胺四乙酸合钴)的结构如图,1 ml该配合物形成的配位键有____ml,配位原子是________,碳原子的杂化类型有_____________。
(10)酞菁和钴酞菁的分子结构如图所示。 酞菁 钴酞菁酞菁分子中所有原子共平面,其中p轨道能提供1个电子对的N原子是___(填酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为____,氮原子提供孤电子对与钴离子形成______键。
【解析】 (9)乙二胺四乙酸合钴中的氮原子、氧原子均提供孤电子对作为配位原子,则1 ml该配合物形成的配位键有6 ml,碳原子有sp2、sp3两种杂化方式。 (10)已知酞菁分子中所有原子共平面,则其分子中所有的C原子和所有的N原子均为sp2杂化,且分子中存在大π键,其中标号为①②的N原子均有1个电子对占据了1个sp2杂化轨道,其p轨道只能提供1个电子参与形成大π键,标号为③的N原子的 p轨道能提供1个电子对参与形成大π键;标号为③的N原子形成的N—H易断裂从而电离出H+;钴酞菁分子中,失去了2个H+的酞菁离子与钴离子通过配位键结合成分子,故钴离子的化合价为+2,氮原子提供孤电子对与钴离子形成配位键。
例4 (1)SO2分子的空间结构为__________。(2) 分子中原子轨道采用sp2杂化的碳原子数目是_______。(3)键角:ClO2__Cl2O(填“>”“Cl—C,则极性:F3C—>Cl3C—,导致三氟乙酸的羧基中的羟基极性更大,更容易电离出H+,酸性更强,B不符合题意;电负性:F>Cl,极性:F—H>Cl—H,导致分子极性:HF>HCl,C不符合题意;氢键的形成条件是原子的半径小、电负性大,电负性:F>Cl,故HF分子间可以形成氢键,气态氟化氢中存在(HF)2,而气态氯化氢分子间不能形成氢键,D不符合题意。
例6 回答下列问题。(1)基态硅原子的核外电子排布式为_____________。 (2)从晶体类型看,C60属于______晶体。(3)SiO2结构与金刚石结构(如图1)相似,即SiO2的结构相当于在晶体硅结构中每个Si—Si之间插入1个O原子,则SiO2的空间网状结构中,Si、O原子形成的最小环上有______个原子;晶体硅中硅原子与共价键的个数之比为______。
1s22s22p63s23p2
(4)CO2的晶胞模型如图2所示,若晶胞的边长为a cm,则CO2晶体的密度ρ=
_____g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
(5)S单质的常见形式为S8环状结构(如图: ),S原子采用的轨道杂化类型是__________。(6)Se和S同主族,H2Se的热稳定性比H2S____(填“强”或“弱”)。气态SeO3分子的空间结构为____________。(7)H2SeO4比H2SeO3酸性强的原因是______________________________________
____________________________________________________________________。
由于H2SeO4分子中中心原子Se的正电性高于
H2SeO3中的Se,导致羟基上O原子偏向Se,在水分子的作用下越易电离出H+
(8)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3所示,二聚体中Al的轨道杂化类型为________。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断Al、F之间的化学键为______键。AlF3结构属立方晶系,晶胞如图4所
示,F-的配位数为__。若晶胞参数为a pm,晶体密度ρ=________________g/cm3(列出计算式,设NA为阿伏加德罗常数的值。F—19,Al—27)。
(7)H2SeO3的分子结构为 ,Se元素为+4价,H2SeO4的分子结
构为 ,Se元素为+6价, Se原子吸电子能力强,更容易电离
出H+。
例7 (2024·南京、盐城一模)短周期主族元素X、Y、Z、W的原子序数依次增大,X的一种核素没有中子,基态Y原子的p轨道为半充满,Z单质是植物光合作用的产物之一,W与Z同族。下列说法正确的是( )A. X位于元素周期表中第二周期 ⅣA族B. 共价键的极性:X—Y<X—Z<X—WC. 简单气态氢化物的热稳定性:W<Y<ZD. X、Y、Z三种元素形成化合物的水溶液一定呈酸性
【解析】 X、Y、Z、W依次为H、N、O、S。H元素位于元素周期表中第一周期ⅠA族,A错误;两种非金属元素的电负性差值越大,形成共价键的极性越强,电负性:O>N>S,则共价键的极性:H—O>H—N>H—S,B错误;元素的非金属性越强,其简单气态氢化物的热稳定性越强,非金属性:O>N>S,则热稳定性:H2S<NH3<H2O,C正确;H、N、O可形成多种化合物,如形成的HNO3的水溶液呈酸性,形成的NH3·H2O的水溶液呈碱性,D错误。
A. CH3COOH属于共价晶体C. P原子的结构示意图为 D. 基态Fe2+的电子排布式为[Ar]3d54s1
【解析】 CH3COOH属于分子晶体,A错误;H2O的电子式为 ,B错误;基态Fe2+的电子排布式为[Ar]3d6,D错误。
1. (2024·黑吉辽卷)下列化学用语或表述正确的是( )B. SiO2的晶体类型:分子晶体C. F2的共价键类型:p-pσ键D. PCl3的空间结构:平面三角形
2. (2024·安徽卷)某催化剂结构简式如图所示。下列说法错误的是( )A. 该物质中Ni元素为+2价B. 第一电离能:Cl>PC. 该物质中C原子和P原子均采取sp2杂化D. 基态Ni原子价层电子排布式为3d84s2
【解析】 该配合物中P原子提供孤电子对、Ni原子提供空轨道形成配位键,Ni原子形成的4个化学键中,2个P—Ni是配位键,根据氯离子个数知,Ni元素的化合价为+2,A正确;同一周期从左到右,元素的第一电离能呈增大趋势,第一电离能:Cl>P,B正确;该分子中C原子均在苯环上,C原子均为sp2杂化,P原子价层电子对数都是4,所以P原子的杂化类型为sp3,C错误;基态Ni原子的电子排布式为[Ar]3d84s2,基态Ni原子价层电子排布式为3d84s2,D正确。
3. (2024·安徽卷)25 ℃时,Ka(HNO2)=7.2×10-4,Kb(NH3·H2O)=1.8×10-5,Kb(NH2OH)=8.7×10-9。下列有关物质结构或性质的比较正确的是( )B. 熔点:NH2OH>[NH3OH]ClC. 25 ℃下,相同浓度溶液的pH:[NH3OH]Cl>NH4ClD. 羟胺分子间氢键的强弱:O—H…O>N—H…N
4. (2024·广东卷)一种可为运动员补充能量的物质,其分子结构式如图所示。已知R、W、Z、X、Y为原子序数依次增大的短周期主族元素,Z和Y同族。下列说法正确的是( )A. 沸点:ZR3
相关课件
这是一份微专题2 常见物质的性质、用途及转化 (讲义+课件 2份打包)2025年高考化学二轮复习,文件包含专题1微专题2常见物质的性质用途及转化pptx、主题1微专题2常见物质的性质用途及转化DOC等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2025届高考化学一轮总复习第6章物质结构与性质元素周期律微专题10晶胞结构的分析及相关计算课件,共22页。
这是一份高考化学二轮复习专题5物质结构与性质课件,共60页。PPT课件主要包含了高考命题分析,核素和同位素,d64s2,s23p4,s22p3,s24p4,d54s2,练预测·押考向,GeSe,电子云等内容,欢迎下载使用。









