






基础排查6 常考热点物质(讲义+课件 2份打包)2025年高考化学二轮复习
展开
这是一份基础排查6 常考热点物质(讲义+课件 2份打包)2025年高考化学二轮复习,文件包含基础排查6常考热点物质pptx、基础排查6常考热点物质DOC等2份课件配套教学资源,其中PPT共56页, 欢迎下载使用。
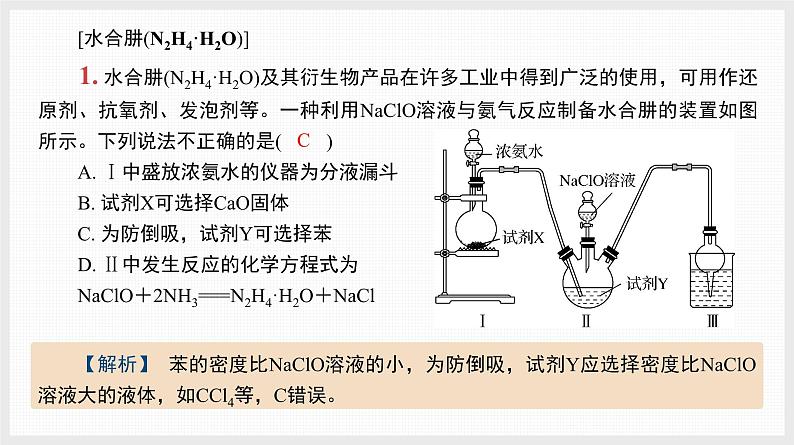
[水合肼(N2H4·H2O)]1. 水合肼(N2H4·H2O)及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是( )A. Ⅰ中盛放浓氨水的仪器为分液漏斗B. 试剂X可选择CaO固体C. 为防倒吸,试剂Y可选择苯D. Ⅱ中发生反应的化学方程式为NaClO+2NH3===N2H4·H2O+NaCl
【解析】 苯的密度比NaClO溶液的小,为防倒吸,试剂Y应选择密度比NaClO溶液大的液体,如CCl4等,C错误。
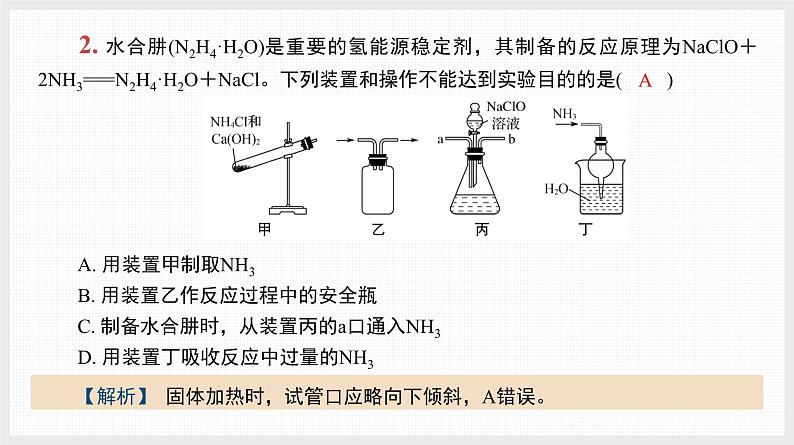
2. 水合肼(N2H4·H2O)是重要的氢能源稳定剂,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列装置和操作不能达到实验目的的是( )A. 用装置甲制取NH3B. 用装置乙作反应过程中的安全瓶C. 制备水合肼时,从装置丙的a口通入NH3D. 用装置丁吸收反应中过量的NH3
【解析】 固体加热时,试管口应略向下倾斜,A错误。
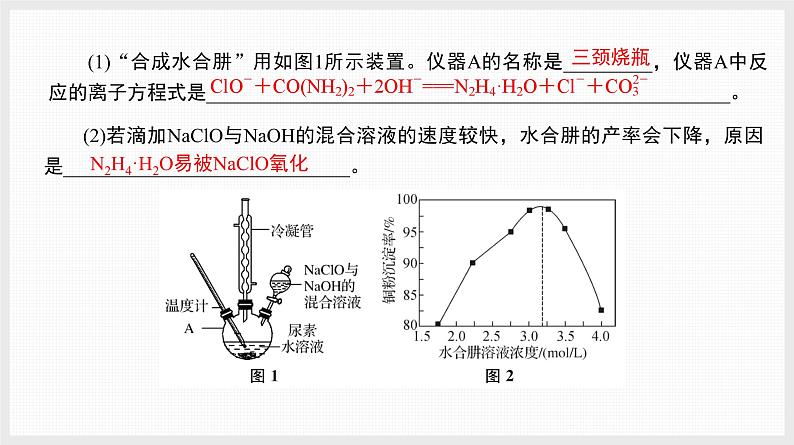
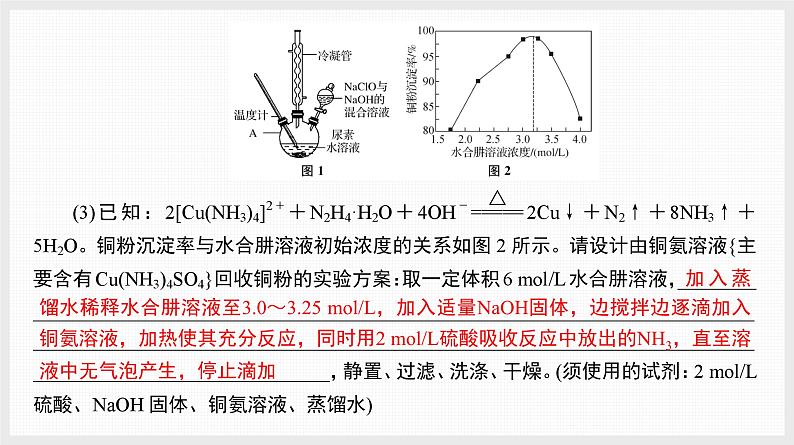
3. 水合肼(N2H4·H2O)的制备方法有多种,实验室以Cl2、NaOH和尿素[CO(NH2)2]为原料制备,再用水合肼处理铜氨溶液并制得铜粉,其实验过程表示如下:
已知:N2H4·H2O的沸点约118 ℃,具有强还原性。
(2)若滴加NaClO与NaOH的混合溶液的速度较快,水合肼的产率会下降,原因是_____________________________。
N2H4·H2O易被NaClO氧化
(1)“合成水合肼”用如图1所示装置。仪器A的名称是_________,仪器A中反应的离子方程式是_____________________________________________________。
加入蒸馏水稀释水合肼溶液至3.0~3.25 ml/L,加入适量NaOH固体,边搅拌边逐滴加入铜氨溶液,加热使其充分反应,同时用2 ml/L硫酸吸收反应中放出的NH3,直至溶液中无气泡产生,停止滴加
4. N2H4·H2O处理碱性银氨{[Ag(NH3)2]+}溶液获得超细银粉的工艺流程如下:
(1)实验室中配制一定体积的银氨溶液的方法为__________________________ ______________________________________________________________________________(提供的试剂:2%的稀氨水、2%的硝酸银溶液)。
取一定体积2%的硝酸银溶液于试管中,边振荡试管边向其中滴加2%的稀氨水,直至产生的沉淀恰好完全溶解
(2)制备超细银粉:在水合肼溶液中逐滴加入新制的银氨溶液,控制20 ℃充分反应。①水合肼还原银氨溶液的离子方程式为_________________________________ _____________________________。②水合肼直接与AgNO3溶液反应也能生成Ag,用银氨溶液代替AgNO3溶液的原因是____________________________________________________________________ ______________________________________________________________________。
4Ag↓+N2↑+8NH3+5H2O
有效降低溶液中Ag+的浓度,减弱Ag(Ⅰ)的氧化性,降低Ag+与水合肼分子相互碰撞而发生氧化还原反应的概率,减小化学反应速率,便于得到超细银粉
(3)实验室通过如下步骤测定所制超细银粉样品中Ag的质量分数(杂质不参与反应)。①称取超细银粉样品2.500 g,加适量稀硝酸充分溶解、过滤、洗涤,将滤液和洗涤滤液合并定容到250 mL容量瓶中。②准确量取25.00 mL溶液置于锥形瓶中,酸化后滴入几滴指示剂铁铵矾[NH4Fe(SO4)2]溶液,再用0.100 0 ml/L NH4SCN标准溶液滴定。滴定终点的实验现象为_________________________________________________________________。
当滴入最后半滴NH4SCN标准溶液时,溶液变红,且30 s内不褪色
③重复②的操作3次,所用NH4SCN标准溶液的平均体积为23.00 mL,求样品中银的质量分数(写出计算过程)。已知:Ag++SCN-===AgSCN↓(白色)。
【解析】 (1)配制银氨溶液时,应将稀氨水逐滴滴加到硝酸银溶液中。(2)①水合肼还原银氨溶液得到银粉的同时,还得到N2和NH3,离子方程式见答案。②要制备超细银粉,则银的生成速率不能太快,银氨溶液中Ag+浓度小于AgNO3溶液中 Ag+浓度,则Ag+的氧化性减弱,从而减小化学反应速率,便于得到超细银粉。(3)②达到滴定终点时,过量的SCN-与指示剂中的Fe3+结合生成红色物质,且30 s内不褪色。
5. 某实验室设计了如图所示装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成OH-和H+并可分别通过阴、阳膜定向移动。(1)双极膜中产生的________(填“H+”或“OH-”)移向多孔铂电极。(2)石墨电极反应式为_______________________________。
ClO-+2e-+H2O===Cl-+2OH-
[铬酸钾与重铬酸钾]6. 为了处理废水中含有的大量Cr(Ⅵ),工业上可以用还原法处理。Ⅰ. 还原沉淀法
Ⅱ. 还原吸附法(3)纳米磁性Fe3O4的制备以FeSO4和Fe2(SO4)3为原料,在氨水存在的条件下反应可生成纳米磁性Fe3O4,发生反应的化学方程式为________________________________________________ _________。
FeSO4+Fe2(SO4)3+8NH3·H2O===Fe3O4+4(NH4)2SO4+4H2O
(5)Fe3O4@SiO2-GO还原吸附氧化石墨烯(记作GO)表面含有—COOH等含氧官能团,将氧化石墨烯嫁接在Fe3O4@SiO2的表面得到Fe3O4@SiO2-GO,其去除废水中Cr(Ⅵ)的过程如下:
“吸附”过程中,氧化石墨烯表面带电微粒与Cr3+之间的静电作用是实现“吸附”的重要因素,溶液中Cr3+去除率随pH变化如图所示。
①pH较小时,Cr3+去除率较低的原因是________________________________ ______________________________________________________________________________________________________________________________________________。②实际除Cr3+时,控制pH约为6,而不选择更高pH的原因是____________ __________________________________________________________________________________________________________________。
pH较小时,此时Cr(Ⅵ)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,且溶液中H+浓度较大,导致氧化石墨烯表面带电微粒吸附大量的H+,不利于吸附Cr3+,导致去除率较低
pH大于6,溶液中OH-浓度过大,将与Fe3O4@SiO2-GO中的SiO2反应以及和GO中的—COOH反应,从而破坏Fe3O4@SiO2-GO,使其失效
7. 工业上以铬铁矿[主要成分为Fe(CrO2)2,杂质主要为硅和铝的氧化物]制备重铬酸钾的工艺流程如下:已知:“焙烧”时Fe(CrO2)2转化为NaFeO2和Na2CrO4,硅和铝的氧化物分别转化为Na2SiO3和Na[Al(OH)4];NaFeO2能强烈水解。(1)写出“焙烧”过程中发生主要反应的化学方程式:____________________ ________________________________________。(2)“水浸”后滤渣的主要成分是Fe(OH)3,“中和”后滤渣的主要成分是_____________________(填化学式)。
4Fe(CrO2)2+10Na2CO3
H2SiO3、Al(OH)3
①滴定终点的判断方法是______________________________________________ __________________________________________。②该样品的纯度为____________________________(写出计算过程,K2Cr2O7的摩尔质量为294 g/ml)
滴入最后半滴Na2S2O3标准溶液后,溶液蓝色恰好褪去,且30 s不恢复原来的颜色
94.08% (计算过程见解析)
(4)铬酸铅(PbCrO4)是一种黄色颜料,难溶于水,可由沸腾的铬酸盐溶液与铅盐溶液反应制得。已知:①Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。②Cr(Ⅵ)在溶液中物种分布分数与pH关系如图所示。
请设计由K2Cr2O7溶液制备铬酸铅(PbCrO4)的实验方案:_________________ ______________________________________________________________________________________________________________________________________,得PbCrO4 [实验中须使用的试剂有:6 ml/L KOH溶液,0.5 ml/L Pb(NO3)2溶液]。
向K2Cr2O7溶液中边搅拌边滴加6 ml/L KOH溶液,至pH略小于7.2,加热溶液至沸腾,边搅拌边加入0.5 ml/L Pb(NO3)2溶液至不再产生沉淀,静置,过滤,洗涤,干燥
8. 氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成分为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:
陶瓷中的SiO2在高温下
(3)操作Ⅰ包括过滤与洗涤,简述实验室中洗涤沉淀的操作:_____________ _____________________________________________________________________。(4)硫黄在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为_____________________________________________________,滤渣中除Al(OH)3外还有___________(填化学式)。(5)某工厂用448 kg铬铁矿粉[含80%Fe(CrO2)2]制备Cr2O3,最终得到产品182.4 kg,产率为____________(Cr—52)。(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_________,才能使铬离子沉淀完全[已知:离子浓度小于1×10-5 ml/L时视为沉淀完全,Cr(OH)3的Ksp=1.0×10-32]。
将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水自然流下后,再重复操作2~3次
(2)纳米铁粉还原法:纳米铁粉可将水体中Cr(Ⅵ)还原为Cr3+,再通过调节溶液pH,可使Cr3+转化为Cr(OH)3沉淀而被除去。
②实验发现,其他条件相同,含铁的物质的量相同,用纳米铁粉和铁-铜粉分别处理pH=5的含Cr(Ⅵ)废水,废水中Cr(Ⅵ)的去除率随时间变化关系如图1所示,用铁-铜粉处理含Cr(Ⅵ)废水的效果更好,原因是____________________________。
Fe-Cu原电池加快了反应速率
(3)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬(总浓度为0.20 ml/L)废水中加入等量NaHSO3,将Cr(Ⅵ)还原成Cr(Ⅲ),再加入石灰乳可将Cr(Ⅲ)转化为Cr(OH)3沉淀。①已知溶液中含铬物种浓度随pH的变化如图2所示,pH=4时,溶液中主要含Cr(Ⅵ)粒子与NaHSO3反应的离子方程式为_________________________________ ___________________________。
②废水中残留Cr(Ⅵ)与反应时间的变化关系如图3所示,实际反应中,控制废水pH为2.5的原因是_________________________________________________________ __________________________。
pH偏高,H+浓度低,反应速率较慢;pH偏低,H+浓度大,HSO易转化为SO2气体逸出
(2)沉淀法回收Cr(Ⅵ)。已知:CaSO4和CaCrO4微溶于水,Ksp(BaSO4)=1.1× 10-10,Ksp(BaCrO4)=1.2×10-10。①向除去CN-和Ni元素的废液中加入一定量的BaCl2,可将Cr(Ⅵ)转化为BaCrO4沉淀。相同时间内,Cr元素沉淀率与溶液初始pH的关系如图1所示。与pH=6相比,初始pH=7时Cr(Ⅵ)去除率较高的原因是_______________________________ ___________________________________________________________________________________________________________________________。
②BaCrO4沉淀中混有BaSO4等杂质,可加入足量硫酸充分反应后过滤,实现Cr(Ⅵ)的分离回收,反应的离子方程式为_____________________________________ ______________。
(3)电解法除Cr(Ⅵ)的一种装置如图2所示。利用阳极生成的Fe2+,还原Cr(Ⅵ)生成Cr3+,最终转化为Cr(OH)3和Fe(OH)3沉淀除去。①随着电解的进行,阳极表面形成FeO·Fe2O3的钝化膜,电解效率降低。将电源正负极反接一段时间,钝化膜消失。钝化膜消失的原因为_________________ _________________________。
电极交换后,阴极产生H2,使钝化膜还原
0.5(计算过程见解析)
11. 铬和钒具有广泛用途。从含高价钒(Ⅴ)、铬(Ⅵ)废水中提取铬和钒的一种流程如图所示:
②图1表示pH=4时不同铁钒摩尔比条件下对钒去除率的影响。当铁钒摩尔比大于2时,钒去除率会再次增大、但增加幅度趋缓,其原因是__________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
③回收的钒可制备V2O5,V2O5可作为二氧化硫被氧气氧化的催化剂。反应机理如下:第一步:V2O5+SO2===2VO2+SO3;第二步:__________________________(写化学方程式)。
4VO2+O2===2V2O5
①写出Na2S2O5还原Cr(Ⅵ)的离子方程式:_______________________________ ___________________________。
(3)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图2所示。请补充完整由Cr2(SO4)3溶液制得Cr(OH)3的实验方案:取分离、提纯得到的Cr2(SO4)3溶液,_________________________________________________________________________________________________________________________________________________________________________________,低温烘干,得到高纯Cr(OH)3晶体。实验中须使用的试剂:蒸馏水、2 ml/L NaOH溶液、1.0 ml/L HCl溶液、 1.0 ml/L BaCl2溶液
边搅拌边加入2 ml/L NaOH溶液,调节溶液的pH在6~12范围内,静置,过滤,用蒸馏水洗涤沉淀,直至向最后一次洗涤滤液中滴加1.0 ml/L HCl溶液,再加1.0 ml/L BaCl2溶液不再出现浑浊
[次氯酸钠(NaClO)]12. 实验室制备NaClO溶液并用于处理含氨氮废水。(1)低温下将Cl2通入NaOH溶液中制得NaClO溶液,装置如图所示。
①装置B中盛放的试剂是________________。②为了防止装置C温度升高生成副产物NaClO3,可采取的操作为___________ ___________________________________________。
装置C使用冰水浴冷却(或向装置A中缓慢滴加浓盐酸)
(2)NaClO溶液处理含氨氮废水(pH为6.0~7.0)。室温下,分别取200 mL预处理后的废水,将初始pH调节至不同值,加入等量NaClO溶液,30分钟后检测剩余氨氮浓度。不同初始pH对NaClO氧化脱除氨氮效果的影响如图1所示,不同初始pH对应反应结束后的pH如图2所示。
①NaClO将废水中NH3氧化为无污染气体,反应的化学方程式为_____________ ______________________________。实验中NaClO溶液的实际投入量大于理论计算量,其原因是_________________________________。②处理后的废水pH在6.0~9.0之间才能排放。NaClO溶液处理含氨氮废水初始pH设置为7.0而不是2.0的原因是___________________________________________。
2NH3+3NaClO===N2↑+3H2O+3NaCl
NaClO(或HClO)不稳定,易分解
pH为7.0时氨氮去除率高且调节pH所需的酸更少
用0.050 0 ml/L Na2S2O3溶液滴定至溶液呈微黄色,加入2~3滴淀粉溶液,继续滴定至加入最后半滴Na2S2O3溶液后,溶液蓝色褪去,且30 s不恢复原来的颜色。平行滴定三次,记录消耗Na2S2O3溶液的体积
【解析】 (1)②C中温度低时可有效避免副反应,则为了防止装置C温度升高生成副产物NaClO3可采取使用冰水浴冷却或向装置A中缓慢滴加浓盐酸等。(2)②由图知,pH=2.0时和7.0时,氨氮去除率均较高,但当pH=2.0时,次氯酸根离子易转变为次氯酸而消耗酸,会消耗更多的酸。(3)碘遇淀粉变蓝色,该滴定中以淀粉作指示剂,滴定时,应先以0.050 0 ml/L Na2S2O3滴定到浅黄色,再加入淀粉,再继续以0.050 0 ml/L Na2S2O3溶液滴定到蓝色恰好消失且30 s不恢复原来的颜色为终点。淀粉指示剂若加入太早,则大量的碘单质与淀粉结合成蓝色物质,这一部分碘就不容易与硫代硫酸钠反应,会使滴定发生误差。滴定到终点后几分钟,溶液又会出现蓝色,这是由于空气氧化碘离子引起的。为避免误差,应作平行实验,故需平行滴定三次。
[二氧化氯(ClO2)]13. 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0 ℃,浓度高时极易爆炸。
(1)实验室在60 ℃的条件下用闪锌矿(主要成分为ZnS)与NaClO3溶液、H2SO4溶液制备二氧化氯,同时生成硫酸锌。①写出反应的离子方程式:___________________________________________________。
②用如图所示的装置制备二氧化氯。则闪锌矿、NaClO3溶液、H2SO4溶液三种反应物的加料方式是_____________________________________________________ __________________________________________。③若闪锌矿加料过量太多,生成ClO2的量明显减少的原因是___________ _____________________________________________________________________________________。④反应过程中通入N2的作用是__________________________________________ ________________________。
将粉碎后的闪锌矿和NaClO3溶液混合(制成浆料)加入三颈烧瓶中,从滴液漏斗中缓慢滴加H2SO4溶液
闪锌矿过量太多时,过量的ZnS将生成的ClO2还原(或者过量的ZnS直接将NaClO3中的Cl还原至更低价态)
加速ClO2的排出;起搅拌作用;稀释ClO2,防止其浓度高时发生爆炸
(2)工业上常用ZnS去除废水中Cu2+。反应为ZnS(s)+Cu2+(aq)===CuS(s)+Zn2+(aq),该反应的平衡常数K______________[已知:Ksp(CuS)=6.0×10-36,Ksp(ZnS)=3.0×10-25 ]。
6.75 mg/L(计算过程见解析)
14. 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:①电解时发生反应的化学方程式为____________________________________。②溶液X中大量存在的阴离子有_______________。(2)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_________(填字母)。a. 明矾b. 碘化钾c. 盐酸d. 硫酸亚铁
(3)用如图装置可以测定混合气中ClO2的含量:Ⅰ. 在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;Ⅱ. 在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;Ⅲ. 将一定量的混合气体通入锥形瓶中吸收(ClO2+I-+H+―→I2+H2O+Cl-,未配平);Ⅳ. 将玻璃液封装置中的水倒入锥形瓶中;
①玻璃液封装置的作用是____________________________________________。②测得混合气中ClO2的质量为_____________________________ (写出计算过程)。
防止碘的逸出,也可吸收未反应的ClO2
0.027 00 g(计算过程见解析)









