
高中化学人教版 (2019)必修 第一册第二节 元素周期律第3课时教学设计及反思
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律第3课时教学设计及反思,共10页。
课题
《元素周期律》第三课时
单元
4
学科
化学
年级
高一
教材
分析
本节教学内容是人教版高中化学必修第一册第四章《物质结构元素周期律》第二节《元素周期律》的第三课时。该部分的教学内容涉及到第三周期元素性质递变的探索,同周期元素性质的递变,元素周期律的概念,元素周期律所对应的多个变化规律,元素周期表和元素周期律的应用及相关内容。元素在周期表中的位置,反映了元素的原子结构和性质。在认识了元素周期律以后,可以根据元素在周期表中的位置推测其原子结构和性质,并研究元素性质的变化规律;也可以根据元素的原子结构推测其在周期表中的位置和性质。科学家依据元素周期律和周期表,对元素性质进行系统研究,可以为新元素的发现,以及预测它们的原子结构和性质提供线索。本节安排了“归纳掌握原子结构示意图”,“归纳掌握同周期主族元素性质的递变规律”,“归纳掌握主族金属元素的递变规律”和“归纳掌握主族非金属元素的递变规律”这几部分内容,是第四章第二节中总结性的知识点。通过学习这部分知识,学生对原子结构示意图,同周期主族元素性质的递变规律,主族金属元素的递变规律以及主族非金属元素的递变规律,进行归纳总结。通过本节内容的学习,学生将从归纳和总结、原子结构、同周期主族元素、主族金属元素和主族非金属元素等各方面的性质特点,感受探究化学元素不同的奇妙特性的方法,由此得到启发:可以通过元素周期律的特点对元素的化学性质进行分析,推测出新的化学元素以及元素的性质特点。
教学目标与核心素养
宏观辨识与微观探析:从宏观上学习并掌握元素周期表中元素的递变规律,从微观上辨析不同周期元素的性质递变规律,体会微观粒子的变化对宏观物质的性质的影响。
证据推理与模型认知:通过物质分类的基本模型,理解元素周期表中元素的相似点,通过结合理论与实际感知化学学习的魅力,为后续的化学知识的学习奠定坚实的方法基础。
科学探究与创新意识:熟悉原子同周期元素伴随原子序数变化产生的性质的递变规律,熟练掌握通过原子结构分析元素性质的能力,体会化学研究过程中的科学方法。
科学精神与社会责任:通过对元素原子结构的学习和理解,掌握更高效的学习方法,建立高效学习的科学精神。
重点
难点
归纳掌握原子结构示意图;归纳掌握同周期主族元素性质的递变规律;归纳掌握主族金属元素的递变规律;归纳掌握主族非金属元素的递变规律”。
教学过程
教学环节
教师活动
学生活动
设计意图
导入新课
通过对元素周期律的学习,我们发现了许多规律。那么今天,我们将对这些规律进行一个系统的归纳和整理。
讲授新课
第二节元素周期律
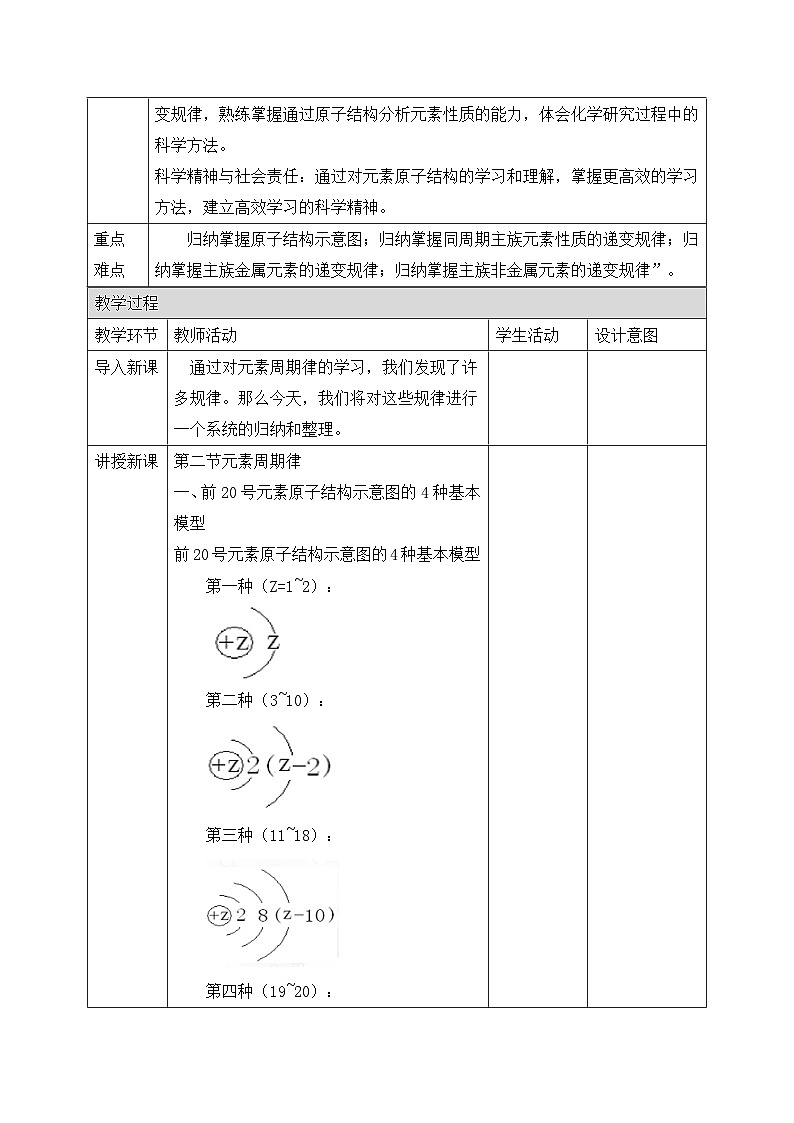
一、前20号元素原子结构示意图的4种基本模型
前20号元素原子结构示意图的4种基本模型
第一种(Z=1~2):
第二种(3~10):
第三种(11~18):
第四种(19~20):
同周期主族元素性质的递变规律
(1)核外电子排布:随着核电荷数增大,内层电子数不变,最外层电子数逐渐增多(除第一周期外,每一周期主族元素的最外层电子数都是从1个增加到7个)
同周期主族元素性质的递变规律
(2)原子半径:随着核电荷数的增大,原子半径逐渐减小。
同周期主族元素性质的递变规律
(3)最高正化合价:随着核电荷数增大,最高正化合价从+1到+7(氧、氟例外)
同周期主族元素性质的递变规律
(4)非金属元素的最低负价:随着核电荷数的增大,从第四主族到第七主族,化合价升高(从-4到-1)
同周期主族元素性质的递变规律
(5)金属性、非金属性:随着核电荷数增大,金属性越来越弱,非金属性越来越强
在第三周期的主族元素中,随着核电荷数依次增多,金属性逐渐降低,非金属性逐渐增强。
同周期主族元素性质的递变规律
(6)元素最高价氧化物对应的水化物的酸碱性:随着核电荷数增大,元素最高价氧化物对应的水化物,碱性越来越弱,酸性越来越强
有关元素周期表的认识
(1)元素周期表有多少横行就有多少周期,但不是有多少列就有多少族
(2)周期是电子层数相同的元素集合,族是性质相似的元素集合
(3)族是性质相似的元素集合,所以氦元素排在了0族,而不是ⅡA
(4)元素种类最多的族是ⅢB,其次是Ⅷ族。
(5)元素种类最少的周期是第一周期,元素种类最多的周期是第六周期
(6)如果原子序数为x的元素是的A元素,则原子序数为(x+1)的元素可能是ⅢA元素或ⅢB元素
主族金属元素的递变规律
箭头所指的方向:金属性增强、原子半径增大、最高价氧化物对应水化物的碱性增强
主族金属元素的递变规律
(1)同周期元素从右到左金属性增强,同主族元素从上到下金属性增强,所以金属性:左下角元素的大于右上角元素的。
(2)同周期元素从右到左原子半径增大,同主族元素从上到下原子半径增大,所以原子半径:左下角元素的大于右上角元素的。
(3)同周期元素从右到左最高价氧化物对应水化物的碱性增强,同主族元素从上到下最高价氧化物对应水化物的碱性增强,所以最高价氧化物对应水化物的碱性:左下角元素的大于右上角元素的。
(4)元素周期表中,金属性最强的元素是Cs,原子半径最大的元素是Cs,最高价氧化物对应的水化物的碱性最强的是Cs。
(5)短周期元素中,金属性最强的元素是Na,原子半径最大的元素是Na,最高价氧化物对应的水化物的碱性最强的是Na。
主族非金属元素的递变规律
箭头所指的方向:非金属性增强、原子半径减小、最高价氧化物对应水化物的酸性增强
主族非金属元素的递变规律
(1)同周期元素从左到右非金属性增强,同主族元素从下到上非金属性增强,所以非金属性:右上角元素的大于左下角元素的。
(2)同周期元素从左到右原子半径减小,同主族元素从下到上原子半径减小,所以原子半径:右上角元素的小于左下角元素的。
(3)同周期元素从左到右最高价氧化物对应水化物的酸性增强,同主族元素从下到上最高价氧化物对应水化物的酸性增强,所以最高价氧化物对应水化物的酸性:右上角元素的大于左下角元素的。
(4)元素周期表中,非金属性最强的元素是F,原子半径最小的元素是H,最高价氧化物对应的水化物的酸性最强的是Cl。
(5)短周期元素中,非金属性最强的元素是F,原子半径最小的元素是H,最高价氧化物对应的水化物的酸性最强的是Cl。
【练习】1、填空
元素周期表的第三周期元素,从左到右,原子半径逐渐_________;元素的金属性逐渐_________,非金属性逐渐_________。该周期元素中,最高价氧化物对应的水化物碱性最强的是_________(填元素符号,下同);最高价氧化物对应的水化物呈两性的是_________;最高价氧化物对应的水化物酸性最强的是_________。
元素周期表的第三周期元素,从左到右,原子半径逐渐减小;元素的金属性逐渐减弱,非金属性逐渐增强。该周期元素中,最高价氧化物对应的水化物碱性最强的是Na(NaOH>Mg(OH)2>Al(OH)3);最高价氧化物对应的水化物呈两性的是Al(Al(OH)3);最高价氧化物对应的水化物酸性最强的是Cl(HClO4>H2SO4>H3PO4)
【练习】2.比较下列各组元素中金属性或非金属性的强弱
(1)Na、K;(2)B、Al;(3)P、Cl;(4)S、Cl;(5)O、S.
(1)Na、K处于同主族,同主族自上而下金属性增强,则金属性:Na<K,故答案为:金属性Na<K;(2)B、Al处于同主族,同主族自上而下金属性增强,则金属性:B<Al,故答案为:金属性B<Al;(3)P、Cl处于同周期,同周期自左而右非金属性增强,则非金属性:P<Cl,故答案为:非金属性P<Cl;(4)S、Cl处于同周期,同周期自左而右非金属性增强,则非金属性:S<Cl,故答案为:非金属性S<Cl;(5)O、S处于同一主族,同主族元素的非金属性逐渐减弱,则非金属性:O>S,故答案为:非金属性O>S。
【练习】3.根据元素在周期表中的位置,判断下列各组化合物的水溶液的酸、碱性的强弱.
(1)H3PO4和HNO3酸性____________
(2)KOH和Mg(OH)2碱性____________
(3)Al(OH)3和Ca(OH)2碱性____________
(1)N和P在同一主族,P在N元素的下一周期,同一主族元素从上到下元素的非金属性逐渐减弱,则非金属性N>P,非金属性越强,则对应的最高价氧化物的水合物的酸性越强,所以:酸性H3PO4<HNO3,故答案为:H3PO4<HNO3;
(2)K位于第四周期第ⅠA族,Mg位于第三周期第ⅡA族,同一主族元素从上到下元素的金属性逐渐增强,同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱,则金属性K>Mg,所以碱性KOH>Mg(OH)2,故答案为:KOH>Mg(OH)2;
(3)Ca位于第四周期第IIA族,Al位于第三周期IIIA族,同一主族元素从上到下元素的金属性逐渐增强,同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱,则金属性Ca>Al,所以碱性Al(OH)3<Ca(OH)2,故答案为:Al(OH)3<Ca(OH)2。
课堂小结
板书
1.有关元素周期表的认识
2.主族金属元素的递变规律
3.主族非金属元素的递变规律
相关教案
这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律第2课时教案设计,共3页。
这是一份人教版 (2019)必修 第一册第二节 元素周期律第1课时教学设计,共5页。教案主要包含了复习引入,实验演示等内容,欢迎下载使用。
这是一份化学必修 第一册第二节 元素周期律第2课时教案,共3页。