

高中化学人教版 (2019)选择性必修1第一节 化学反应速率教案
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率教案,共9页。
教学目标
能用一定的理论模型说明外界条件改变对反应速率的影响。
教学环节
情境导引
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么理解这些反应速率不同?
任务1:如何从微观角度理解化学反应机理?
问题1:什么是反应历程?
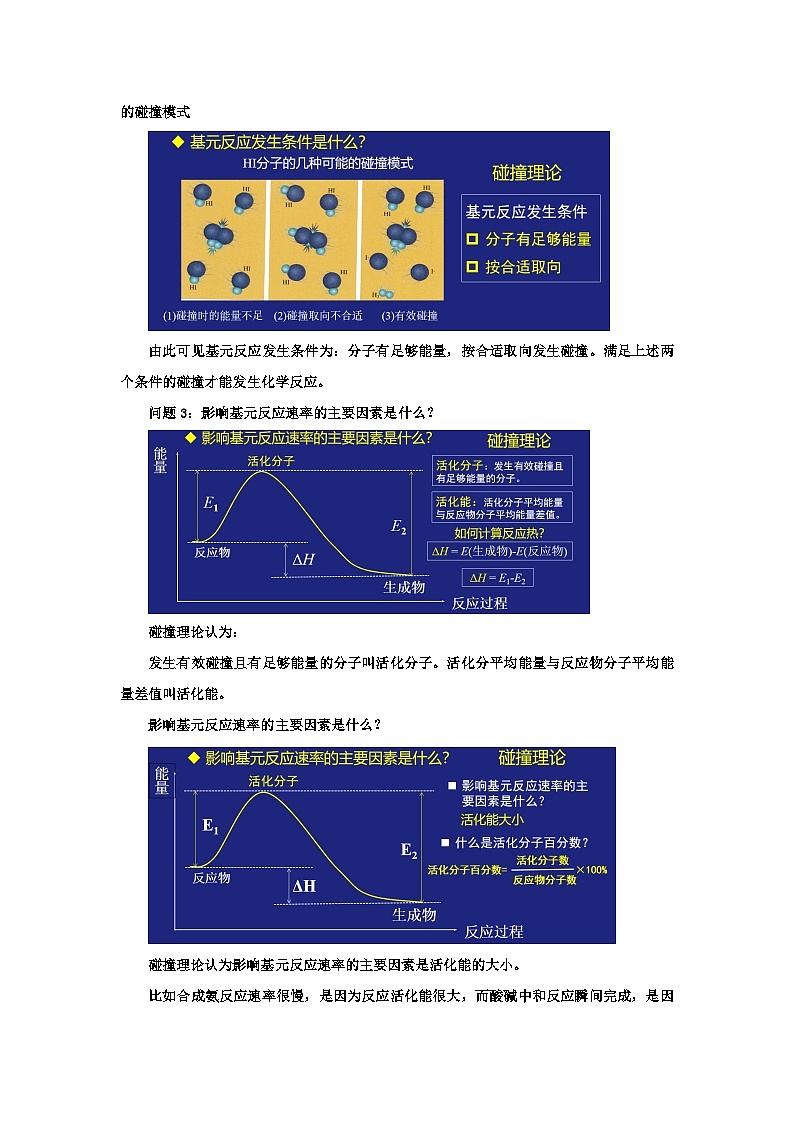
问题2:基元反应发生条件是什么?
我们把能够发生化学反应的碰撞叫做有效碰撞。这样的理论在化学上称之为碰撞理论。
为什么分子碰撞时有的能发生化学反应,有的不能呢?这幅图片是HI分子的几种可能的碰撞模式
由此可见基元反应发生条件为:分子有足够能量,按合适取向发生碰撞。满足上述两个条件的碰撞才能发生化学反应。
问题3:影响基元反应速率的主要因素是什么?
碰撞理论认为:
发生有效碰撞且有足够能量的分子叫活化分子。活化分平均能量与反应物分子平均能量差值叫活化能。
影响基元反应速率的主要因素是什么?
碰撞理论认为影响基元反应速率的主要因素是活化能的大小。
比如合成氨反应速率很慢,是因为反应活化能很大,而酸碱中和反应瞬间完成,是因为该反应的活化能非常小。
活化分子在反应物分子中占有一定的百分比,这个数叫活化分子百分数。
在必修教材的学习中我们已经知道,影响反应速率的因素有浓度、压强、温度、催化剂等外界条件,下面我们就从微观角度逐一分析。
任务2:从微观角度理解浓度是如何对化学反应速率产生影响?
任务2:从微观角度理解压强是如何对化学反应速率产生影响的呢?
许多化学反应物都是以气态组分的形式参与反应的,而气体很容易受到压强变化的影响,下面我们继续研究压强对反应速率的影响。
对气体来说,若其他条件不变,增大压强,就是增加反应物各气体物质的浓度。
请同学们思考:恒温恒容通入惰性气体反应速率如何变化?
请同学们思考:恒温恒压通入惰性气体反应速率如何变化?
请同学们思考:反应体系均为固态或液态,改变压强对反应速率有何影响?
由于固体或液体的浓度不变,因此增大压强时,单位体积活化分子数不变,单位时间有效碰撞次数不变,化学反应速率不变。
由此我们可以得出以下结论: 压强改变的实质:是对反应物各气体物质浓度产生了影响,而引起反应速率发生变化。
任务3:从微观角度理解温度是如何对化学反应速率产生影响的呢?
任务4:从微观角度理解催化剂是如何对化学反应速率产生影响的呢?
目前,科学家普遍认为,催化剂之所以能改变化学反应速率,是因为它能改变反应历程,改变反应的活化能。图中实线和虚线分别表示无催化剂和有催化剂的反应过程中,反应物及生成物的能量与活化能的关系。很显然,有催化剂时反应的活化能降低了很多。 这就使得更多的反应物分子成为活化分子,增大了单位体积内反应物分子中活化分子的数目,从而增大了化学反应速率。
通过之前的学习,我们知道
下面我们来看一道例题
我们知道,把这①②两步反应相加会得到总反应。本题已知总反应和第①步反应,所以用总反应-第①步反应,就是第②步反应。
同学们思考以下三个问题
我们知道,催化剂参与反应,改变反应历程,但反应前后质量和化学性质不变。则反应机理和总反应可知:I-是①步反应物,是第②步生成物,相加时消耗掉,所以I-做为催化剂,而IO-做为第①步生成物,第②步反应物,相加时消耗掉,所以IO-做为中间产物。
既然I-参与化学反应且做为第①步反应物,当然其浓度会影响反应速率。
要想画出反应过程中的能量变化图像,首先解决两个问题,一是判断反应热大小,可根据反应物和生成物总能量来确定,二是判断活化能大小,可根据反应的快慢来确定。
本题已知总反应和分反应的反应热,如何确定第①步第②步活化能大小呢?
根据题给条件,第①步是慢反应,所以活化能大。
解答本题的基本思路是
课堂小结
通过以上分析我们可知,无论是增大浓度或加压,还是升高温度或使用催化剂,均能提高单位体积活化分子数增多,使得单位时间有效碰撞次数增多,从而实现反应速率加快。而二者之间的不同点在于,增大浓度或加压,单位体积分子总数增多 (活化分子百分数不变);而升高温度或使用催化剂,单位体积分子总数不变 (活化分子百分数增大)。
反馈与评价
布置作业
1.阅读教材相关内容,整理笔记
2.完成教材28-29页 第6题
最后以道尔顿一句话与同学们共勉
一些人能获得更多的成就,是由于他们对问题比起一般人能够更加专注和坚持。
——道尔顿
相关教案
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率教案,共2页。教案主要包含了教学设计框架等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率第2课时教案及反思,共7页。
这是一份人教版 (2019)选择性必修1第一节 化学反应速率教学设计,共10页。










