





高中化学人教版 (2019)选择性必修1第一节 化学反应速率背景图ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率背景图ppt课件,共32页。PPT课件主要包含了定义化学反应速率,实验原理,实验用品,简单碰撞理论,基元反应,反应历程反应机理,反应历程又称反应机理,有效碰撞,活化能和活化分子,E1表示反应的活化能等内容,欢迎下载使用。
第二课时 影响化学反应速率的因素
本着对生产生活最有利的原则,我们总是想加快有利的化学反应速率,减慢有害的化学反应的速率。
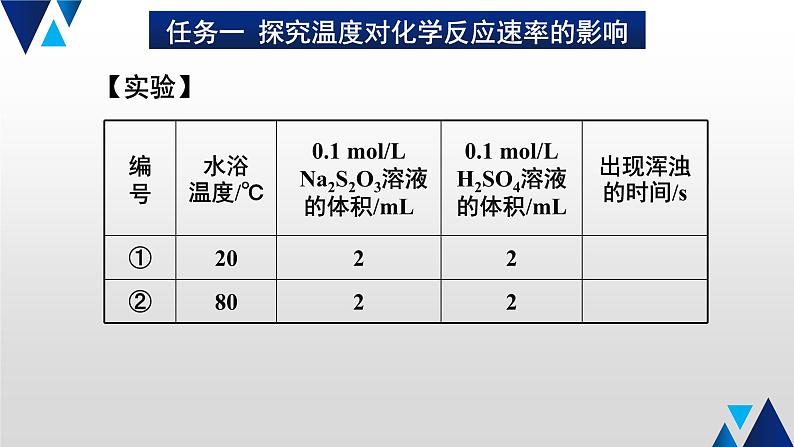
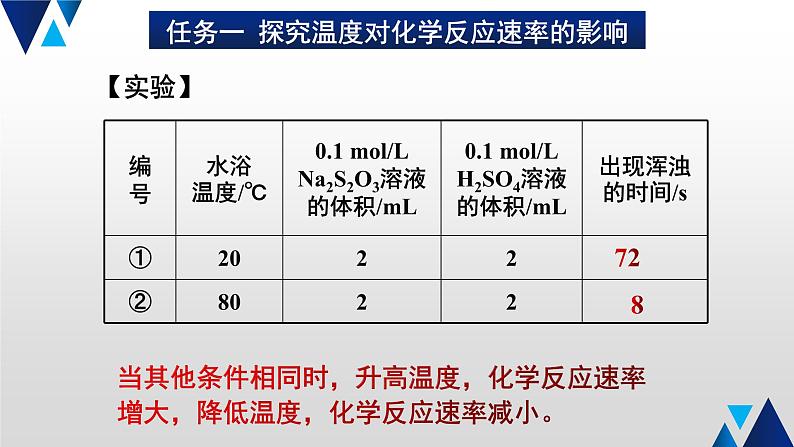
任务一 探究温度对化学反应速率的影响
0.1 ml/L Na2S2O3 溶液、0.1 ml/L H2SO4 溶液、20 ℃水、 70 ℃热水、试管、烧杯等。
当其他条件相同时,升高温度,化学反应速率增大,降低温度,化学反应速率减小。
②反应若是可逆反应,升高温度,正、逆反应速率都加快,只是加快的程度不一样
③实验测定,温度每升高10K,化学反应速率通常增大到原来2~4倍
①无论吸热反应、还是放热反应,升高温度,速率都加快,只是加快的程度不一样
1918年,路易斯提出了化学反应速率的简单碰撞理论。该理论认为,反应物分子间的碰撞是化学反应的先决条件。反应物分子间有效碰撞的频率越高,化学反应速率越大。
思考:如何解释温度对化学反应速率的影响呢?
基元反应:通过碰撞一步直接转化为产物的反应。例如:NO2 + CO NO + CO2
更多的化学反应过程分为多步进行例如: 2HI H2 + I2 第一步: 2HI → 2I• + H2 第二步: 2I• → I2
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI=H2+I2的反应历程。
基元反应发生的先决条件是反应物的分子必须发生碰撞。
以气体的反应为例,任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为1ml/L时,在每立方厘米、每秒内反应物分子的碰撞可达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,反应只需10-5就可以完成。任何气体的反应均可瞬间完成。但实际并非如此。这就说明并不是反应物分子的每一次碰撞都能发生反应。我们把能够发生化学反应的碰撞叫做有效碰撞。
任务二 : 简单碰撞理论解释温度对化学反应速率的影响
其他条件相同时,升高温度
单位体积内活化分子百分数增多
发生有效碰撞的分子必须具有足够的能量,这种分子叫做活化分子。
E2表示活化分子变成生成物分子放出的能量
活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
E反应物:反应物分子的平均能量
E生成物:生成物分子的平均能量
E1-E2表示反应热ΔH
任务三 探究浓度对化学反应速率的影响
变量: Na2S2O3或H2SO4浓度
控制变量:其他组分浓度、温度等
选取观测量:溶液达到相同浑浊度的过程中,浑浊度随时间的变化
还可以用浊度计进行实验。浊度计:用于测量溶液浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
其他条件相同时,增大反应物浓度
单位体积内活化分子百分数不变
任务四 简单碰撞理论解释浓度对化学反应速率的影响
式中υ是反应速率;a、b分别是反应物A和B浓度的幂指数,它们的数值是通过化学实验测得的,与化学方程式的计量数无关;k为速率常数,其值与温度有关。
增大反应物浓度可以增大反应速率,但是到底能增大多少呢?二者之间的关系能否用数学表达式表示呢?就像y=kx
对一个化学反应mA(g)+nB(g)=pC(g)+qD(g),经过研究发现,其反应速率和反应物浓度有如下关系,称为“速率方程”:υ=k.ca(A).cb(B)
根据下表数据,建立反应2H2+2NO=2H2O+N2的速率方程。并讨论H2浓度或NO浓度对反应速率的影响,谁更显著?
分析:设该反应的速率方程为:υ=k.Ca(H2).Cb(NO)
根据1、2组实验可知,仅改变H2浓度:
根据3、4组实验可知,仅改变NO浓度:
υ=k. c (H 2). c 2 (NO)
相对于H2,NO浓度对反应速率的影响更显著
催化剂对H2O2分解化学反应速率的影响
较高浓度的H2O2在避光条件下的分解速率
任务五 简单碰撞理论解释催化剂对化学反应速率的影响
①没特别指明一般指正催化剂
在其它条件不变时,使用适当催化剂可较大程度地加快反应速率
③使用催化剂同等程度的增大正逆反应速率,从而改变反应到达平衡所需
⑤催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒
②催化剂只能催化可能发生的反应,对不发生的反应无作用
④催化剂具有一定的选择性
催化剂对化学反应速率的影响
其他条件相同时,使用催化剂
问题: 为什么催化剂对化学反应速率有显著影响?
未使用催化剂时:反应A+B=AB的活化能为Ea
使用催化剂K后:反应分两步(历程改变)第一步:A+K=AK, 活化能为Eal
K是催化剂,前后质量不变;AK是中间产物
第二步:AK+B=AB+K 活化能为Ea2总反应:A+B=AB
这两个分步反应的活化能都比原来的Ea要小,因此反应速率加快。
又因为Ea1>Ea2,所以第一步是慢反应,第二步是快反应。而整个反应的速率是由慢反应决定的,也叫“决速步骤”。所以第一步的活化能Eal就是在催化剂条件下,整个反应的活化能。
单位时间内、单位体积内有效碰撞次数增多
单位体积内活化分子数增大
小结:简单碰撞理论解释反应条件对化学反应速率的影响
1.下列说法正确的是( ) A、一定条件下,增大反应物的量会加快化学反应速率。 B、增大压强,肯定会加快化学反应速率。 C、活化分子间所发生的碰撞为有效碰撞。 D、能够发生有效碰撞的分子叫活化分子。
2.在500℃时,2SO2+O2 2SO3正向是放热反应体系,只改变下列条件,请把影响结果填入下表。(填写“增大”“减小”“不变”)
相关课件
这是一份选择性必修1第一节 化学反应速率教学演示ppt课件,共28页。PPT课件主要包含了化学反应速率的定义,实验探究,实验现象,实验结论,外因外界条件,内因反应物的性质,科学探究实验2-5,较慢产生气泡,冷水中,较快产生气泡等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率评课ppt课件,共27页。PPT课件主要包含了课程目标,催化剂,表面积,压强等,---浓度,实验探究,☂名师点拨,---温度,---催化剂,---压强等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 化学反应速率备课课件ppt,共18页。PPT课件主要包含了新课导入,I·→I2,有效碰撞理论,自由基,分两步,思考时间,实际并非如此,看看下图找找原因,有效碰撞,活化分子等内容,欢迎下载使用。










