
人教版 (2019)选择性必修1第一节 化学反应速率随堂练习题
展开
这是一份人教版 (2019)选择性必修1第一节 化学反应速率随堂练习题,共19页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
一、选择题(本题共16小题,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.对于可逆反应3H2+N22NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.充入更多N2
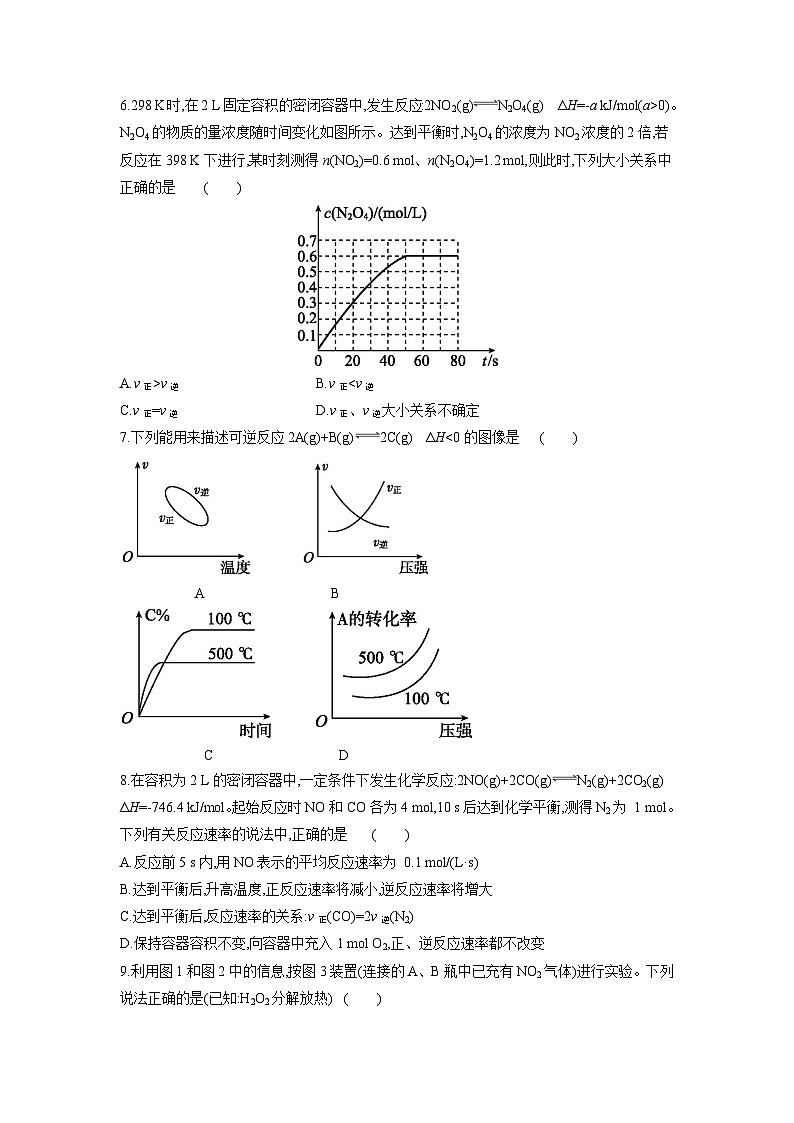
C.使用高效催化剂 D.降低温度
2.反应C2H6(g)C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷的平衡转化率的是( )
A.增大容器容积
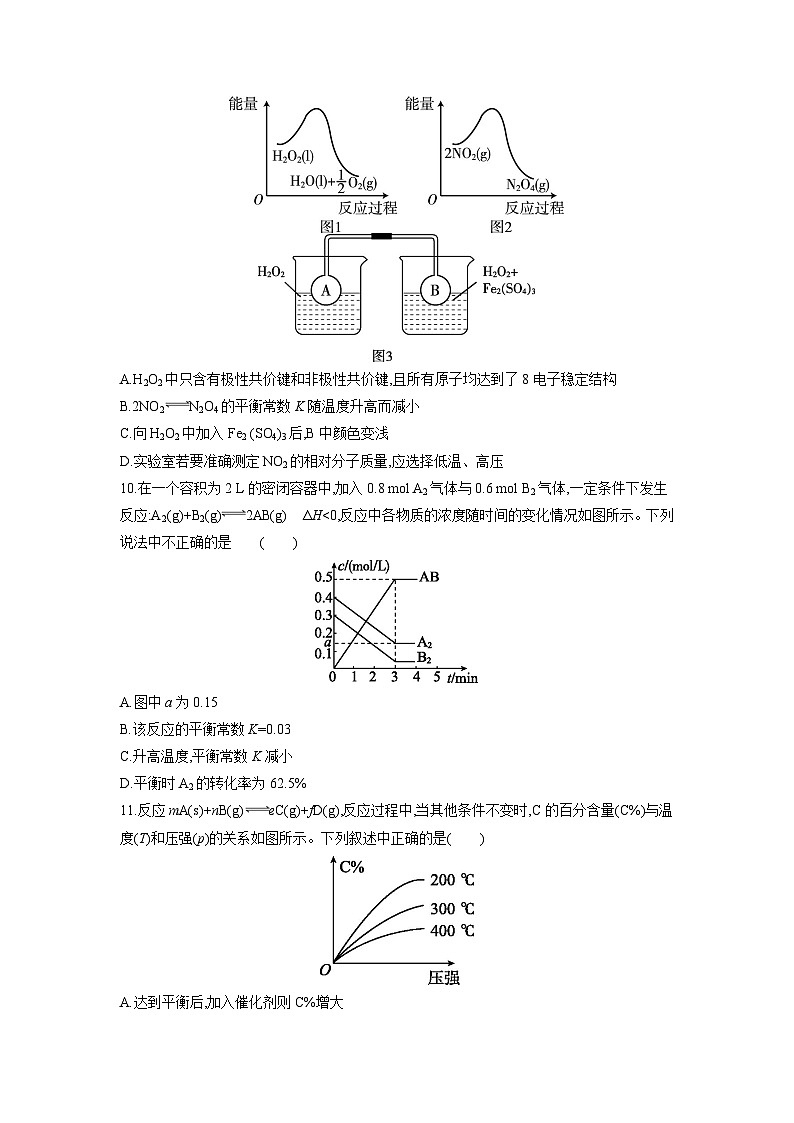
B.升高反应温度
C.分离出部分氢气
D.等容下通入稀有气体
3.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
A.K不变,平衡可能移动
B.K变化,平衡一定移动
C.平衡移动,K可能不变
D.平衡移动,K一定变化
4.金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)Sn(s)+2CO(g),反应过程中能量的变化如图所示。下列有关该反应的ΔH、ΔS的说法正确的是( )
A.ΔH0
5.下列说法中正确的是( )
A.2CaCO3(s)+2SO2(g)+O2(g)2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔHv逆 B.v正v逆
16.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法中不正确的是
A.反应2NO(g)+O2(g)2NO2(g)的ΔH2 000
二、非选择题(本题共4小题,共52分)
17.(9分)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
甲
乙
(1)X的化学式为 。
(2)改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是 (填图中字母,下空同);当横坐标为温度时,变化趋势正确的是 。
18.(14分)H2S、SO2、NO和CO都是常见的大气污染物。目前治理汽车尾气是在催化剂条件下发生反应2NO+2CON2+2CO2。实验室模拟上述反应,已知t℃时在2 L恒容密闭容器中加入2 ml NO与1 ml CO气体,经10 min达到平衡,测得此时CO2的体积分数为17。回答下列问题。
(1)这段时间内用CO表示的化学反应速率为 。
(2)该反应的平衡常数为 (结果精确至0.001)。
(3)平衡后再向密闭容器中通入0.4 ml CO和0.4 ml CO2,平衡将 (填“正向”“逆向”或“不”)移动。判断理由是 。
(4)若升温发现体系气体平均相对分子质量增大,则该反应的ΔH (填“>”“0。已知该反应在2 404 ℃时的平衡常数K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2 L密闭容器中充入N2与O2各1 ml,平衡时N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为0.25 ml/L、4.0×10-2 ml/L、3.0×10-3 ml/L,此时反应 (填“处于化学平衡状态”“正向进行”或“逆向进行”)。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是 (填字母)。
A B C
(5)向恒温恒容的密闭容器中充入等物质的量的N2与O2,达到平衡状态后再向其中充入一定量NO, 重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大”“变小”或“不变”)。
20.(14分)环戊二烯()是重要的有机化工原料,广泛应用于农药、橡胶、塑料等生产。请回答下列问题。
(1)某温度下,等物质的量的碘与环戊烯()在刚性容器内发生反应:(g)+I2(g)(g)+2HI(g) ΔH>0。起始的总压强为105Pa,平衡时总压强比起始时总压强增加了20%,则环戊烯的转化率为 ,该反应的平衡常数Kp= 。达到平衡后,欲增大环戊烯的平衡转化率,可采取的措施有 (填字母)。
A.通入稀有气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(2)环戊二烯容易发生聚合反应生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法中正确的是 (填字母)。
A.T1>T2
B.M点的反应速率小于K点的反应速率
C.M点的正反应速率大于N点的逆反应速率
D.N点时二聚体的浓度为0.45 ml/L
参考答案
一、选择题(本题共16小题,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.对于可逆反应3H2+N22NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.充入更多N2
C.使用高效催化剂 D.降低温度
解析:增大压强,活化分子百分数、平衡常数都不变,故A项错误;充入更多N2,活化分子百分数、平衡常数都不变,故B项错误;使用高效催化剂,平衡常数不变,故C项错误;降低温度,反应物中活化分子百分数、化学反应速率都减小,且化学平衡常数发生变化,故D项正确。
答案:D
2.反应C2H6(g)C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷的平衡转化率的是( )
A.增大容器容积
B.升高反应温度
C.分离出部分氢气
D.等容下通入稀有气体
解析:该反应的正反应是气体体积增大的吸热反应,增大反应容器的容积,体系的压强减小,化学平衡正向移动,能提高乙烷的平衡转化率,A项不符合题意;该反应的正反应是气体体积增大的吸热反应,升高温度,化学平衡正向移动,可提高乙烷的平衡转化率,B项不符合题意;分离出部分氢气,减小了生成物浓度,平衡正向移动,可提高乙烷的平衡转化率,C项不符合题意;等容下通入稀有气体,体系的总压强增大,但各物质的浓度不变,因此化学平衡不移动,对乙烷的平衡转化率无影响,D项符合题意。
答案:D
3.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
A.K不变,平衡可能移动
B.K变化,平衡一定移动
C.平衡移动,K可能不变
D.平衡移动,K一定变化
解析:平衡常数只与温度有关,温度不变,平衡也可能发生移动,则K不变,平衡可能移动,A项正确;K变化,说明反应的温度一定发生了变化,因此平衡一定移动,B项正确;平衡移动,温度可能不变,因此K可能不变,C项正确;平衡移动,温度可能不变,因此K不一定变化,D项错误。
答案:D
4.金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)Sn(s)+2CO(g),反应过程中能量的变化如图所示。下列有关该反应的ΔH、ΔS的说法正确的是( )
A.ΔH0
解析:SnO2(s)+2C(s)Sn(s)+2CO(g),该反应生成物气体化学计量数增大,混乱度增大,所以是熵增加的反应,故ΔS>0;从图中可知,反应物能量低,生成物能量高,该反应是吸热反应,故ΔH>0。
答案:D
5.下列说法中正确的是( )
A.2CaCO3(s)+2SO2(g)+O2(g)2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH
相关试卷
这是一份化学选择性必修1整理与复习单元测试当堂达标检测题,共23页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡第1课时课后作业题,共8页。试卷主要包含了2 ml·L-1、0等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率第1课时精练,共16页。试卷主要包含了对于反应,已知,把0等内容,欢迎下载使用。










