






高中化学人教版 (2019)选择性必修1第一节 化学反应速率复习课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率复习课件ppt,共25页。PPT课件主要包含了学业要求,等动定变,平衡常数K,反应方向,△G△H-T△S,化学反应的调控,化学反应,v逆都增大,正向移动或逆向移动,逆向移动或正向移动等内容,欢迎下载使用。
能从化学反应的方向、快慢、限度认识化学反应,丰富对化学反应认识的角度;形成化学变化是有条件的观念。认识反应条件对化学反应速率和化学平衡的影响。能从快慢、限度的角度调控反应条件,形成调控化学反应的思路。
发展运用变量控制思想设计、实施探究的能力。能利用实验探究影响反应速率和化学平衡的因素。能用数据、图表、符号等处理实验信息。能从方向、限度、快慢角度分析实验体系中的化学变化,丰富分析实验中“异常现象”的角度。
增强将化学反应原理应用于生产、生活的意识。提高理论联系实际的能力。能结合生产实际问题情境说明调控反应条件等的重要应用;能从调控反应速率、提高反应转化率等方面综合分析反应的条件。提出有效控制反应条件的措施;能综合节约成本、循环利用、保护环境等观念,设计、优化简单的工业流程。
1.能书写平衡常数表达式,能进行平衡常数、转化率的简单计算,能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动的方向。2.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化,能讨论化学反应条件的选择和优化。3.能进行化学反应速率的简单计算,能通过实验探究分析不同组分浓度改变对化学反应速率的影响,能用一定的理论模型说明外界条件改变对化学反应速率的影响。4.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、实验室中的实际问题,能讨论化学反应条件的选择和优化。5.针对典型案例,能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
一、化学反应的认识视角
化学反应往往经历多个基元反反应
同边异向,异边同向;变量不变
勒夏特列原理[ v(正)≠v(逆)、Q ≠ K ]
与反应的焓变、熵变有关
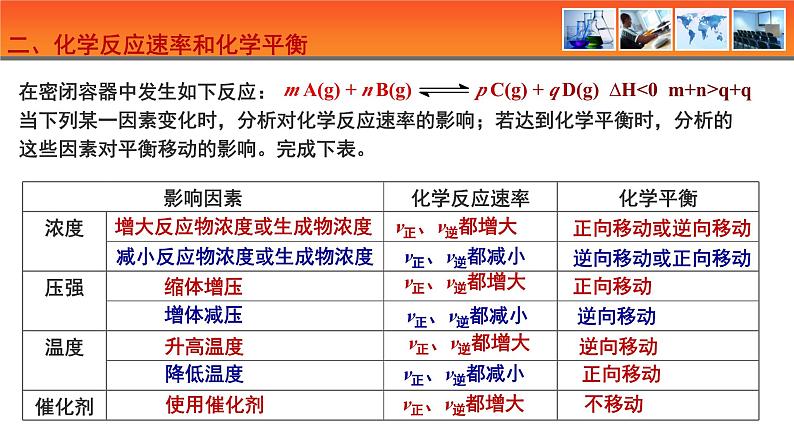
二、化学反应速率和化学平衡
增大反应物浓度或生成物浓度
减小反应物浓度或生成物浓度
x3(H2) •x (N2)
(一)用物质的量分数或分压强表示化学平衡常数的计算
1.物质的量分数(用x表示)表示的化学平衡常数Kx
始/ml变/ml平/ml
Kx:生成物物质的量分数的计量数幂之积除以反应物物质的分数的计量数幂之积。
2.气体的分压强(用p表示)表示的化学平衡常数Kp(己知p分=p总×物质的量分数)
例2 在500 ℃ 时,将N2、H2按1:3的体积比充入容积不变的密闭容器中,测得此时容器中的压强为10kPa,一段时间后达到平衡,测得平衡时容器中压强为6kPa。试求该反应500 ℃ 时用气体分压强表示的平衡常数Kp。
设起始时N2物质的量为a,平衡时转化物物质量为y。
Kp:生成物分压强的计量数幂之积除以反应物分压强的计量数幂之积。
例3 加热N2O5时,发生下列两个分解反应: N2O5 N2O3+O2 , N2O3 N2O+O2;在1L密闭容器中加热4ml N2O5达到化学平衡时O2的浓度为4.50 ml/L, N2O3的浓度为1.62 ml/L,求其他各物质的平衡浓度。
解析:这是一个连续平衡的计算,计算思路为:第一个反应的平衡量作为第二个反应的 起始量。
x – y = 1.62
x +y = 4.50
x = 3.06 ml
y = 1.44ml
故:c (N2O5)= (4 – 3.06) ml / 1L=0.94 ml/L
c (N2O ) = 1.44 ml / 1L=1.44 ml/L
A.往平衡体系中加入金属铅后,c(Pb2+)增大B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0D.25 ℃时,该反应的平衡常数K=2.2
2.可逆反应L(s)+aG(g) bR(g) ΔH 达到平衡时,温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强p1>p2。下列判断正确的是( )
A.1+a
相关课件
这是一份人教版 (2019)选择性必修1第一节 化学反应速率复习课件ppt,共60页。PPT课件主要包含了学习目标,整体框架,整理与提升,合成氨反应历程,合成氨反应方向,合成氨反应调控,再思考,化学平衡常数K,课堂小结,实战演练等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率复习ppt课件,共30页。PPT课件主要包含了知识网络,学习目标,②体积分数,知识要点等内容,欢迎下载使用。
这是一份选择性必修1第一节 化学反应速率复习ppt课件,共33页。PPT课件主要包含了学习目标,专题三等效平衡,课堂练习,课堂小结,课堂达标,8×10-3等内容,欢迎下载使用。










