


高中化学人教版 (2019)选择性必修1第一节 化学反应速率复习ppt课件
展开
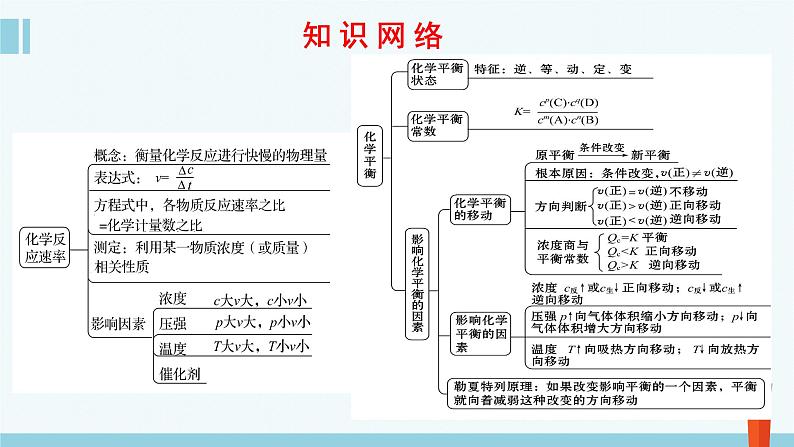
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率复习ppt课件,共30页。PPT课件主要包含了知识网络,学习目标,②体积分数,知识要点等内容,欢迎下载使用。
能书写平衡常数表达式,能进行平衡常数、转化率的简单计算,能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动的方向。
能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化,能思考化学反应条件的选择和优化
能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、实验室中的实际问题,能思考化学反应条件的选择和优化
针对典型案例,能从限度、速率等角度对化学反应和化工生产条件进行综合分析
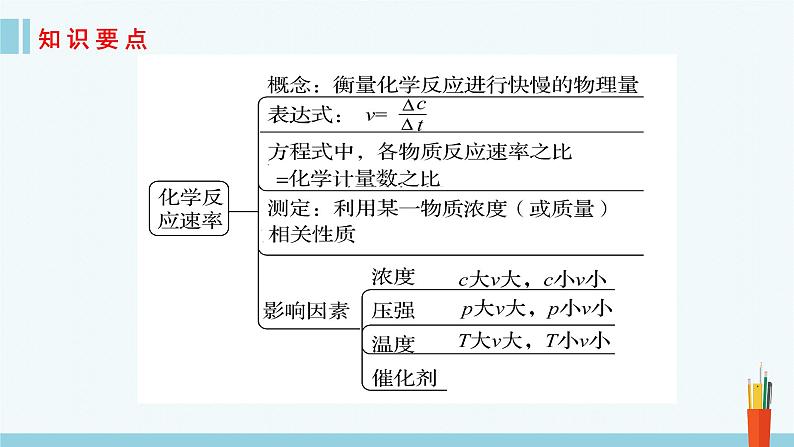
①反应方程式中各物质的化学计量数之比等于各物质的化学反应速率之比,等于变化的浓度之比,等于变化的物质的量之比。
②固体或纯液体(不是溶液),其浓度可视为常数, 因此一般不用固体或纯液体表示反应速率
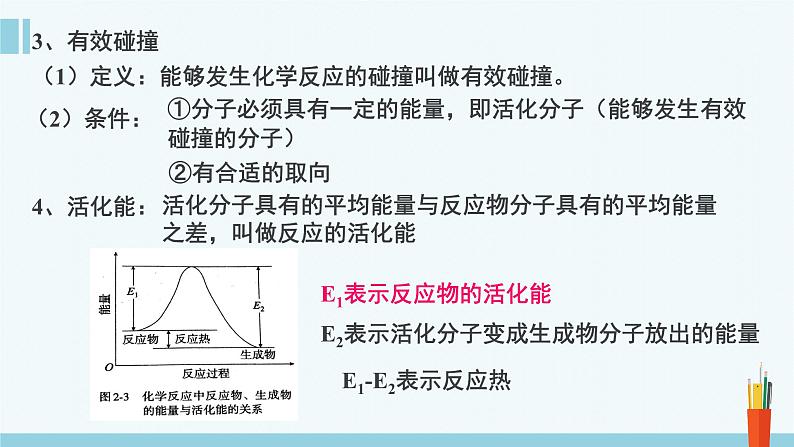
(1)定义:能够发生化学反应的碰撞叫做有效碰撞。
①分子必须具有一定的能量,即活化分子(能够发生有效碰撞的分子)
活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能
E1表示反应物的活化能
E2表示活化分子变成生成物分子放出的能量
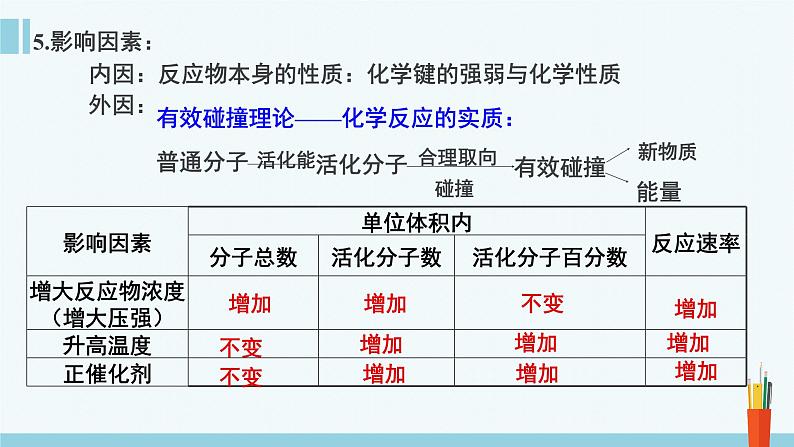
内因:反应物本身的性质:化学键的强弱与化学性质
有效碰撞理论——化学反应的实质:普通分子
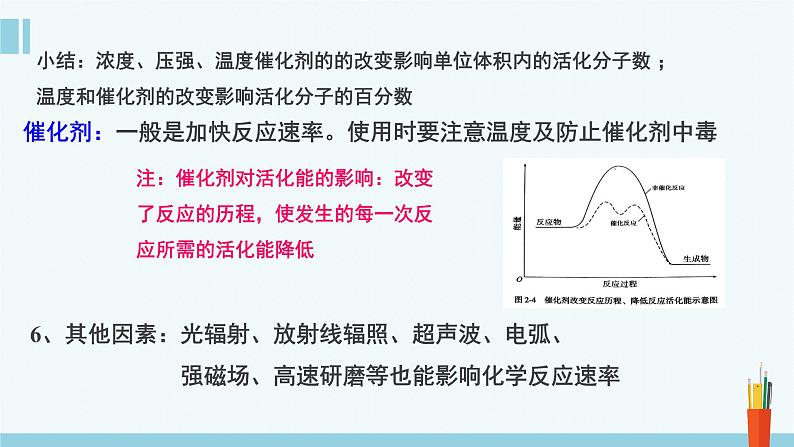
催化剂:一般是加快反应速率。使用时要注意温度及防止催化剂中毒
6、其他因素:光辐射、放射线辐照、超声波、电弧、 强磁场、高速研磨等也能影响化学反应速率
小结:浓度、压强、温度催化剂的的改变影响单位体积内的活化分子数 ; 温度和催化剂的改变影响活化分子的百分数
注:催化剂对活化能的影响:改变了反应的历程,使发生的每一次反应所需的活化能降低
[易错警示] 判断化学平衡时要规避“2”个易失分点(1)化学平衡状态判断“三关注”关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
[解析] 颜色加深平衡向左移动,所以正反应为放热反应,A错误;首先假设平衡不移动,加压颜色加深,但平衡向右移动,使混合气体颜色在加深后的基础上变浅,但一定比原平衡的颜色深,B错误;同理C选项,首先假设平衡不移动,若体积减小一半,压强为原来的两倍,但平衡向右移动,使压强在原平衡2倍的基础上减小,C正确;D选项体积不变,反应物及生成物浓度不变,所以正、逆反应速率均不变,平衡不移动,颜色无变化,D错误。
[归纳小结] 化学平衡移动方向的判断方法1.根据勒夏特列原理判断如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。2.根据v正、v逆的相对大小判断(1)若v正>v逆,则平衡向正反应方向移动(注意v正增大,平衡不一定向正反应方向移动);(2)若v正Q,则平衡向正反应方向移动;(2)若K0.9,以反应向逆反应方向进行。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 ml·L-1,c(H2)为1.5 ml·L-1,c(CO)为1 ml·L-1,c(H2O)为3 ml·L-1,则下一时刻,反应向哪个方向进行?
小结:“大大高温,小小低温”
[典例5]氨是化肥工业和基本有机化工的主要原料。用氨可加工成硝酸,现代化学工业中,常将硝酸生产归属于合成氨工业范畴。合成氨工业在20世纪初期形成,开始用氨作炸药工业的原料,为战争服务;第一次世界大战结束后,转向为农业、工业服务。合成氨的反应如下:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·ml-1,ΔS=-198.2 J·K-1·ml-1。
1.化学反应方向的判断(1)由化学方程式可判断,反应的熵变是增加的还是减小的?根据熵变判断反应是否自发?
提示:反应是气体系数减小的反应,所以反应的熵变ΔS<0,大部分熵减小的反应不自发,所以从熵变来看反应不自发。
(2)如果合成氨反应常温下能自发,根据(1)的分析判断,反应为什么能自发?
提示:熵变不能自发,所以只能从焓变上看自发,即反应的ΔH<0,且焓变起决定性作用。
相关课件
这是一份人教版 (2019)选择性必修1第一节 化学反应速率复习课件ppt,共60页。PPT课件主要包含了学习目标,整体框架,整理与提升,合成氨反应历程,合成氨反应方向,合成氨反应调控,再思考,化学平衡常数K,课堂小结,实战演练等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率复习课件ppt,共25页。PPT课件主要包含了学业要求,等动定变,平衡常数K,反应方向,△G△H-T△S,化学反应的调控,化学反应,v逆都增大,正向移动或逆向移动,逆向移动或正向移动等内容,欢迎下载使用。
这是一份选择性必修1第一节 化学反应速率复习ppt课件,共33页。PPT课件主要包含了学习目标,专题三等效平衡,课堂练习,课堂小结,课堂达标,8×10-3等内容,欢迎下载使用。










