



人教版 (2019)选择性必修1第二节 水的电离和溶液的pH课文ppt课件
展开
这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH课文ppt课件,共31页。PPT课件主要包含了水的电离,总结归纳,精确测定pH,课后作业等内容,欢迎下载使用。
1. 能认识水的电离特征,用水的离子积常数认识溶液的酸碱性。2. 能进行溶液 pH 的简单计算,了解测定溶液pH方法,能调控溶液的酸碱性。 3. 能选择实例说明溶液 pH 的调控在工农业生产和科学研究中的重要作用。
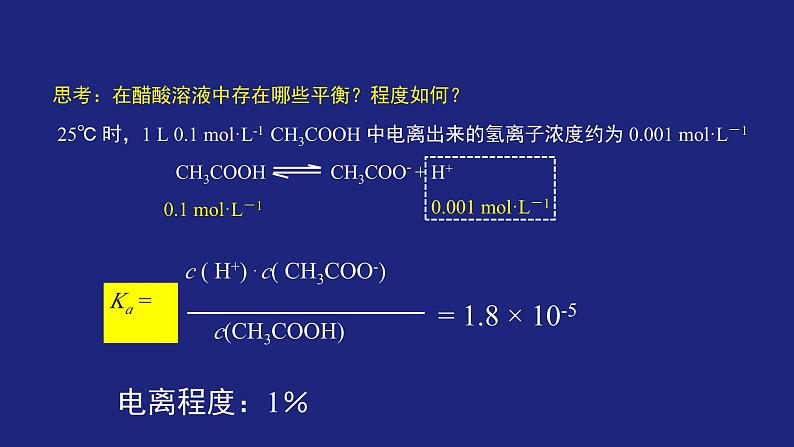
25℃ 时,1 L 0.1 ml·L-1 CH3COOH 中电离出来的氢离子浓度约为 0.001 ml·L-1
0.001 ml·L-1
思考:在醋酸溶液中存在哪些平衡?程度如何?
电离程度:1%
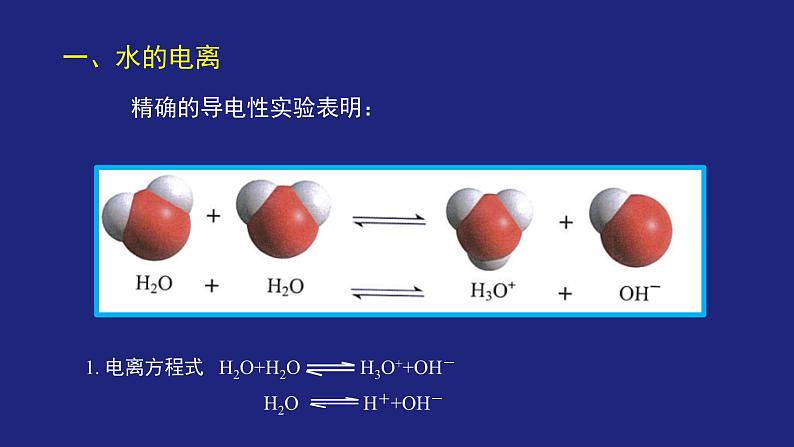
精确的导电性实验表明:
实验数据:25℃ 时 1 L 水约等于 55.6 ml 约有 10-7 ml H2O 分子发生电离
(3)c(H+)水=c(OH-)水
K 电离=
c(H+)×c(OH-)
c(H+) .c(OH-)
K电离 .c(H2O) =
已知 25℃ 时,1 L 纯水电离出的 n(H+) = n(OH-) = 1×10-7 ml则 Kw = c(H+)×c(OH-) = 1×10-14
符号 Kw,该数据可由实验测得也可以通过理论计算求得
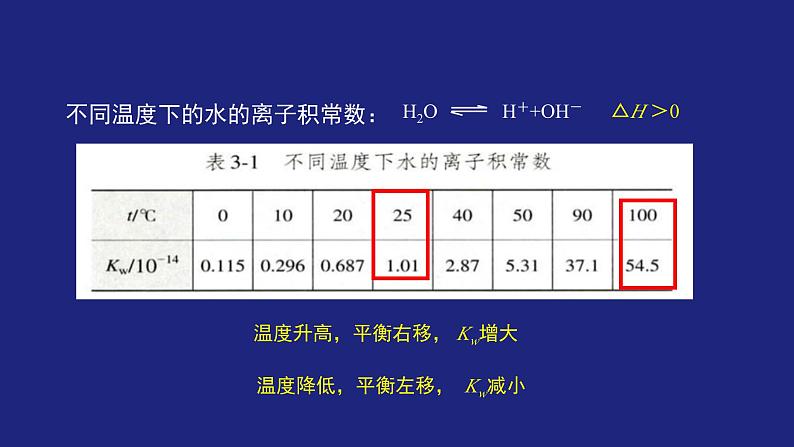
温度升高,平衡右移, Kw增大
不同温度下的水的离子积常数:
温度降低,平衡左移, Kw减小
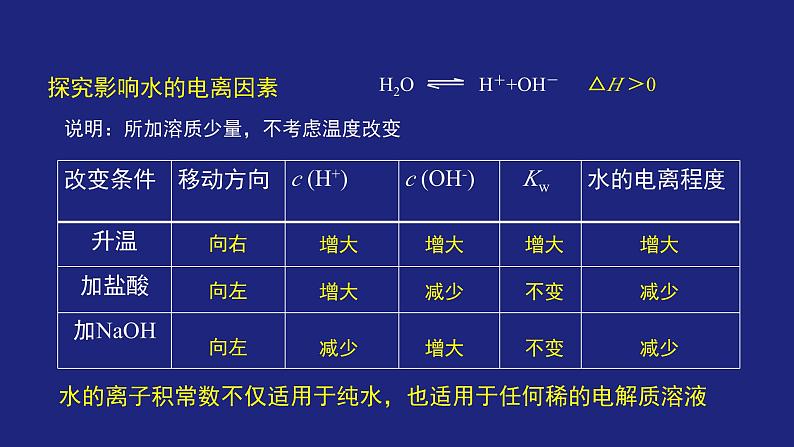
探究影响水的电离因素
水的离子积常数不仅适用于纯水,也适用于任何稀的电解质溶液
说明:所加溶质少量,不考虑温度改变
4.影响水的电离的因素
(1)升高温度,促进水的电离
(2)加酸或加碱都会抑制水的电离
(3)加入可以结合 H+或 OH-的物质(如某些盐), 会促进水的电离
思考:室温下,0.1 ml/L 的醋酸溶液,c(H+) = 0.001 ml/L 水电离的 c(H+)=___________
1.0×10-11 ml/L
c(H+)水 = c(OH-)水
溶液中c(H+)增大,抑制水的电离,使水电离出来的c(OH-)减小
≈ 0.001ml/L
Kw = c(H+)×c(OH-) = 1×10-14
课堂练习: 已知:100℃ Kw ≈ 1 × 10-12在 100 ℃ 时,纯水中 c(H+) 为多少?显中性还是酸性或碱性?
注意:不能仅用c(H+) 多少来判断溶液酸碱性, 要通过 c(H+) 和 c(OH-) 两者相对大小比较。
Kw = c(H+)×c(OH-) ≈ 1×10-12
c(H+)水 = c(OH-)水
≈1×10-6 ml/L
二 、溶液的酸碱性与 pH
碱性溶液: c(H+) < c(OH-)
酸性溶液: c(H+) > c(OH-)
中性溶液: c(H+) = c(OH-)
判断溶液的酸碱性的依据: 溶液中 c(H+) 与 c(OH-) 的相对大小
pH = 2.7 可乐
pH =7.4 弱碱性水
25℃ 溶液的 pH
pH=12 的NaOH溶液
1. 定义:化学上常采用溶液中c(H+)的负对数来表示溶液的酸碱性
2. 表示方法:pH = -lg c(H+)
c(H+) 为 0.001 ml/L 的盐酸,pH=?
c(H+) 为 0.01 ml/L 的盐酸,pH=?
c(H+) 为 0.1 ml/L 的盐酸,pH=?
c(H+) 为 1 ml/L 的盐酸,pH=?
c(H+) 为 2 ml/L 的盐酸,pH=?
c(H+) = 10-pH ml/L
pH 每减小一个单位,c(H+) 扩大 10 倍
pH 可以等于 0 ,也可以是负数、小数
浓度小于 1 ml/L 的稀溶液用 pH 表示比较方便
思考:通过观察上述数据,可以得到什么结论?
试计算常温下: ① 0.005 ml/L H2SO4溶液的pH ② 0.005 ml/L Ba(OH)2 溶液的pH ③ 将上面①②二溶液等体混合充分反应后的pH
c (H+) = 0.005ml/L×2= 0.01ml/L
c(OH-)= 0.005×2 = 0.01 ml/L
c (H+) =Kw/c(OH-)=10 -12 ml/L pH = 12
c(H+) = c(OH-)
H2SO4 = 2H++ SO42-
Ba(OH)2 = 2OH-+Ba2+
pH = - lg 0.01 = 2
强酸强碱中和后溶液pH的计算
1. 若 n(H+) > n(OH-) 则酸剩余,计算混合溶液中剩余的c(H+), 再计算pH=-lg c(H+)
2. 若 n(H+)③
pH: ③>④>①>②
1.整理课堂笔记2.课后习题 P68 练习与应用第1-6题
不积跬步 无以至千里不积小流 无以成江海
水的电离虽微弱,但请大家相信:
相关课件
这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH授课ppt课件,共32页。PPT课件主要包含了PH的测定,溶液中pH的计算,思考与讨论,pH的测定等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH课前预习ppt课件,共22页。PPT课件主要包含了水的电离,影响平衡的因素,PH的计算,新课导入,水的导电性实验,简写为,OH-H2O,适用范围,思考与讨论,课堂小结等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH图片ppt课件,共27页。PPT课件主要包含了酸碱中和滴定原理,方法2酸碱指示剂,酸碱中和滴定视频演示,实验步骤,数据处理,课堂小结,课堂反馈,课后作业等内容,欢迎下载使用。










