





高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教案配套课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教案配套课件ppt,共23页。PPT课件主要包含了核心素养发展目标,H2O,H-O-H,纯水无色无味,水是良好的溶剂,水是弱电解质,pH=5,pH=8,实验测得pH<7,不发光等内容,欢迎下载使用。
变化观念与平衡思想:认识水的电离存在电离平衡,了解水的电离平衡的影响因素,知道水的离子积常数,会分析水的电离平衡移动。
水是生命之源,关于水你了解多少?
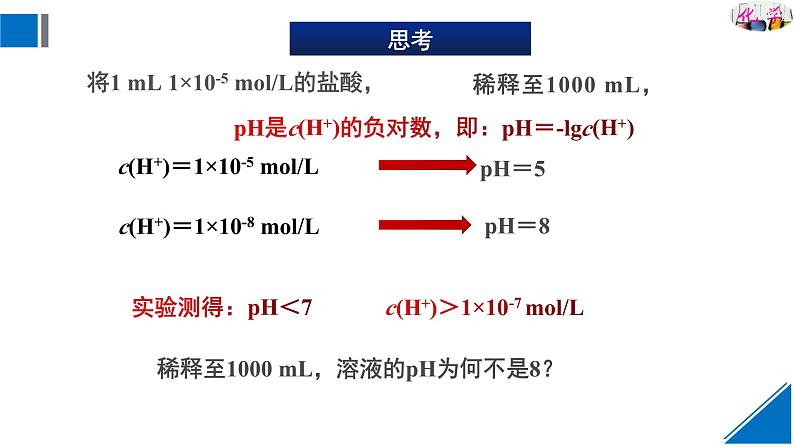
稀释至1000 mL,溶液的pH为何不是8?
pH是c(H+)的负对数,即:pH=-lgc(H+)
c(H+)>1×10-7 ml/L
将1 mL 1×10-5 ml/L的盐酸,
c(H+)=1×10-8 ml/L
c(H+)=1×10-5 ml/L
稀释至1000 mL,
1、纯水中究竟存在哪些微观粒子?
科学家通过纯水中导电实验现象发现:灯泡 ,
结论:水能发生电离,但电离不完全
2、如何通过实验证明这些粒子的存在?
把灯泡换成灵敏电流计时,发现电流计的指针 了。
任务一 寻找证明水的电离很微弱的证据
精确的电导性实验表明,纯水大部分以H2O分子的形式存在,但其中也存在着极少量的离子。
结论:纯水能发生微弱的电离
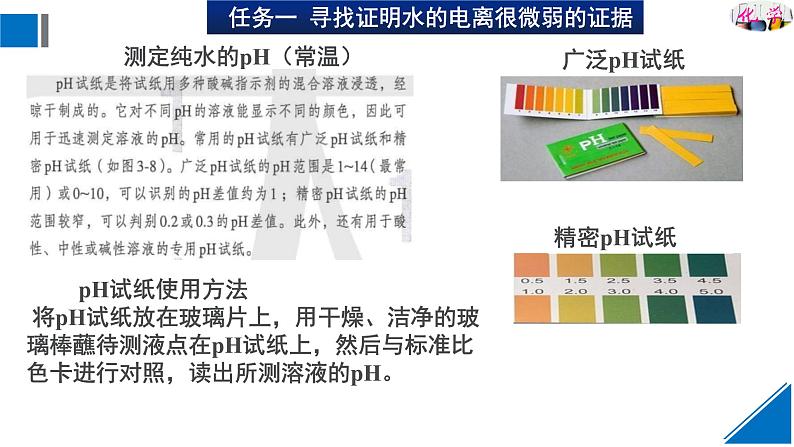
pH试纸使用方法 将pH试纸放在玻璃片上,用干燥、洁净的玻璃棒蘸待测液点在pH试纸上,然后与标准比色卡进行对照,读出所测溶液的pH。
测定纯水的pH(常温)
pH计,又叫酸度计。可用来精密测量溶液的pH,其量程为0~14。
用pH计测量溶液的pH
c(H+)=c(OH-)=1×10-7 ml/L
n(H2O)=55.6 ml
55.6 ml H2O中,只有1×10-7 ml发生电离
水电离出的H+、OH-浓度 相等
水是一种极弱的电解质,能发生微弱的电离。
现在我们来写出水的电离平衡常数。
室温下55.6mlH2O中,只有1×10-7mlH2O电离,电离的水可以忽略不计,因此c(H2O)可视为常数
KW=c(H+)·c(OH-)
Kw 叫做水的离子积常数,简称水的离子积。
常温时,c(H+)=c(OH-)=1×10-7 ml/L
常温时,KW=c(H+)·c(OH-)=1×10-14
H2O H+ + OH- NaOH Na+ + OH-
加入NaOH,瞬间溶液中c(OH-)增大水的电离平衡逆向移动c(H+)减小,pH增大
向水中逐渐加入少量NaOH固体,分别配制成 0.001 ml/L和0.1 ml/L NaOH溶液,测定两溶液的pH(常温)。
结论:向水中加入碱,c(OH-)增大,水的电离平衡逆向移动。
注:表中浓度单位均为ml/L
c(H+)、c(OH-)分别指溶液中总的H+浓度、总的OH-浓度
常温时,两溶液中c(H+)·c(OH-)相等,这是巧合吗?
≈c(OH-)NaOH
pH 11.0 11.7 12.0
pH 12.3 12.7 13.0
配制6种不同浓度NaOH溶液,用pH计测定溶液的pH
1×10-3 5×10-3 1×10-2 2×10-2 5×10-2 1×10-1
1×10-11 1×10-12 1×10-13
c(H+)·c(OH-)
【结论】常温时,稀NaOH溶液中c(H+)·c(OH-)为常数。
11.0 11.7 12.0 12.3 12.7 13.0
Kw= c(H+)·c(OH-)
常温下,KW =c(H+)·c(OH-)=1×10-14
(1)KW 不仅适用于纯水,也适用于稀的电解质水溶液
(2) c(H+)表示溶液中总的H+浓度, c(OH-)表示溶液中总的OH-浓度
结论:升高温度,水的电离平衡正向移动,Kw 增大。
用pH计测定不同温度下纯水的pH,计算Kw
【预测】升高温度,水的电离平衡正向移动。
Kw与温度有关,温度升高,Kw增大
外界条件对水的电离平衡的影响
(1)升高温度,若Kw增大到10-12,则纯水电离出的c(H+)=10-6 ml·L-1( )(2)在纯水中加入少量酸,水的电离平衡向逆向移动,Kw减小( )(3)25 ℃时,若溶液中c(H+)=1.0×10-6 ml·L-1,则溶液中c(OH-)=1.0×10-8ml·L-1( )(4)25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时水中的c(H+)>c(OH-)( )(5)25 ℃时,0.01 ml·L-1的盐酸中,由水电离出的c(OH-)=1.0×10-12 ml·L-1( )
2.常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 ml·L-1,该溶液可能是______。①二氧化硫的水溶液②氯化钠水溶液③硝酸钠水溶液④氢氧化钠水溶液
提示:某溶液中由水电离出来的c(H+)=1.0×10-11 ml·L-1,说明溶液既可能呈酸性,也可能呈碱性。
3.某温度下,纯水的c(H+)=2×10-7 ml·L-1,则此时纯水的c(OH-)为_______________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 ml·L-1,则溶液中c(OH-)为___________________,此时温度___________(填“高于”“低于”或“等于”)25 ℃。
2×10-7 ml·L-1
8×10-11 ml·L-1
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH图文ppt课件,共30页。PPT课件主要包含了回顾旧知,什么是弱电解质,思考一下,两者都有,水的电离,水的电离平衡,01molL,-12molL,随堂小练,3加入碱等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH集体备课ppt课件,共38页。PPT课件主要包含了什么是水的离子积,1温度,难点例析,学与问,小结一,溶液的酸碱性,cH+,pH的测定,pH的应用,学习评价等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH课前预习ppt课件,共22页。PPT课件主要包含了水的电离,影响平衡的因素,PH的计算,新课导入,水的导电性实验,简写为,OH-H2O,适用范围,思考与讨论,课堂小结等内容,欢迎下载使用。










