
人教版 (2019)选择性必修1第三节 盐类的水解第1课时教学设计
展开
这是一份人教版 (2019)选择性必修1第三节 盐类的水解第1课时教学设计,共4页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,从盐的构成上探究盐溶液呈现不同酸碱性的原因,总结其规律,形成宏观辨识与微观探析的能力。
2.熟练掌握盐类水解的表示方法——水解离子方程式的书写。
【教学重难点】
重点:盐类水解的概念、原理及规律
难点:理解盐类水解的原理
【教学过程】
1.新课导入
[复习巩固]什么是盐?什么是电离平衡?水溶液的酸碱性由什么决定?
2.新课讲授
[探究活动1]酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢?测定下列盐溶液的pH,实验探究一下。
实验步骤:分别用玻璃棒蘸取少量下列溶液,滴到pH试纸上,观察颜色变化,并与标准比色卡比较,得出溶液的酸碱性。
NaCl、FeCl3、K2SO4、(NH4)2SO4、Na2CO3、(NH4)2CO3、CH3COONa、CH3COONH4
[学生活动]分析实验结果,归纳其与盐的类型间的关系,并从电离平衡的角度寻找原因。
根据下表,对三类不同盐溶液中存在的各种粒子(不要忘记水及其电离)及粒子间的相互作用进行比较、分析,从中找出不同类盐溶液呈现不同酸碱性的原因。
[得出结论]盐溶液不一定都显中性,有的呈酸性,有的呈碱性。
[设疑]同样为盐溶液,却表现岀不同的酸碱性,说明在这六种溶液里H+和OHˉ的浓度分别呈何种关系呢?
[学生活动]学生分组讨论并回答:由于溶液呈现酸或碱性,因此溶液中H+和OHˉ的浓度不相等。
[追问]提问:CH3COONa、Na2CO3、NH4Cl、Al2(SO4)3在水溶液中既不能电离出OHˉ也不能电离出H+,而在任何物质的水溶液中由水电离出的H+和OHˉ的浓度总相等,那么是谁打破了这一等量关系呢?
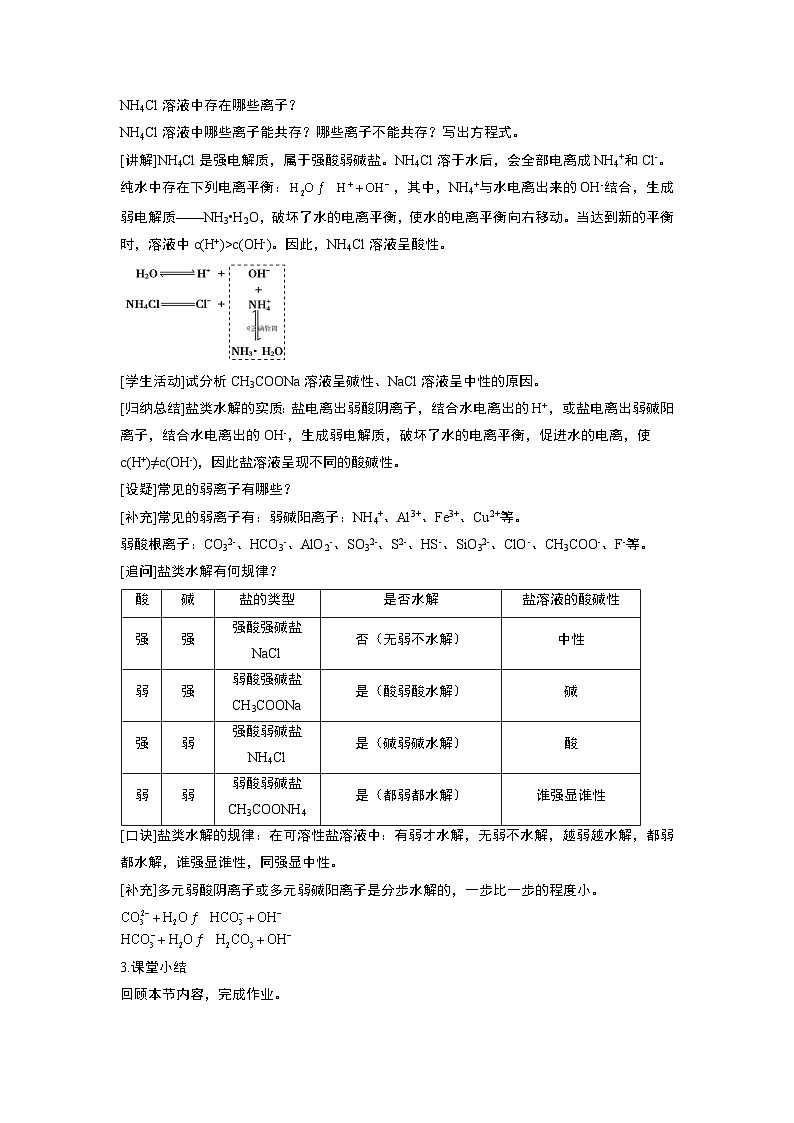
[分析1]NH4Cl溶液显酸性的原因。
NH4Cl溶液存在哪些电离平衡?
NH4Cl溶液中存在哪些离子?
NH4Cl溶液中哪些离子能共存?哪些离子不能共存?写出方程式。
[讲解]NH4Cl是强电解质,属于强酸弱碱盐。NH4Cl溶于水后,会全部电离成NH4+和Cl-。纯水中存在下列电离平衡:,其中,NH4+与水电离出来的OH-结合,生成弱电解质——NH3•H2O,破坏了水的电离平衡,使水的电离平衡向右移动。当达到新的平衡时,溶液中c(H+)>c(OH-)。因此,NH4Cl溶液呈酸性。
[学生活动]试分析CH3COONa溶液呈碱性、NaCl溶液呈中性的原因。
[归纳总结]盐类水解的实质:盐电离出弱酸阴离子,结合水电离出的H+,或盐电离出弱碱阳离子,结合水电离出的OH-,生成弱电解质,破坏了水的电离平衡,促进水的电离,使c(H+)≠c(OH-),因此盐溶液呈现不同的酸碱性。
[设疑]常见的弱离子有哪些?
[补充]常见的弱离子有:弱碱阳离子:NH4+、Al3+、Fe3+、Cu2+等。
弱酸根离子:CO32-、HCO3-、AlO2-、SO32-、S2-、HS-、SiO32-、ClO-、CH3COO-、F-等。
[追问]盐类水解有何规律?
[口诀]盐类水解的规律:在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。
[补充]多元弱酸阴离子或多元弱碱阳离子是分步水解的,一步比一步的程度小。
3.课堂小结
回顾本节内容,完成作业。
4.板书
3.3.1盐类水解
盐
NaCl
KNO3
Na2CO3
CH3COONa
NH4Cl
(NH4)2SO4
盐溶液的酸碱性
盐的类型
酸
碱
盐的类型
是否水解
盐溶液的酸碱性
强
强
强酸强碱盐
NaCl
否(无弱不水解)
中性
弱
强
弱酸强碱盐
CH3COONa
是(酸弱酸水解)
碱
强
弱
强酸弱碱盐
NH4Cl
是(碱弱碱水解)
酸
弱
弱
弱酸弱碱盐
CH3COONH4
是(都弱都水解)
谁强显谁性
相关教案
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解第1课时教案,共2页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教案,共3页。教案主要包含了教学设计框架等内容,欢迎下载使用。
这是一份高中化学第三节 盐类的水解教学设计,共2页。教案主要包含了教学目标,核心素养目标,教学重点等内容,欢迎下载使用。










