








第二章 章末整合 重点突破--人教版高中化学必修第一册同步课件+讲义+专练(新教材)
展开
这是一份第二章 章末整合 重点突破--人教版高中化学必修第一册同步课件+讲义+专练(新教材),文件包含第二章章末整合重点突破pptx、第二章章末整合重点突破教师版docx、第二章章末整合重点突破学生版docx等3份课件配套教学资源,其中PPT共57页, 欢迎下载使用。
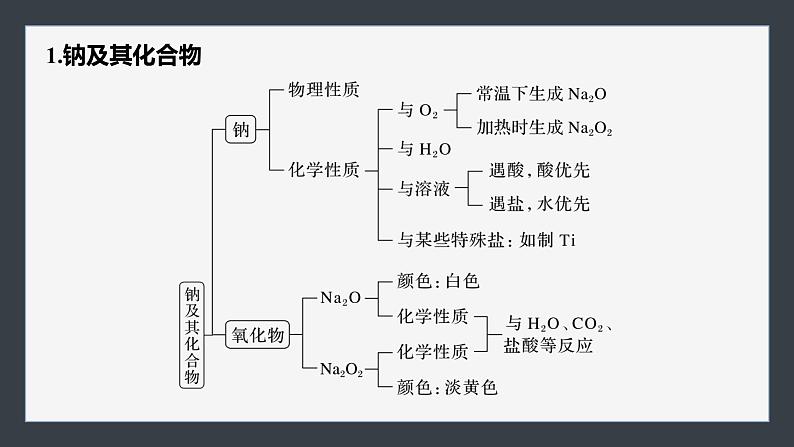
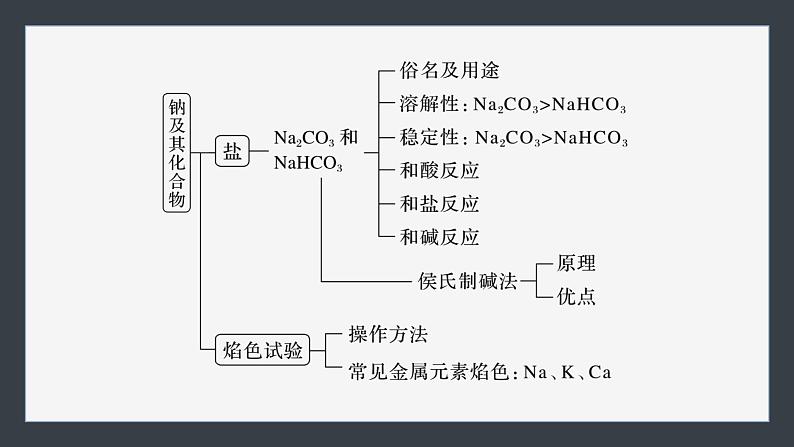
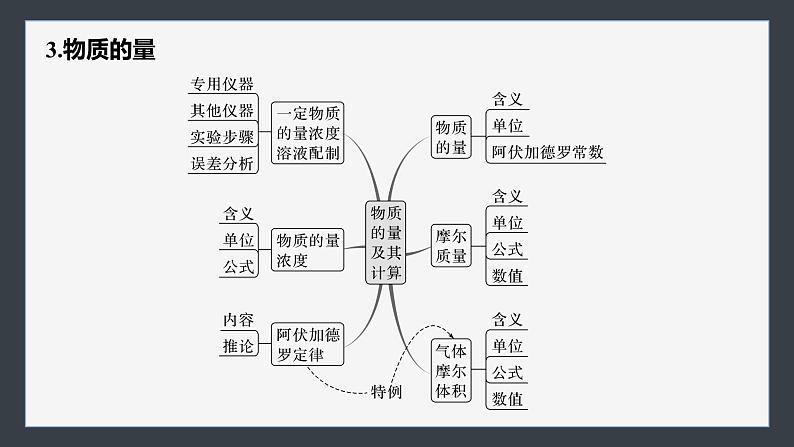
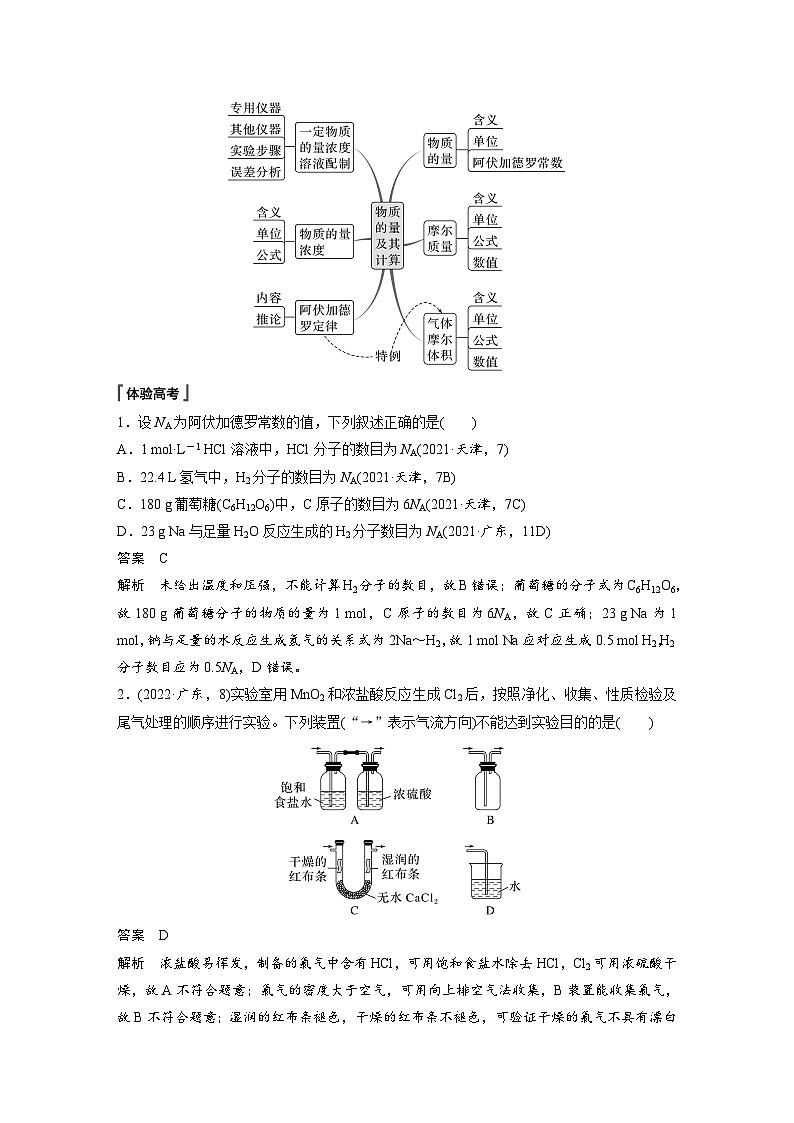
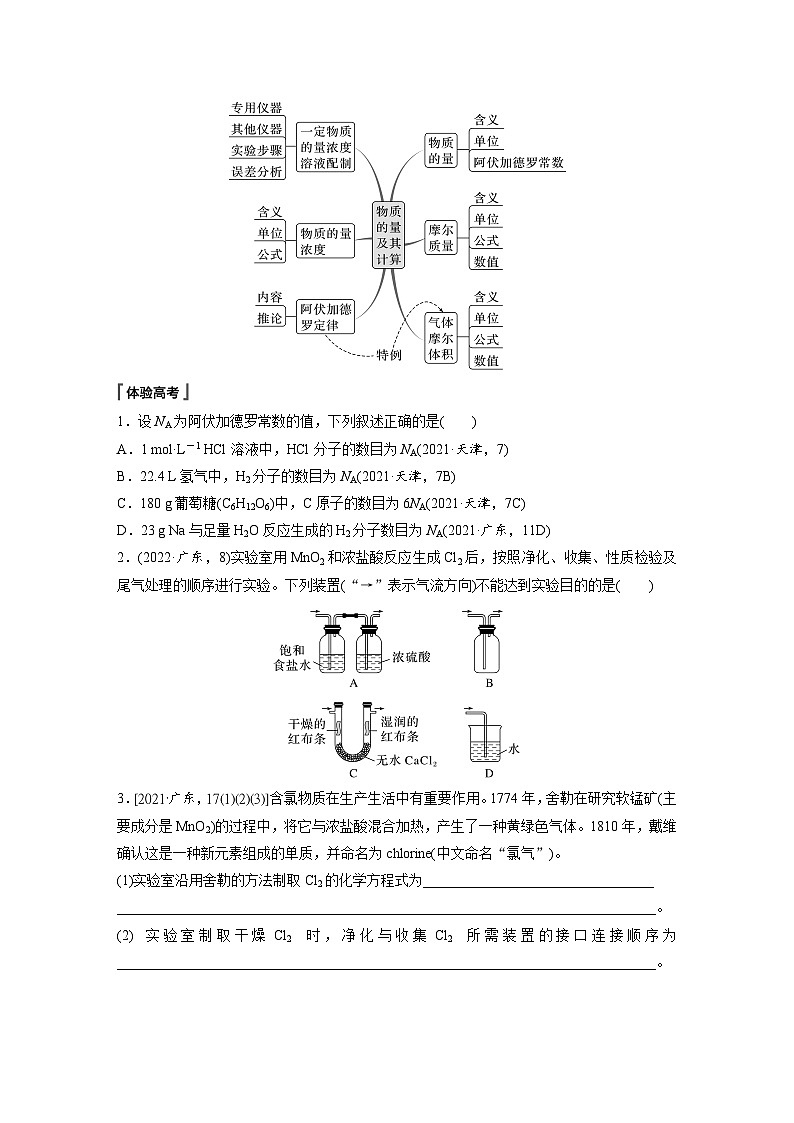
第二章章末整合 重点突破体系构建 理清脉络重点突破 素养提升内容索引体系构建 理清脉络 1.钠及其化合物2.氯及其化合物氯气氯及其化合物物理性质化学性质与金属反应:①Na、②Fe、③Cu与非金属反应:①H2、②P与水反应:Cl2+H2O H++Cl-+HClO与碱反应:Cl2+2OH-===Cl-+ClO-+H2O与还原性盐反应:如FeCl2、Na2S实验室制法原理装置氯水成分:三分子、四离子HClO性质次氯酸盐常见物质“84”消毒液——制备方法漂白粉制备方法漂白原理化学性质:强氧化性(漂白性)3.物质的量体验高考1.设NA为阿伏加德罗常数的值,下列叙述正确的是A.1 mol·L-1 HCl溶液中,HCl分子的数目为NA(2021·天津,7)B.22.4 L氢气中,H2分子的数目为NA(2021·天津,7B)C.180 g葡萄糖(C6H12O6)中,C原子的数目为6NA(2021·天津,7C)D.23 g Na与足量H2O反应生成的H2分子数目为NA(2021·广东,11D)√体验高考2.(2022·广东,8)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是√体验高考3.[2021·广东,17(1)(2)(3)]含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取Cl2的化学方程式为__________________________________________。MnO2+4HCl(浓)体验高考(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为________________。c→d→b→a→e体验高考(3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______已分解。检验此久置氯水中Cl-存在的操作及现象是______________________________________________________________________________________________________________________。HClO向溶液中加入过量稀硝酸,色沉淀生成,则证明原溶液中含有Cl-体验高考4.(2020·全国卷Ⅲ,26节选)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。回答下列问题:(1)盛放MnO2粉末的仪器名称是__________,a中的试剂为____________。圆底烧瓶饱和食盐水体验高考(2)b中采用的加热方式是__________,c中化学反应的离子方程式是_____________________________,采用冰水浴冷却的目的是__________________。水浴加热Cl2+2OH-===ClO-+Cl-+H2O避免生成NaClO3体验高考(3)d的作用是_____________,可选用试剂_____(填标号)。A.Na2S B.NaClC.Ca(OH)2 D.H2SO4吸收尾气(Cl2)AC返回重点突破 素养提升 突破一 Na、Cl及其化合物的转化关系1.钠及其化合物的转化完成下列序号表示的化学方程式或离子方程式:① ,④ ,⑤ ,⑧ ,⑫ ,⑬ ,⑮2Na2O2+2H2O===4Na++4OH-+O2↑,⑯2Na2O2+2CO2===2Na2CO3+O2。2Na+2H2O===2Na++2OH-+H2↑Na2CO3+CO2+H2O===2NaHCO3NaHCO3+NaOH===Na2CO3+H2ONaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl4Na+O2===2Na2O2.氯及其化合物的转化完成下列序号表示的化学方程式或离子方程式:① ,② ,④ ,⑦ ,⑩ ,⑭ ,⑯ ,⑲ 。2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2OCl2+2OH-===Cl-+ClO-+H2OCl2+2I-===I2+2Cl-Cl-+Ag+===AgCl↓Ca(ClO)2+CO2+H2O===CaCO3+2HClO跟踪训练1.以不同类别物质间的转化为线索,认识钠及其化合物。下列分析错误的是A.反应③表明CO2是酸性氧化物B.反应④说明NaHCO3的稳定性弱于Na2CO3C.反应⑤、⑥可用于潜水艇中氧气的供给D.属于氧化还原反应的仅有①、⑤、⑥√跟踪训练2.(2022·广州高一检测)利用如图所示的“价—类”二维图,可以从不同角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。下列说法不正确的是A.若要将甲→乙,需要加入还原剂B.根据氯元素的化合价判断,乙既 有氧化性又有还原性C.丙的化学式为ClO2,戊的化学式 为HClOD.若辛为钾盐,其在MnO2催化下受热分解可制备O2√突破二 以物质的量为核心的计算1.牢记“两大”基本公式:(1)n= = = =_______(2)cB= ;w= ( ρ单位:g·cm-3)c·V(aq)2.理解“三定律,一推论”(1)质量守恒定律:稀释前后,溶质的 不变。(2)电荷守恒定律:溶液中阳离子所带的正电荷总数 阴离子所带的负电荷总数。(3)阿伏加德罗定律:同温、同压、同 的 都含相同数目的 。物质的量等于体积任何气体分子(4)阿伏加德罗定律推论:可概括为“三同定一同,两同见比例”:①同温同压:V1∶V2= = ;ρ1∶ρ2= ;②同温同体积:p1∶p2= =N1∶N2;③同温、同压、同体积:M1∶M2= 。n1∶n2N1∶N2M1∶M2m1∶m2n1∶n2跟踪训练1.下列说法正确的是A.Al的摩尔质量是27 gB.常温常压下,17 g NH3分子中含中子数为10NAC.含6.02×1023个K+的K2SO4晶体的质量为174 gD.48 g O2和O3的混合气体中共含有3NA个氧原子√跟踪训练2.(2023·重庆市育才中学高一检测)用NA代表阿伏加德罗常数的值,下列说法正确的是A.2.7 g金属铝变成[Al(OH)4]-时失去的电子数为0.1NAB.40 g NaOH溶解在1 L水中,所得溶液中溶质的物质的量浓度为 1 mol·L-1C.16 g甲烷(CH4)中含有的质子数为10NAD.常温常压时,22.4 L CO中含有的原子数目为2NA√跟踪训练3.(2023·山东菏泽曹县一中高一质检)回答下列问题:(1)含1.0 mol Fe3+的Fe2(SO4)3中所含 的物质的量是_________。1.5 mol跟踪训练(2)等质量的N2、NH3、NO2、Cl2四种气体中,在相同温度和压强下,体积最大的是_______。NH3跟踪训练(3)某混合溶液中含有Na+、Al3+、Cl-、 ,测得Na+、Al3+和Cl-的物质的量浓度比为3∶2∶1,则Al3+与 的微粒个数比为______。1∶2跟踪训练(4)实验室常用KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O制取少量氯气。若转移电子数目为NA,则产生Cl2的体积为_________(标准状况),被氧化的HCl的物质的量为_______。13.44 L1 mol跟踪训练(5)黑火药是我国古代四大发明之一,其化学反应方程式为S+2KNO3+3C===K2S+3CO2↑+N2↑。①上述反应中被氧化的元素是____(填元素符号);氧化剂是________(填化学式)。CS、KNO3跟踪训练②收集上述反应生成的气体0.4 mol,通入100 mL 4 mol·L-1的氢氧化钠溶液中,最终所得溶液中的溶质是__________________(填化学式)。NaHCO3、Na2CO3突破三 一定物质的量浓度溶液的配制与误差分析1.明确溶液配制过程中的“四数据”(1)记录质量(体积),小数点后保留 数字;(2)选择容量瓶,要注明其 ;(3)移液时要洗涤烧杯、玻璃棒 次;(4)定容时距刻度线1~2 cm时,改用 滴加。一位规格2~3胶头滴管2.实验操作易错点(1)不能在容量瓶中直接溶解、稀释或配制任意体积的溶液;(2)定容时,要平视刻度线,如仰视,则V 、c ;俯视,则V 、c ;(3)摇匀后,液面低于刻度, 滴加蒸馏水,否则,V 、c 。3.误差分析依据: ,要根据实验操作弄清是“m”还是“V”引起的误差再具体分析。偏大偏大偏小不能偏小偏大偏小跟踪训练1.配制500 mL 0.1 mol·L-1的NaCl溶液,下列说法或操作正确的是A.准确称量2.9 g NaCl固体溶于500 mL蒸馏水B.用托盘天平准确称量干燥的NaCl固体2.925 gC.在500 mL容量瓶中溶解氯化钠固体,然后加蒸馏水至刻度线D.准确称量2.9 g混有KCl的NaCl固体,其他操作均正确,配好后的溶 液中c(Cl-)偏低√跟踪训练2.(2022·东莞东华中学高一期末)实验室要使用200 mL 0.1 mol·L-1的Na2CO3溶液,需自行配制。实验室可提供配制溶液的试剂有:①Na2CO3·10H2O晶体,②2 mol·L-1 Na2CO3溶液[M(Na2CO3)=106 g·mol-1]。(1)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、________________。250 mL容量瓶跟踪训练(2)若用Na2CO3·10H2O晶体进行配制,需用托盘天平称取Na2CO3·10H2O的质量为_____ g;若用2 mol·L-1 Na2CO3溶液稀释配制,需用量筒量取_____ mL 2 mol·L-1 Na2CO3溶液。7.212.5跟踪训练(3)用2 mol·L-1 Na2CO3溶液配制所需溶液过程中,下列操作造成浓度偏高的有_____(填字母)。A.容量瓶用蒸馏水洗后未干燥B.用量筒量取2 mol·L-1 Na2CO3时仰视读数C.容量瓶定容加水时超过刻度线后,立即吸出多余的水D.容量瓶定容加水时俯视BD跟踪训练3.某同学按下列步骤配制500 mL 0.2 mol·L-1Na2SO4溶液,完成表格并回答有关问题。14.2托盘天平跟踪训练用玻璃棒引流改用胶头滴管加蒸馏水到凹液面与刻度线水平相切(1)上述实验中使用容量瓶前应___________________。检查容量瓶是否漏液跟踪训练(2)取出该Na2SO4溶液10 mL加水稀释到100 mL,稀释后溶液中Na+的物质的量浓度是______________。0.04 mol·L-1跟踪训练(3)上述配制溶液的过程缺少步骤⑤,⑤是________________________________________________。(4)若进行第⑥步操作时加蒸馏水超过刻度线,则需__________。洗涤烧杯和玻璃棒2~3次,洗涤液一并转移到容量瓶中重新配制跟踪训练(5)在实验中,以下操作造成实验结果偏低的是_______(填字母)。A.在转移溶液时有液体溅到容量瓶外B.定容时仰视刻度线C.转移前没有将使用的容量瓶烘干D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至 刻度线ABD返回






