











第四章 第二节 第1课时 元素性质的周期性变化规律--人教版高中化学必修第一册同步课件+讲义+专练(新教材)
展开
这是一份第四章 第二节 第1课时 元素性质的周期性变化规律--人教版高中化学必修第一册同步课件+讲义+专练(新教材),文件包含第四章第二节第1课时元素性质的周期性变化规律pptx、第四章第二节第1课时元素性质的周期性变化规律专练docx、第四章第二节第1课时元素性质的周期性变化规律教师版docx、第四章第二节第1课时元素性质的周期性变化规律学生版docx、实验视频金属铝和酸碱反应mp4、实验视频Mg和水反应mp4等6份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
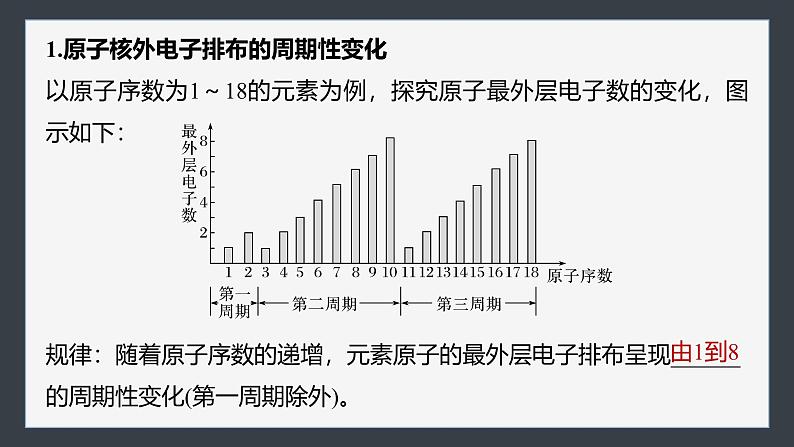
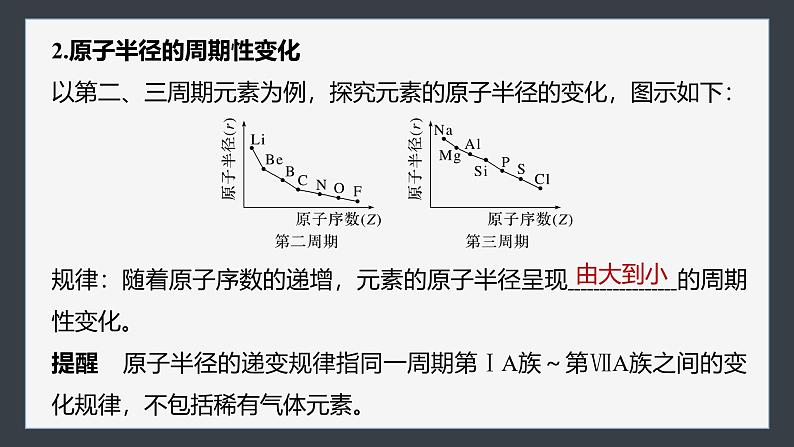
第四章 第二节 第1课时 元素性质的周期性变化规律1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元 素周期律并理解其实质。2.会设计实验探究同周期元素性质的变化规律,会比较元素的金属性或非金属 性的强弱,促进“证据推理与模型认知”化学核心素养的发展。核心素养 发展目标一、核外电子排布、原子半径和主要化合价的变化二、同周期元素金属性和非金属性的递变规律课时对点练内容索引随堂演练 知识落实核外电子排布、原子半径和主要化合价的变化 一1.原子核外电子排布的周期性变化以原子序数为1~18的元素为例,探究原子最外层电子数的变化,图示如下:规律:随着原子序数的递增,元素原子的最外层电子排布呈现______的周期性变化(第一周期除外)。由1到82.原子半径的周期性变化以第二、三周期元素为例,探究元素的原子半径的变化,图示如下:规律:随着原子序数的递增,元素的原子半径呈现 的周期性变化。提醒 原子半径的递变规律指同一周期第ⅠA族~第ⅦA族之间的变化规律,不包括稀有气体元素。由大到小【思考1】 为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?提示 同一周期元素的原子电子层数相同,随着核电荷数的递增,原子核对核外电子的吸引力逐渐增强,故原子半径逐渐减小。3.元素化合价的周期性变化以原子序数为1~18的元素为例,探究元素化合价的变化,图示如右:规律:随着原子序数的递增,元素的化合价呈 变化,即每周期,最高正价为 (O无最高正价、F无正价),负价为 。周期性+1→+7-4→-1【思考2】 主族元素的最高化合价等于其族序数,这句话对吗?为什么?提示 不对。主族元素形成最高化合价时,失去(或偏移)最外层的全部电子达到稳定结构,但O、F元素因原子半径很小,非金属性很强,所以在反应中不能失去(或偏移)最外层的全部电子,故O元素没有最高正化合价、F元素无正价。归纳总结主族元素主要化合价的确定方法(1)最高正价=主族序数=最外层电子数(O、F除外)。(2)最低负价=最高正价-8(H、O、F除外)。(3)H的最高价为+1,最低价为-1;O无最高正价;F无正化合价。应用体验1.判断正误(1)第二周期元素从左至右,最高正价从+1递增到+7(2)原子半径最小的元素是氢元素(3)氢元素除了有+1价外,也可以有-1价,如NaH(4)主族元素的最低负价等于其族序数-8(5)第三周期原子半径最大的元素为钠××√√√应用体验2.(2022·江西赣州期末)下列说法正确的是A.原子序数越大,原子半径一定越大B.电子层数多的原子半径一定比电子层数少的原子半径大C.元素性质的周期性变化不是元素性质的简单重复D.按C、N、O、F的顺序,元素的最高正化合价依次升高√应用体验3.试比较下列微粒的半径大小(填“>”“<”或“=”)。(1)Mg______Ca______K;(2)P______S______Cl;(3)Fe3+______Fe2+______Fe;(4)S2-______Cl-______Na+______Mg2+。><<><<>>>归纳总结“三看法”比较微粒半径的大小一看层,层多径大;二看核,层同核多径小;三看电子,层同核同电子多径大,如Cl->Cl、Fe2+>Fe3+。返回同周期元素金属性和非金属性的递变规律 二以第三周期元素为例探究元素性质的递变规律。1.预测:元素性质的递变规律第三周期元素电子层数 ,由左向右核电荷数依次增多,原子半径依次 ,失电子的能力依次 ,得电子的能力依次 ,预测它们的金属性依次 ,非金属性依次 。相同减小减弱增强减弱增强2.实验探究:金属性的递变规律(1)Na、Mg元素金属性强弱比较少量气泡容易Na>Mg(2)Mg、Al元素金属性强弱比较[Al(OH)4]-溶解溶解溶解不溶解Al(OH)3+3H+===Al3++3H2OMg(OH)2+2H+===Mg2++2H2O不反应Na>Mg>AlAl(OH)3+OH-===3.信息获取:非金属性的递变规律Cl、S、P、Si逐渐增强逐渐增强HClO4H2SO4H3PO4H2SiO34.元素周期律(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。(2)实质:元素性质的周期性变化是元素原子的 周期性变化的必然结果。核外电子排布【思考1】 从原子结构角度解释同周期元素从左至右金属性逐渐减弱,非金属性逐渐增强的原因。提示 在同一周期中,各元素的原子核外电子层数虽然相同,但从左至右,随核电荷数的增加,原子半径逐渐减小,原子核对最外层电子的吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,得电子能力逐渐增强,非金属性逐渐增强。应用体验1.判断正误(1)第三周期元素中,最高价氧化物对应水化物的酸性最强的为H2SO4(2)可以通过气态氢化物的稳定性比较元素的非金属性(3)Al(OH)3是两性氢氧化物,与氨水、盐酸均可反应(4)盐酸可以与Na2CO3溶液反应生成CO2,可由此推出非金属性:Cl>C(5)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性(6)因为金属钠常失去1个电子,而铝失去3个电子,所以钠的金属性小于铝的金属性×××√××应用体验2.除第一周期外,下列关于同周期主族元素的变化规律的叙述不正确的是A.从左到右,原子半径逐渐减小B.从左到右,单质的氧化性逐渐减弱,还原性逐渐增强C.从左到右,元素最高价氧化物对应水化物的碱性逐渐减弱,酸性 逐渐增强D.从左到右,元素最高正化合价从+1递变到+7(氧、氟除外),最低 负化合价从-4递变到-1√应用体验3.(2022·吉林通化高一期末)下列事实不能用于比较元素金属性或非金属性强弱的是A.Na比Mg与冷水反应剧烈,金属性:Na>MgB.F2比O2更容易与H2化合,非金属性:F>OC.KOH的碱性强于Ca(OH)2,金属性:K>CaD.盐酸的酸性强于H2SO3,非金属性:Cl>S√返回随堂演练 知识落实 1231.如图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示A.电子层数 B.最外层电子数C.最高化合价 D.原子半径随堂演练√2.某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为A.4 B.5 C.6 D.7√随堂演练1233.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。随堂演练123(1)C元素在元素周期表中的位置是第____周期第_____族。三ⅢA随堂演练123随堂演练123(2)B的原子结构示意图为__________。随堂演练123(3)D、E气态氢化物的稳定性:__________(填化学式,下同)。HCl>H2S随堂演练123(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是_______。HClO4返回课时对点练 123456789题组一 1~18号元素性质的周期性变化规律1.下列说法正确的是A.随着元素原子序数的递增,P、S、Cl、Ar的最高正化合价依次升高B.随着元素原子序数的递增,Na、Mg、Al、Si的最低负化合价依次降低C.原子序数为15的元素最高化合价为+3D.随着原子序数的递增,第三周期主族元素的最高正化合价依次升高√101112131415对点训练123456789101112131415对点训练13456789101112131415对点训练22.第三周期主族元素中原子半径最大的是A.Na B.Si C.S D.Cl√3.下列各组元素中,按从左到右的顺序,原子序数递增,元素的最高正化合价也递增的是A.C、N、O、F B.Na、Be、B、CC.P、S、Cl、Ar D.Na、Mg、Al、Si13456789101112131415对点训练√2题组二 元素周期律4.元素性质呈周期性变化的决定因素是A.元素原子半径大小呈周期性变化B.元素相对原子质量依次增大C.元素原子核外电子排布呈周期性变化D.元素的最高正化合价呈周期性变化13456789101112131415对点训练√213456789101112131415对点训练5.下列关于元素周期律的叙述正确的是A.随着元素原子序数的递增,原子最外层电子数总是从1→8重复出现B.元素的性质随着原子序数的递增而呈周期性变化C.随着元素原子序数的递增,元素的最高化合价从+1→+7(O、F除外), 最低化合价从-7→-1重复出现D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半 径的周期性变化及元素主要化合价的周期性变化√213456789101112131415对点训练26.(2022·威海高一期末)比较镁和铝金属性强弱的方法正确的是A.将空气中放置已久的两种元素的单质分别与热水作用,比较产生气泡的 快慢B.比较两种金属的熔点C.氢氧化镁的碱性比氢氧化铝强D.将形状、大小相同的两种金属单质和足量盐酸反应,比较产生气体的量13456789101112131415对点训练2√13456789101112131415对点训练27.(2023·温州高一期中)硫的非金属性不如氧强,下列叙述不能说明这一事实的是13456789101112131415对点训练2√13456789101112131415对点训练213456789101112131415对点训练28.几种短周期元素的原子半径及主要化合价如下表:13456789101112131415对点训练2下列叙述正确的是A.X、Y元素的金属性:Xc>bB.形成的简单离子半径:d>e>b>cC.d与c形成的化合物中阴、阳离子 个数比不一定为1∶2D.简单气态氢化物的稳定性:g>f>a13456789101112131415综合强化2√13456789101112131415综合强化2由原子半径大小可知,a、b、c位于第二周期,d、e、f、g位于第三周期,结合化合价可知,a为C,b为N,c为O,d为Na,e为Al,f为S,g为Cl,以此分析解答。Cl的最高正价为+7价,N的最高正价为+5价,O没有最高正价,故A错误;核外电子层数相同时,核电荷数越大离子半径越小,则简单离子半径:b>c>d>e,故B错误;13456789101112131415综合强化2钠元素与氧元素可以形成氧化钠和过氧化钠,阴、阳离子个数比均为1∶2,故C错误;非金属性越强,简单氢化物越稳定,非金属性:Cl>S>C,因此简单气态氢化物的稳定性:g>f>a,故D正确。13.下表为元素周期表的一部分。请回答下列问题:(1)⑦⑧⑨三种元素最高价氧化物对应的水化物中酸性最强的是_______(填化学式)。13456789101112131415综合强化2HClO4(2)③⑥⑨三种元素的简单离子半径由大到小排序为______________(填离子符号)。13456789101112131415综合强化2Cl->O2->Al3+(3)元素④和⑥的最高价氧化物对应的水化物反应的离子方程式为__________________________。13456789101112131415综合强化2(4)从原子结构的角度分析④与⑤的金属性强弱:_______________________________________________________________________________________________________________。13456789101112131415综合强化2Na原子半径比Mg大,Na的核电荷数比Mg小,Na原子核对最外层电子的吸引力较弱,更易失电子,故Na的金属性比Mg强(5)②、⑦的简单气态氢化物中较稳定的是_____(填化学式),判断依据是__________________________。13456789101112131415综合强化2NH3N元素的非金属性比P元素强13456789101112131415综合强化14.(2022·广州真光中学高一期末)为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:(1)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是_______(填字母)。A.硒元素的最低负化合价为-2 B.硒的氧化物对应的水化物属于强酸C.稳定性:H2Se>H2O D.二氧化硒(SeO2)既有氧化性也有还原性2AD13456789101112131415综合强化213456789101112131415综合强化(2)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。①砷有多种同位素原子,其中稳定的核素是75As,它的中子数比质子数多______。2913456789101112131415综合强化②下列关于第ⅤA族元素及其化合物的说法正确的是______(填字母)。A.热稳定性:NH3>PH3B.酸性:HNO3>H3AsO4C.As的氧化物的水化物是强碱D.形成的简单离子半径随着原子序数递增而减小2AB13456789101112131415综合强化213456789101112131415综合强化15.某同学为了验证元素周期律相关的结论,自己设计了一套实验方案,并记录了有关实验现象。213456789101112131415综合强化2回答下列问题:(1)实验①相关反应的离子方程式为_____________________。由实验①可知,Cl、S的非金属性由强到弱的顺序为______(用元素符号表示,下同)。由实验③可知,Br、I的非金属性由强到弱的顺序为_____。S2-+Cl2===2Cl-+S↓Cl>SBr>I13456789101112131415综合强化213456789101112131415综合强化2(2)由实验②和实验④知,碱性:NaOH_____(填“>”或“13456789101112131415综合强化2(3)实验结论:同主族元素自上而下,元素的非金属性逐渐_____(填“增强”或“减弱”,下同);同周期元素,原子序数逐渐增大,金属性逐渐______,非金属性逐渐______。由此可知,H2SiO3、H3PO4、H2SO4、HClO4的酸性由强到弱的顺序为____________________________(填化学式,下同),常见简单气态氢化物NH3、H2O、HF、H2S中稳定性最强的是____。减弱减弱增强HClO4>H2SO4>H3PO4>H2SiO3HF13456789101112131415综合强化2返回






