













所属成套资源:人教版高中化学同步必修第一册课件PPT+讲义+专练(新教材)
第四章 第一节 第1课时 原子结构--人教版高中化学必修第一册同步课件+讲义+专练(新教材)
展开
这是一份第四章 第一节 第1课时 原子结构--人教版高中化学必修第一册同步课件+讲义+专练(新教材),文件包含第四章第一节第1课时原子结构pptx、第四章第一节第1课时原子结构专练docx、第四章第一节第1课时原子结构教师版docx、第四章第一节第1课时原子结构学生版docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
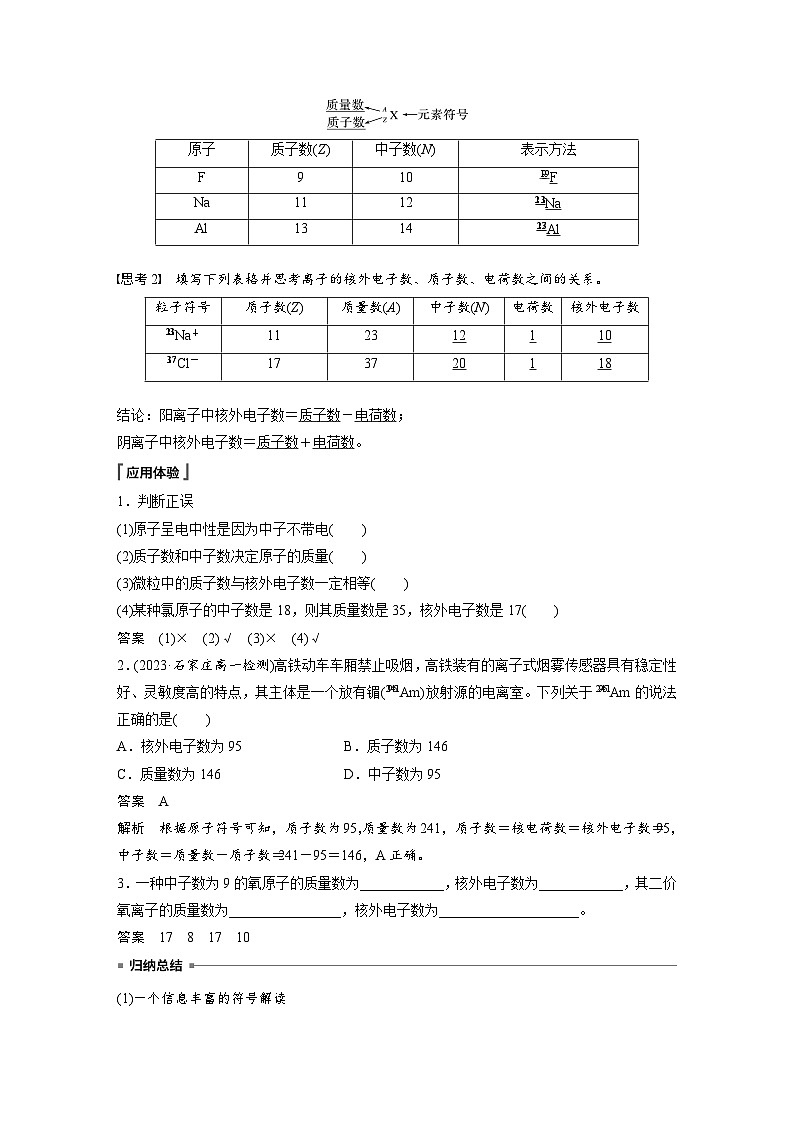
第四章 第一节 第1课时 原子结构1.了解原子的表示方法,掌握有关质量数、质子数、中子数、电子数的相关计算。2.能从微观角度认识原子的构成,掌握原子核外电子排布规律,能画出1~20号 元素的原子结构示意图。核心素养 发展目标一、原子的构成二、原子核外电子排布课时对点练内容索引随堂演练 知识落实原子的构成 一1.构成原子的微粒及其性质原子原子核 :相对质量近似为1,带1个单位正电荷 :相对质量近似为1,不带电核外电子:带1个单位负电荷,质量很小(可忽略不计)质子中子2.质量数(1)概念:将原子核内所有 和 的相对质量取近似_______ ,所得的数值叫做质量数,常用 表示。(2)构成原子的粒子间的两个关系①质量数(A)= + 。②质子数=核电荷数= 。质子整数值相加A质子数(Z)中子数(N)核外电子数中子【思考1】 原子的质量数是否就是原子的相对原子质量?请举例说明。提示 不一定。如 的质量数为32,而硫原子的相对原子质量为32.06,两者数值上相近但不相等。3.原子的表示方法质量数质子数【思考2】 填写下列表格并思考离子的核外电子数、质子数、电荷数之间的关系。1220101811结论:阳离子中核外电子数= - ;阴离子中核外电子数= + 。质子数电荷数质子数电荷数应用体验1.判断正误(1)原子呈电中性是因为中子不带电(2)质子数和中子数决定原子的质量(3)微粒中的质子数与核外电子数一定相等(4)某种氯原子的中子数是18,则其质量数是35,核外电子数是17××√√应用体验2.(2023·石家庄高一检测)高铁动车车厢禁止吸烟,高铁装有的离子式烟雾传感器具有稳定性好、灵敏度高的特点,其主体是一个放有镅 放射源的电离室。下列关于 的说法正确的是A.核外电子数为95 B.质子数为146C.质量数为146 D.中子数为95√应用体验3.一种中子数为9的氧原子的质量数为_____,核外电子数为_____,其二价氧离子的质量数为_____,核外电子数为_____。1781710归纳总结(1)一个信息丰富的符号解读(2)粒子中的电性关系①分子或原子:质子数=核外电子数②阳离子Xn+:质子数=核外电子数+n③阴离子Xn-:质子数=核外电子数-n返回原子核外电子排布 二1.电子层(1)概念:在含有多个电子的原子里,电子分别在 的区域内运动。我们把不同的区域简化为 ,也称作电子层。如图为电子层模型示意图:能量不同不连续的壳层(2)不同电子层的表示及能量关系KLMNOPQ近远低高2.电子分层排布阅读教材思考与讨论中稀有气体元素原子的电子层排布规律(1)能量最低原理核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。(2)电子层最多容纳的电子数①第n层最多容纳 个电子。如K、L、M、N层最多容纳的电子数分别为 。②最外层电子数目最多不能超过 个(K层为最外层时不能超过 个)。③次外层最多能容纳的电子数不超过 个。2n22、8、18、3282183.核外电子排布的表示方法——原子结构示意图(1)钠的原子结构示意图(2)画出下列原子或离子的结构示意图①S: ,S2-: ;②Ca: ,Ca2+: 。【思考1】 M层最多可容纳18个电子,为什么钾原子的核外电子排布不是 而是 ?提示 原子核外电子排布每层最多容纳2n2个电子,故M层最多可容纳18个电子,但M层作为最外层时,最多不超过8个电子。4.常见的10e-和18e-微粒(1)F-、O2-、N3-、OH-HF、H2O、NH3、CH4(2)H2SF2K+、Ca2+【思考2】 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出质子数,请你根据核外电子排布,推测可能的微粒符号。提示 可能为中性原子Ne,也可能为阳离子Na+、Mg2+、Al3+,也可能为阴离子F-、O2-、N3-。归纳总结(1)从两个角度看核外电子排布规律归纳总结(2)核外电子排布的规律是互相联系的,不能孤立地理解。如钙原子由于受最外层电子数不超过8个的限制,其原子结构示意图为 而不是 。(3)通常把最外层有8个电子(外层为K层时,只有2个电子)的结构,称为相对稳定结构。应用体验1.判断正误(1)在多电子原子里,电子的能量不完全相同(2)能量高的电子在离核近的区域内运动(3)M层为最外层时,最多容纳18个电子(4)原子的次外层电子数都是8(5)Mg的原子结构示意图是×××√×应用体验2.下列说法正确的是A.某单核微粒的核外电子排布如图所示,则该微粒 一定是氩原子 B.最外层只有1个电子的元素一定是金属元素C. 与H3O+具有相同的质子数和电子数D.最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为 阳离子√返回随堂演练 知识落实 12341.(2022·葫芦岛高一月考)稀土被称为“工业黄金”和“新材料之母”,其中钇(Y)是稀土元素的代表。下列关于 的说法,不正确的是A.质子数为39 B.质量数为128C.中子数为50 D.核外电子数为39√随堂演练2.如图为某原子的原子结构示意图,下列有关说法错误的是A.核电荷数为11B.该原子的摩尔质量为23 gC.电子层数为3D.最外层有1个电子√随堂演练12343.(2022·上海嘉定区高一期中)有如下三种微粒的结构示意图,下列说法正确的是A.①②属于同种元素的原子B.①②是同种元素的微粒, 且①是原子,②是正离子C.②③是同种元素的原子D.①②是同种元素的微粒,且①是负离子,②是原子√随堂演练1234随堂演练12344.根据下列叙述,写出元素名称并画出原子结构示意图。随堂演练1234硼钠氧随堂演练1234返回课时对点练 123456789题组一 原子结构1.铍的密度是钛的一半,铍元素被称为“未来的航天元素”。中国是世界上有能力提炼铍的少数国家之一。已知铍的一种同位素 ,其核内中子数为A.4 B.5 C.9 D.13√101112131415对点训练13456789101112131415对点训练2A.质子数为90 B.核外电子数为90C.中子数为142 D.质量数为322√3.(2022·重庆高一检测)钴-60( )放射源的应用非常广泛,在农业上,常用于辐射育种、刺激增产、辐射防治虫害等。下列有关说法错误的是A.钴的相对原子质量是60B.60Co与60Fe具有相同的质量数C.60Co与59Co核外电子数相同D. 核内中子数与核外电子数之差为613456789101112131415对点训练√213456789101112131415对点训练2题组二 原子核外电子排布规律4.下列说法不符合原子核外电子排布基本规律的是A.核外电子总是优先排在能量最低的电子层上B.K层是能量最低的电子层C.N电子层为次外层时,最多可容纳的电子数为18D.各电子层(n)最多可容纳的电子数为n213456789101112131415对点训练√213456789101112131415对点训练5.下列关于核外电子排布的说法不正确的是A.第二电子层最多容纳的电子数为8B.次外层最多可容纳的电子数为18C.最多可容纳2个电子的电子层一定是第一电子层D.最多可容纳8个电子的电子层一定是第二电子层√213456789101112131415对点训练2题组三 原子(离子)结构示意图的理解及判断6.认识原子的结构有利于理解元素的性质。某元素X的原子结构示意图如图所示。下列说法不正确的是A.a=16B.该元素原子可得2个电子达到稳定结构C.该元素的最高化合价为+10D.该元素单质在空气中燃烧的产物的化学式为SO213456789101112131415对点训练2√13456789101112131415对点训练27.某粒子的结构示意图为 ,关于该粒子的说法不正确的是A.属于阴离子 B.核外有3个电子层C.核外电子数为18 D.在化学反应中易得电子13456789101112131415对点训练2√8.(2022·上海闵行区高一期中)某粒子(原子或离子)的结构示意图如图所示,下列说法错误的是A.若n=8,则该粒子所对应元素的符号一定为ArB.若该粒子带两个单位负电荷,且n=8,则该粒子 的符号为S2-C.若m-n<10,则该粒子是一个阴离子D.若m-n=10,则该粒子一定是原子13456789101112131415对点训练2√13456789101112131415对点训练213456789101112131415综合强化2√134567891011121314152综合强化134567891011121314152综合强化A.①②③ B.②③④C.①②④ D.①③④√11.两种元素原子X和Y,X原子的M层比Y原子的M层少3个电子,Y原子的L层电子数恰好是X原子L层电子数的两倍,则X、Y分别是A.硅原子和钠原子 B.硼原子和氮原子C.氮原子和碳原子 D.碳原子和铝原子√134567891011121314152综合强化12.(2023·吉林高一检测)核内中子数为N的R2+的质量数为A,R2+与16O所形成的W g氧化物中所含质子的物质的量为13456789101112131415综合强化2√13456789101112131415综合强化2R2+带2个单位正电荷,所以其氧化物的化学式为RO,该氧化物的摩尔质量为(A+16) g·mol-1,W g该氧化物的物质的量为 ;核内中子数为N的R2+的质量数为A,所以质子数为A-N,1 mol氧化物中含有(A-N+8) mol质子,所以W g该氧化物中所含质子的物质的量为 ,A符合题意。13.某微粒A的结构示意图为 :(1)若x=8,则此阴离子与图表示的带一个正电荷的阳离子形成一种常见化合物的化学式是_______。13456789101112131415综合强化2Na2O(2)1 mol微粒A含有10 mol电子,下列微粒各1 mol,也含有10 mol电子的有__________(填序号)。①CH4 ②H2O2 ③HF ④Al3+ ⑤Cl- ⑥13456789101112131415综合强化2①③④⑥13456789101112131415综合强化2①C原子含有6个电子,H原子中含有1个电子,CH4共含有10个电子;②H原子中含有1个电子,O原子中含有8个电子,H2O2共含有18个电子;③H原子中含有1个电子,F原子含有9个电子,HF共含有10个电子;④Al原子含有13个电子,Al失去3个电子形成Al3+,Al3+含有10个电子;⑤Cl原子含有17个电子,Cl得到1个电子形成Cl-,Cl-含有18个电子;(3)若A的阳离子为An+且质量数为a,则其质子数为________,中子数为___________(用含有a、n的代数式表达)。13456789101112131415综合强化210+na-(10+n)13456789101112131415综合强化14.按要求填写下列空白。(1)ARn+共有x个电子,则该阳离子的中子数为__________。2A-x-n13456789101112131415综合强化(2)AXn-共有x个电子,则该阴离子的中子数为__________。2A-x+n13456789101112131415综合强化(3)已知R原子有b个中子,R2+核外有a个电子,则R原子的组成符号是_______。213456789101112131415综合强化(4)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为________________。213456789101112131415综合强化(5)已知阴离子R2-的原子核内有x个中子,R原子的质量数为m,则W g R原子完全转化为R2-,其中含有的电子数为________________(用NA表示阿伏加德罗常数的值)。213456789101112131415综合强化15.(2022·邯郸一中高一月考)有四种元素A、B、C、D,其中B2-与C+核外都有两个电子层,B原子的质子数与C原子的质子数之和等于D原子的质子数,A原子失去一个电子后变成一个质子,试回答:(1)A、B、C、D的元素符号分别为_____、_____、_____、_____。(2)D原子的原子结构示意图为_____________,C+的离子结构示意图为__________。2HONaK13456789101112131415综合强化(3)写出与C+具有相同电子数的四种分子:______、______、______、______(填化学式)。2H2ONH3CH4HF返回






