

湖南省长沙市2024-2025学年高一下学期开学适应性模拟测试化学试题(解析版)
展开
这是一份湖南省长沙市2024-2025学年高一下学期开学适应性模拟测试化学试题(解析版),共26页。试卷主要包含了化学与生活密切相关,三氟化溴等内容,欢迎下载使用。
1.下列单、双线桥的表示方法不正确的是( )
A.
B.
C.
D.
2.下列各组离子能在同一溶液中大量共存的是( )
A.Fe2+、Al3+、S2﹣、OH﹣
B.Ca2+、Mg2+、、
C.Ag+、Li+、Cl﹣、
D.K+、Na+、、
3.化学与生活密切相关。下列物质的用途利用了其还原性的是( )
A.食品袋中铁粉作除氧剂
B.醋酸用于除去水壶中的水垢
C.臭氧作自来水消毒剂
D.铜用于制作电线
4.甲、乙、丙、丁四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl﹣、、、中的某一种。已知:每种离子均不重复出现。现做以下实验:
①各取少量四种盐,分别溶于盛有5mL蒸馏水的4支试管中,只有乙盐溶液呈蓝色。
②分别向4支试管中加入2mL稀盐酸,发现甲盐溶液中产生白色沉淀,丙盐溶液中有较多气泡产生,而丁盐溶液中无明显现象。
下列说法正确的是( )
A.甲盐溶液中产生的白色沉淀是AgCl
B.乙盐为Cu(NO3)2
C.若向丙盐溶液中滴加稀盐酸,溶液中立即产生气泡
D.实验②结束后,向盛有丁盐溶液的试管中依次滴加足量的稀硝酸、AgNO3溶液,可检验丁盐中是否含有Cl﹣
5.化学的学习与研究,由宏观到微观,由定性到定量。用NA表示阿伏加德罗常数的值,下列定量分析正确的是( )
A.标准状况下,22.4LHH2O的质量为18g
B.等物质的量的O2、CO2含有的O原子数均为2NA
C.1L0.5ml•L﹣1NaHCO3溶液中含有的H原子数为0.5NA
D.通常状况下,7.8gNa2O2固体中含有的阴离子数为0.1NA
6.下列描述Ⅰ、描述Ⅱ均正确且存在因果关系的是( )
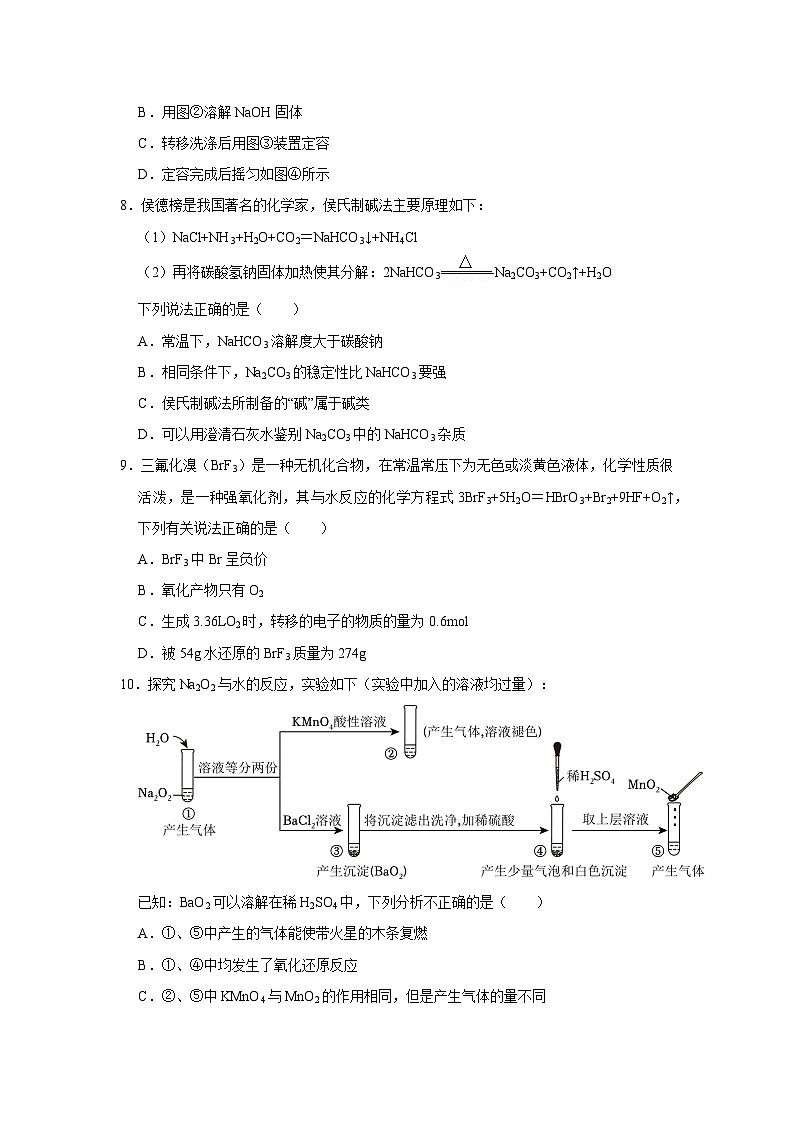
7.配制0.1ml/L的NaOH溶液,如图所示装置和描述均正确的是( )
A.用图①装置称量一定质量的NaOH固体
B.用图②溶解NaOH固体
C.转移洗涤后用图③装置定容
D.定容完成后摇匀如图④所示
8.侯德榜是我国著名的化学家,侯氏制碱法主要原理如下:
(1)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(2)再将碳酸氢钠固体加热使其分解:2NaHCO3Na2CO3+CO2↑+H2O
下列说法正确的是( )
A.常温下,NaHCO3溶解度大于碳酸钠
B.相同条件下,Na2CO3的稳定性比NaHCO3要强
C.侯氏制碱法所制备的“碱”属于碱类
D.可以用澄清石灰水鉴别Na2CO3中的NaHCO3杂质
9.三氟化溴(BrF3)是一种无机化合物,在常温常压下为无色或淡黄色液体,化学性质很活泼,是一种强氧化剂,其与水反应的化学方程式3BrF3+5H2O=HBrO3+Br2+9HF+O2↑,下列有关说法正确的是( )
A.BrF3中Br呈负价
B.氧化产物只有O2
C.生成3.36LO2时,转移的电子的物质的量为0.6ml
D.被54g水还原的BrF3质量为274g
10.探究Na2O2与水的反应,实验如下(实验中加入的溶液均过量):
已知:BaO2可以溶解在稀H2SO4中,下列分析不正确的是( )
A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应
C.②、⑤中KMnO4与MnO2的作用相同,但是产生气体的量不同
D.④中白色沉淀的主要成分是BaSO4
11.下列说法正确的有( )
①酸性氧化物在一定条件下均能与碱发生反应
②离子方程式H++OH﹣═H2O可以表示所有强酸和强碱之间的中和反应
③溶于水后能电离出氢离子的化合物一定是酸
④某物质经分析只含有一种元素,则该物质一定是纯净物
⑤两种化合物生成另外两种化合物的反应一定是复分解反应
⑥某元素由化合态变为游离态,则它可能被还原也可能被氧化
⑦酸性氧化物不一定都是非金属氧化物,但碱性氧化物一定都是金属氧化物
A.3个B.4个C.5个D.6个
12.下列关于胶体和溶液的说法中,正确的是( )
A.许多胶体能进行电泳是因为这些胶体带电
B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
13.分类是学习化学的一种重要方法。下列分类叙述不正确的是( )
A.盐类:烧碱、氧化钙B.金属材料:钢、黄铜
C.氮肥:氯化铵、尿素D.氧化物:二氧化锰、水
14.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
15.下列离子方程式的书写正确的是( )
A.氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣
B.食醋除水垢:+2H+═H2O+CO2↑
C.氯化铁溶液与铁反应:2Fe3++Fe═3Fe2+
D.氧化铜与稀硫酸反应:CuO+2H++═CuSO4+H2O
16.设NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.0.2ml•L﹣1Na2SO4溶液中,Na+的数目为0.4NA
B.在常温常压下,1.6gCH4含有的原子数为0.5NA
C.标准状况下,2.24LH2O含有的共价键数为0.2NA
D.50mL12ml•L﹣1盐酸与足量MnO2共热,转移的电子数为0.3NA
17.下列表示反应中相关微粒的化学用语正确的是( )
A.水的电子式:
B.N2的结构式:N=N
C.CuCl2的电离:CuCl2═Cu2++
D.中子数为18的氯原子:
18.金属钛有“生物金属”之称。下列有关Ti和Ti的说法正确的是( )
A.Ti和Ti原子中均含有22个中子
B.Ti和Ti互为同位素,在元素周期表中的位置相同
C.Ti和Ti物理性质相同
D.Ti和Ti为同一核素
二.解答题(共4小题)
19.碳纳米管可以看成是由石墨片层卷成的管状物,在力学、电学等方面都具有非凡的性能。工业上用电弧法合成的碳纳米管中常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。已知氧化性:K2Cr2O7>KMnO4。
回答下列问题:
(1)碳纳米管、碳纳米颗粒与金刚石的关系为 ;将碳纳米颗粒均匀分散在水中,使用激光笔照射,能观察到的现象为 。
(2)由价态规律可知,Cr2(SO4)3具有的性质: (填标号)。
a.仅具有氧化性
b.仅具有还原性
c.既有氧化性又有还原性
d.无法判断
(3)在上述反应中,还原剂是 (填化学式,下同),氧化剂被还原为 。该反应中H2SO4只表现酸性,为反应提供酸性环境,则在该反应中 (填“能”或“不能”)用盐酸代替硫酸提供酸性环境,原因为 。
(4)将上述化学方程式改写为离子方程式: 。
20.Ⅰ.对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的,现有以下物质:①CH3COOH②Cu③固体BaSO4④Fe(OH)3胶体⑤CH3CH2OH(酒精)⑥氨气⑦稀硫酸
(1)以上物质中属于混合物的是 (填序号,下同)。
(2)属于电解质的是 。
Ⅱ.钠、氯及其化合物有如图转化关系,淡黄色物质M可在潜水艇中作为氧气的来源,常被用作供氧剂,N常用来杀菌消毒。请按要求填空:
(1)物质N是 (填化学式)。
(2)写出M与水反应的离子方程式为 。
(3)除去Na2CO3固体中的少量杂质NaHCO3写出相关反应的化学方程式 。
(4)加热4.00gNa2CO3和NaHCO3的固体混合物,使NaHCO3完全分解,固体混合物的质量减少了0.31g,则原混合物中Na2CO3的质量为 g。
(5)检验某溶液中是否含有Cl﹣的方法是 。
21.完成下列问题。
(1)32.0gO2和2.0gH2组成的混合气体在标准状况下体积约为 L。
(2)标准状况下3.36L某气体的质量为8.1g,则该气体的摩尔质量为 。
(3)将200mL0.5ml•L﹣1BaCl2溶液与300mL0.2ml•L﹣1AlCl3溶液混合,则所得混合溶液中Cl﹣的物质的量浓度为 ml•L﹣1(忽略混合前后溶液体积的变化)。
(4)现有14.4g由CO和CO2组成的混合气体,在标准状况下所占的体积约为8.96L。回答下列问题:
①该混合气体中CO的物质的量为 ml。
②混合气体中碳原子的个数为 。
(5)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有 性。下列不能实现上述转化的物质是 (填字母)。
A.Cl2
B.O2
C.FeCl3
D.KMnO4(H+)
(6)ClO2是一种广谱型的消毒剂,将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,反应中氧化剂和还原剂的个数比为 。
(7)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应。用单线桥法表示上述反应中电子得失的方向和数目: 。
22.对于数以千万计的化学物质和如此丰富的化学变化,分类法的作用几乎是无可替代的。已知有下列物质:
①Ca②熔融CaO③Ca(OH)2固体④干冰(CO2)⑤酒精(C2H5OH)⑥稀硫酸⑦稀氨水⑧有色玻璃⑨稀醋酸⑩小苏打粉末(NaHCO3)⑪Fe(OH)3胶体
请回答:
(1)属于酸式盐的有 (填序号,下同),属于胶体的有 。
(2)能导电的物质有 ,不能导电的电解质有 ,非电解质有 。
(3)将⑥的水溶液逐滴加入到⑪中的现象是 。
(4)写出下列反应的离子方程式。
Ⅰ.⑥与⑦反应: 。
Ⅱ.向③的溶液中加入过量⑩的溶液: 。
(5)通常情况下,在弱酸及弱碱的稀溶液中,弱酸、弱碱的电离程度均较小,据此可判断,向⑨中逐滴加入⑦直至过量,溶液的导电能力[电流(Ⅰ)]随⑦的滴入量[质量(m)]的变化趋势正确的是 (填标号)。
(6)H3PO4是三元酸,能与NaOH反应生成NaH2PO4、Na2HPO4两种酸式盐和Na3PO4一种正盐。磷还有一种含氧酸叫亚磷酸(H3PO3),是二元弱酸,那么Na2HPO3为 (填“正盐”或“酸式盐”)。
【参考答案】
一.选择题(共18小题)
1.下列单、双线桥的表示方法不正确的是( )
A.
B.
C.
D.
【答案】B
【解析】解:A、钠元素的化合价升高,氯元素的化合价降低,则钠失去电子,氯气得到电子,转移的电子数为2e﹣,则用单线桥表示电子转移方向和数目为故A正确;
B.该反应中Cl元素的化合价既升高又降低,转移的电子数为e﹣,则用单线桥表示电子转移方向和数目为,故B错误;
C.该反应中钠失去电子,氢得到电子,转移的电子数为2e﹣,则用双线桥表示电子转移方向和数目为,故C正确;
D.该反应中碘失去电子,溴得到电子,转移的电子数为2e﹣,则用双线桥表示电子转移方向和数目为,故D正确;
故选:B。
2.下列各组离子能在同一溶液中大量共存的是( )
A.Fe2+、Al3+、S2﹣、OH﹣
B.Ca2+、Mg2+、、
C.Ag+、Li+、Cl﹣、
D.K+、Na+、、
【答案】D
【解析】解:A.Fe3+、Al3+与OH﹣分别会产生氢氧化铁沉淀和氢氧化铝沉淀,且硫离子与铁离子和铝离子生成硫化物沉淀,也不能大量共存,故A错误;
B.Mg2+、Ca2+与会产生碳酸镁和碳酸钙沉淀,不能大量共存,故B错误;
C.Ag+与Cl﹣会产生氯化银沉淀,不能大量共存,故C错误;
D.各离子之间互不反应,能大量共存,故D正确;
故选:D。
3.化学与生活密切相关。下列物质的用途利用了其还原性的是( )
A.食品袋中铁粉作除氧剂
B.醋酸用于除去水壶中的水垢
C.臭氧作自来水消毒剂
D.铜用于制作电线
【答案】A
【解析】解:A.铁粉具有还原性,会消耗食品袋内的氧气,而防止食品氧化变质,利用的是Fe的还原性,故A正确;
B.碳酸钙和醋酸反应生成醋酸钙、二氧化碳和水,该过程中没有元素化合价变化,是非氧化还原反应,故B错误;
C.臭氧具有强氧化性,利用其强氧化性消毒杀菌,故C错误;
D.铜单质具有导电性,故用来制作电线,故D错误;
故选:A。
4.甲、乙、丙、丁四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl﹣、、、中的某一种。已知:每种离子均不重复出现。现做以下实验:
①各取少量四种盐,分别溶于盛有5mL蒸馏水的4支试管中,只有乙盐溶液呈蓝色。
②分别向4支试管中加入2mL稀盐酸,发现甲盐溶液中产生白色沉淀,丙盐溶液中有较多气泡产生,而丁盐溶液中无明显现象。
下列说法正确的是( )
A.甲盐溶液中产生的白色沉淀是AgCl
B.乙盐为Cu(NO3)2
C.若向丙盐溶液中滴加稀盐酸,溶液中立即产生气泡
D.实验②结束后,向盛有丁盐溶液的试管中依次滴加足量的稀硝酸、AgNO3溶液,可检验丁盐中是否含有Cl﹣
【答案】A
【解析】解:甲、乙、丙、丁四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl﹣、、、中的某一种,Ag+和Cl﹣、、均不共存,只为AgNO3;与Ba2+、Cu2+、Ag+均不共存,只为Na2CO3;Ba2+与不共存,只为BaCl2;Cu2+与结合为CuSO4;
①各取少量四种盐,分别溶于盛有5mL蒸馏水的4支试管中,只有乙盐溶液呈蓝色,则乙为CuSO4;
②分别向4支试管中加入2mL稀盐酸,发现甲盐溶液中产生白色沉淀,丙盐溶液中有较多气泡产生,而丁盐溶液中无明显现象,则甲为AgNO3、丙为Na2CO3、丁为BaCl2,据此分析解答。
A.由上述分析可知,甲、乙、丙、丁四种可溶性盐分别为AgNO3、CuSO4、Na2CO3、BaCl2,AgNO3和盐酸反应生成AgCl沉淀和HNO3,故A正确;
B.甲、乙、丙、丁四种可溶性盐分别为AgNO3、CuSO4、Na2CO3、BaCl2,故B错误;
C.丙为Na2CO3,滴加稀盐酸时先生成NaHCO3和NaCl,而后NaHCO3和盐酸反应生成CO2气体,故C错误;
D.实验②加入2mL稀盐酸时引入了Cl﹣,不能据此实验检验丁盐中是否含有Cl﹣,故D错误;
故选:A。
5.化学的学习与研究,由宏观到微观,由定性到定量。用NA表示阿伏加德罗常数的值,下列定量分析正确的是( )
A.标准状况下,22.4LHH2O的质量为18g
B.等物质的量的O2、CO2含有的O原子数均为2NA
C.1L0.5ml•L﹣1NaHCO3溶液中含有的H原子数为0.5NA
D.通常状况下,7.8gNa2O2固体中含有的阴离子数为0.1NA
【答案】D
【解析】解:A.标况下水是液体,不能使用气体摩尔体积计算其物质的量,故A错误;
B.物质的量未知,无法计算含氧原子个数,故B错误;
C.碳酸氢钠溶液中,碳酸氢根离子、水分子都含有氢原子,所以1L0.5ml•L﹣1NaHCO3溶液中含有的H原子数大于0.5NA,故C错误;
D.通常状况下,7.8gNa2O2固体物质的量为:=0.1ml,含有的阴离子数为0.1NA,故D正确;
故选:D。
6.下列描述Ⅰ、描述Ⅱ均正确且存在因果关系的是( )
【答案】C
【解析】解:A.电解质必须是本身能电离产生自由移动的离子而导电,二氧化碳、氨气本身不能电离产生自由移动的离子,属于非电解质,故A错误;
B.氧化钠水溶液导电是因为氧化钠与水反应生成电解质氢氧化钠,氢氧化钠电离产生自由移动的离子,不能说明氧化钠为电解质,故B错误;
C.硫酸为化合物,在水溶液中能电离出自由移动的离子,所以硫酸为电解质,故C正确;
D.铜为单质,不是电解质也不是非电解质,故D错误;
故选:C。
7.配制0.1ml/L的NaOH溶液,如图所示装置和描述均正确的是( )
A.用图①装置称量一定质量的NaOH固体
B.用图②溶解NaOH固体
C.转移洗涤后用图③装置定容
D.定容完成后摇匀如图④所示
【答案】C
【解析】解:A.氢氧化钠固体容易潮解,故在称量时不能用称量纸称量,应放在烧杯中称量,故A错误;
B.配制溶液时,应在烧杯中搅拌溶解,而不能在量筒中溶解物质,故B错误;
C.定容时,将蒸馏水注入容量瓶,至液面离容量瓶刻度线1~2cm时,改用胶头滴管滴加至凹液面与刻度线相切,读数时视线与刻度线平视,故C正确;
D.图中所示未定容完成,且定容完成后摇匀的正确操作是:盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,反复上下颠倒,使溶液混合均匀,故D错误;
故选:C。
8.侯德榜是我国著名的化学家,侯氏制碱法主要原理如下:
(1)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(2)再将碳酸氢钠固体加热使其分解:2NaHCO3Na2CO3+CO2↑+H2O
下列说法正确的是( )
A.常温下,NaHCO3溶解度大于碳酸钠
B.相同条件下,Na2CO3的稳定性比NaHCO3要强
C.侯氏制碱法所制备的“碱”属于碱类
D.可以用澄清石灰水鉴别Na2CO3中的NaHCO3杂质
【答案】B
【解析】解:A.NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,反应原理分析可知,碳酸氢钠溶解度小,常温下,NaHCO3溶解度小于碳酸钠,故A错误;
B.2NaHCO3Na2CO3+CO2↑+H2O,碳酸氢钠受热分解,碳酸钠受热不分解,相同条件下,Na2CO3的稳定性比NaHCO3要强,故B正确;
C.侯氏制碱法所制备的“碱”是碳酸钠,不属于碱类,故C错误;
D.Na2CO3中的NaHCO3和澄清石灰水都能反应生成碳酸钙沉淀,不能用澄清石灰水鉴别Na2CO3中的NaHCO3杂质,故D错误;
故选:B。
9.三氟化溴(BrF3)是一种无机化合物,在常温常压下为无色或淡黄色液体,化学性质很活泼,是一种强氧化剂,其与水反应的化学方程式3BrF3+5H2O=HBrO3+Br2+9HF+O2↑,下列有关说法正确的是( )
A.BrF3中Br呈负价
B.氧化产物只有O2
C.生成3.36LO2时,转移的电子的物质的量为0.6ml
D.被54g水还原的BrF3质量为274g
【答案】D
【解析】解:A.电负性:Br<F,共用电子对偏向F,偏离Br,所以BrF3中Br呈正价,F显负价,故A错误;
B.含有化合价升高元素的产物是氧化产物,氧化产物有HBrO3和O2,故B错误;
C.气体状态未知,无法确定氧气的物质的量,无法计算转移电子的物质的量,故C错误;
D.54g水的物质的量为3ml,可以失去6ml电子,能够还原2ml BrF3,质量为2ml×137g/ml=274g,故D正确;
故选:D。
10.探究Na2O2与水的反应,实验如下(实验中加入的溶液均过量):
已知:BaO2可以溶解在稀H2SO4中,下列分析不正确的是( )
A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应
C.②、⑤中KMnO4与MnO2的作用相同,但是产生气体的量不同
D.④中白色沉淀的主要成分是BaSO4
【答案】B
【解析】解:过氧化钠与水先发生复分解反应,生成氢氧化钠和双氧水,反应放热,少量双氧水分解,产生少量氧气,将溶液一分为二,第一份中加入酸性高锰酸钾溶液,双氧水被高锰酸钾氧化为氧气,高锰酸钾溶液褪色,另一份加入氯化钡,双氧水与氯化钡反应,生成BaO2和盐酸,将沉淀过滤、洗涤,加入稀硫酸,BaO2和稀硫酸反应,生成硫酸钡和双氧水,双氧水部分分解为氧气,在加入稀硫酸,然后向上层清液中加入二氧化锰,二氧化锰做催化剂,双氧水分解为氧气和水,据此分析作答。
A.根据分析可知,①、⑤中产生的气体均为氧气,都能使带火星的木条复燃,故A正确;
B.根据分析可知,①中过氧化钠与水先发生复分解反应,生成氢氧化钠和双氧水,反应放热,少量双氧水分解,④中BaO2和稀硫酸反应,生成硫酸钡和双氧水,双氧水部分分解为氧气,同时还发烧了双氧水分解为水和氧气的反应,所以①、④中均发生了氧化还原反应,故B正确;
C.②、⑤中KMnO4与MnO2的作用相同,②中KMnO4做氧化剂,将双氧水氧化为氧气,⑤中MnO2做催化剂,使双氧水分解,故C错误;
D.④中主要发生了稀硫酸与氯化钡,生成硫酸钡和盐酸,白色沉淀的主要成分是BaSO4,故D正确;
故选:C。
11.下列说法正确的有( )
①酸性氧化物在一定条件下均能与碱发生反应
②离子方程式H++OH﹣═H2O可以表示所有强酸和强碱之间的中和反应
③溶于水后能电离出氢离子的化合物一定是酸
④某物质经分析只含有一种元素,则该物质一定是纯净物
⑤两种化合物生成另外两种化合物的反应一定是复分解反应
⑥某元素由化合态变为游离态,则它可能被还原也可能被氧化
⑦酸性氧化物不一定都是非金属氧化物,但碱性氧化物一定都是金属氧化物
A.3个B.4个C.5个D.6个
【答案】A
【解析】解:①酸性氧化物是能与碱反应生成盐和水的氧化物,所以酸性氧化物在一定条件下均能与碱发生反应,故①正确;
②离子方程式H++OH﹣=H2O可以表示所有强酸和强碱反应生成可溶性盐和水的反应,若生成难溶性盐不能用其表示,故②错误;
③溶于水后能电离出氢离子的化合物不一定是酸,如 NaHSO4,故③错误;
④某物质经分析只含有一种元素,则该物质不一定是纯净物,如氧气和臭氧的混合物,故④错误;
⑤两种化合物生成另外两种化合物的反应不一定是复分解反应,如2NaOH+CO2=Na2CO3+H2O,故⑤错误;
⑥某元素由化合态变为游离态,则它可能被还原也可能被氧化,如2H2S+SO2=3S↓+2H2O,故⑥正确;
⑦酸性氧化物不一定都是非金属氧化物,如Mn2O7,但碱性氧化物一定都是金属氧化物,故⑦正确;
综上所述,正确的数目为3,故A正确;
故选:A。
12.下列关于胶体和溶液的说法中,正确的是( )
A.许多胶体能进行电泳是因为这些胶体带电
B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
【答案】C
【解析】解:A.胶体本身不带电,但是可以吸附带电的离子形成带电的胶粒,故A错误;
B.区分胶体与其他分散系应用丁达尔效应,布朗运动是所有粒子在溶液中的运动方式,故B错误;
C.胶体能产生丁达尔效应,溶液则无丁达尔效应,故C正确;
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁沉淀,故D错误。
故选:C。
13.分类是学习化学的一种重要方法。下列分类叙述不正确的是( )
A.盐类:烧碱、氧化钙B.金属材料:钢、黄铜
C.氮肥:氯化铵、尿素D.氧化物:二氧化锰、水
【答案】A
【解析】解:A.烧碱为氢氧化钠,属于碱,氧化钙属于氧化物,故A错误;
B.金属材料包括金属单质和合金,钢和黄铜均属于金属材料,故B正确;
C.氯化铵和尿素中均含有氮元素,属于氮肥,故C正确;
D.氧化物指由两种元素组成,其中一种元素为氧元素的化合物,二氧化锰和水均属于氧化物,故D正确;
故选:A。
14.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
【答案】B
【解析】解:A.MgCl2中只含离子键,为离子化合物,故A不选;
B.CO2中只含C、O之间的极性共价键,为共价化合物,故B选;
C.HCl中只含共价键,为共价化合物,故C不选;
D.NaOH中含离子键和O﹣H极性共价键,为离子化合物,故D不选;
故选:B。
15.下列离子方程式的书写正确的是( )
A.氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣
B.食醋除水垢:+2H+═H2O+CO2↑
C.氯化铁溶液与铁反应:2Fe3++Fe═3Fe2+
D.氧化铜与稀硫酸反应:CuO+2H++═CuSO4+H2O
【答案】C
【解析】解:A.氯气溶于水,反应的离子方程式为Cl2+H2O═H++Cl﹣+HClO,故A错误;
B.食醋除水垢的离子方程式为2CH3COOH+CaCO3=2CH3COO﹣+Ca2++CO2↑+H2O,故B错误;
C.氯化铁溶液与铁生成氯化亚铁,反应的离子方程式为2Fe3++Fe═3Fe2+,故C正确;
D.氧化铜与稀硫酸反应生成硫酸铜和水,离子方程式为CuO+2H+═Cu2++H2O,故D错误;
故选:C。
16.设NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.0.2ml•L﹣1Na2SO4溶液中,Na+的数目为0.4NA
B.在常温常压下,1.6gCH4含有的原子数为0.5NA
C.标准状况下,2.24LH2O含有的共价键数为0.2NA
D.50mL12ml•L﹣1盐酸与足量MnO2共热,转移的电子数为0.3NA
【答案】B
【解析】解:A.溶液体积未知,无法计算0.2ml•L﹣1Na2SO4溶液中所含Na+的数目,故A错误;
B.1个CH4中含有5个原子,1.6gCH4的物质的量为n===0.1ml,则1.6gCH4含有的原子数为0.5NA,故B正确;
C.标况下水为液体,不能根据气体摩尔体积来计算其物质的量,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,即盐酸不能反应完全,故转移的电子数小于0.3NA个,故D错误;
故选:B。
17.下列表示反应中相关微粒的化学用语正确的是( )
A.水的电子式:
B.N2的结构式:N=N
C.CuCl2的电离:CuCl2═Cu2++
D.中子数为18的氯原子:
【答案】D
【解析】解:A.水是共价化合物,H、O原子间共用1对电子对,O原子最外层电子数为8,水的电子式为,故A错误;
B.N2分子中含有氮氮三键,结构式为N≡N,故B错误;
C.CuCl2的电离方程式为CuCl2═Cu2++2Cl﹣,故C错误;
D.中子数为18的氯原子的质量数为17+18=35,核素符号为,故D正确;
故选:D。
18.金属钛有“生物金属”之称。下列有关Ti和Ti的说法正确的是( )
A.Ti和Ti原子中均含有22个中子
B.Ti和Ti互为同位素,在元素周期表中的位置相同
C.Ti和Ti物理性质相同
D.Ti和Ti为同一核素
【答案】B
【解析】解:A.Ti含有中子数为26,Ti含中子数为28,故A错误;
B.Ti和Ti质子数相同、中子数不同,互为同位素,都为同种元素,在元素周期表中的位置相同,故B正确;
C.Ti和Ti的物理性质不同,化学性质相同,故C错误;
D.Ti和Ti的质子数不同,中子数不同,为不同核素,故D错误;
故选:B。
二.解答题(共4小题)
19.碳纳米管可以看成是由石墨片层卷成的管状物,在力学、电学等方面都具有非凡的性能。工业上用电弧法合成的碳纳米管中常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。已知氧化性:K2Cr2O7>KMnO4。
回答下列问题:
(1)碳纳米管、碳纳米颗粒与金刚石的关系为 同素异形体 ;将碳纳米颗粒均匀分散在水中,使用激光笔照射,能观察到的现象为 有一条光亮的通路 。
(2)由价态规律可知,Cr2(SO4)3具有的性质: c (填标号)。
a.仅具有氧化性
b.仅具有还原性
c.既有氧化性又有还原性
d.无法判断
(3)在上述反应中,还原剂是 C (填化学式,下同),氧化剂被还原为 Cr2(SO4)3 。该反应中H2SO4只表现酸性,为反应提供酸性环境,则在该反应中 不能 (填“能”或“不能”)用盐酸代替硫酸提供酸性环境,原因为 氧化性:K2Cr2O7>KMnO4>Cl2,K2Cr2O7能将盐酸氧化为Cl2,消耗K2Cr2O7 。
(4)将上述化学方程式改写为离子方程式: 3C+2Cr2+16H+═3CO2↑+4Cr3++8H2O 。
【解析】解:(1)碳纳米管、碳纳米颗粒与金刚石都是由C元素形成的结构不同的单质,互为同素异形体;胶体能产生丁达尔效应,可以观察到有一条光亮的通路,
故答案为:同素异形体;有一条光亮的通路;
(2)Cr2(SO4)3中Cr为+3价,为中间价态,既有氧化性也有还原性,
故答案为:c;
(3)C元素话合计由+2价变为+4价,故C为还原剂;氧化剂K2Cr2O7在反应过程中发生还原反应,被还原为Cr2(SO4)3;氧化性:K2Cr2O7>KMnO4>Cl2,盐酸中Cl﹣为最低价,具有还原性,K2Cr2O7能将盐酸氧化为Cl2,消耗K2Cr2O7,
故答案为:C;Cr2(SO4)3;不能;氧化性:K2Cr2O7>KMnO4>Cl2,K2Cr2O7能将盐酸氧化为Cl2,消耗K2Cr2O7;
(4)3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,其离子方程式为:3C+2Cr2+16H+═3CO2↑+4Cr3++8H2O,
故答案为:3C+2Cr2+16H+═3CO2↑+4Cr3++8H2O。
20.Ⅰ.对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的,现有以下物质:①CH3COOH②Cu③固体BaSO4④Fe(OH)3胶体⑤CH3CH2OH(酒精)⑥氨气⑦稀硫酸
(1)以上物质中属于混合物的是 ④⑦ (填序号,下同)。
(2)属于电解质的是 ①③ 。
Ⅱ.钠、氯及其化合物有如图转化关系,淡黄色物质M可在潜水艇中作为氧气的来源,常被用作供氧剂,N常用来杀菌消毒。请按要求填空:
(1)物质N是 NaClO (填化学式)。
(2)写出M与水反应的离子方程式为 2Na2O2+2H2O=4Na++4OH﹣+O2↑ 。
(3)除去Na2CO3固体中的少量杂质NaHCO3写出相关反应的化学方程式 2NaHCO3Na2CO3+CO2↑+H2O 。
(4)加热4.00gNa2CO3和NaHCO3的固体混合物,使NaHCO3完全分解,固体混合物的质量减少了0.31g,则原混合物中Na2CO3的质量为 3.16 g。
(5)检验某溶液中是否含有Cl﹣的方法是 取样,滴入适量稀硝酸酸化,然后滴入AgNO3溶液,若产生白色沉淀,则可判断该溶液中含有Cl﹣ 。
Ⅱ.【解析】解:Ⅰ.①CH3COOH是纯净物,溶于水导电,属于电解质,②Cu是金属单质为纯净物,既不是电解质也不是非电解质,③固体BaSO4纯净物,溶于水不导电,熔融状态导电,属于电解质,④Fe(OH)3胶体是混合物,既不是电解质也不是非电解质,⑤CH3CH2OH(酒精)是纯净物,不能电离属于非电解质,⑥氨气⑦稀硫酸是混合物,既不是电解质也不是非电解质,
(1)属于混合物的是:④⑦,
故答案为:④⑦;
(2)属于电解质的是:①③,
故答案为:①③;
Ⅱ.钠、氯及其化合物有如下转化关系,淡黄色物质M可在潜水艇中作为氧气的来源,常被用作供氧剂,N常用来杀菌消毒,钠和O2常温反应生成Na2O,Na和O2加热反应生成淡黄色物质M为Na2O2,Na2O和H2O反应生成NaOH,Na2O2和H2O反应生成NaOH、O2,NaOH和HCl反应生成NaCl和物质N(NaClO),Cl2和NaOH反应生成NaCl,Cl2和Fe反应生成FeCl3,NaClO溶液和CO2、H2O反应生成HClO,Cl2和H2O反应生成HClO。
(1)分析可知,N常用来杀菌消毒,N是NaClO,
故答案为:NaClO;
(2)M与水反应的离子方程式为:2Na2O2+2H2O=4Na++4OH﹣+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH﹣+O2↑;
(3)除去Na2CO3固体中的少量杂质NaHCO3写出相关反应的化学方程为:2NaHCO3Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3Na2CO3+CO2↑+H2O;
(4)加热碳酸钠和碳酸氢钠的混合物,碳酸氢钠完全分解,根据反应的方程式,利用差量法计算,设混合物中含有xgNaHCO3,则
2NaHCO3Na2CO3+CO2↑+H2O△m
2×84 62
xg 0.31g
解之得:x=0.84g,
所以:m(Na2CO3)=4.0g﹣m(NaHCO3)=4.0g﹣0.84g=3.16g,
故答案为:3.16;
(5)氯离子和银离子能生成不溶于酸的氯化银沉淀,故为:取样,滴入适量稀硝酸酸化,然后滴入AgNO3溶液,若产生白色沉淀,则可判断该溶液中含有Cl﹣,
故答案为:取样,滴入适量稀硝酸酸化,然后滴入AgNO3溶液,若产生白色沉淀,则可判断该溶液中含有Cl﹣。
21.完成下列问题。
(1)32.0gO2和2.0gH2组成的混合气体在标准状况下体积约为 44.8 L。
(2)标准状况下3.36L某气体的质量为8.1g,则该气体的摩尔质量为 54g/ml 。
(3)将200mL0.5ml•L﹣1BaCl2溶液与300mL0.2ml•L﹣1AlCl3溶液混合,则所得混合溶液中Cl﹣的物质的量浓度为 0.76 ml•L﹣1(忽略混合前后溶液体积的变化)。
(4)现有14.4g由CO和CO2组成的混合气体,在标准状况下所占的体积约为8.96L。回答下列问题:
①该混合气体中CO的物质的量为 0.2 ml。
②混合气体中碳原子的个数为 0.4NA 。
(5)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有 氧化 性。下列不能实现上述转化的物质是 C (填字母)。
A.Cl2
B.O2
C.FeCl3
D.KMnO4(H+)
(6)ClO2是一种广谱型的消毒剂,将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,反应中氧化剂和还原剂的个数比为 2:1 。
(7)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应。用单线桥法表示上述反应中电子得失的方向和数目: 。
【解析】解:(1)n(O2)+n(H2)=+=2ml,V=nVm=2ml×22.4L/ml=44.8L,
故答案为:44.8;
(2)M=====54g/ml,
故答案为:54g/ml;
(3)混合溶液中c(Cl﹣)===0.76ml/L,
故答案为:0.76;
(4)①n(CO)+n(CO2)==0.4ml,设n(CO)=xml、n(CO2)=yml,,,该混合气体中CO的物质的量为0.2ml,
故答案为:0.2;
②混合气体中n(C)=n(CO)+n(CO2)=0.4ml,N(C)=n(C)NA=0.4NA,
故答案为:0.4NA;
(5)该反应中Fe元素的化合价由+2价变为+3价,则Fe2+作还原剂,NaNO2作氧化剂,体现氧化性;不能实现上述转化,说明该物质不能氧化亚铁离子,ABD都能氧化亚铁离子,只有FeCl3不能氧化亚铁离子,
故答案为:氧化;C;
(6)该反应方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,则NaClO3为氧化剂、Na2SO3为还原剂,其计量数之比等于个数之比,所以该反应中氧化剂和还原剂的个数之比为2:1,
故答案为:2:1;
(7)Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,该反应中1ml Fe反应转移3ml电子,则电子转移方向和数目为,
故答案为:。
22.对于数以千万计的化学物质和如此丰富的化学变化,分类法的作用几乎是无可替代的。已知有下列物质:
①Ca②熔融CaO③Ca(OH)2固体④干冰(CO2)⑤酒精(C2H5OH)⑥稀硫酸⑦稀氨水⑧有色玻璃⑨稀醋酸⑩小苏打粉末(NaHCO3)⑪Fe(OH)3胶体
请回答:
(1)属于酸式盐的有 ⑩ (填序号,下同),属于胶体的有 ⑧⑪ 。
(2)能导电的物质有 ①②⑥⑦⑨⑪ ,不能导电的电解质有 ③⑩ ,非电解质有 ④⑤ 。
(3)将⑥的水溶液逐滴加入到⑪中的现象是 先生成红褐色沉淀,随着硫酸的不断加入,沉淀溶解,溶液变黄色 。
(4)写出下列反应的离子方程式。
Ⅰ.⑥与⑦反应: H++NH3•H2O=+H2O 。
Ⅱ.向③的溶液中加入过量⑩的溶液: Ca2++2+2OH﹣=CaCO3↓+2H2O+ 。
(5)通常情况下,在弱酸及弱碱的稀溶液中,弱酸、弱碱的电离程度均较小,据此可判断,向⑨中逐滴加入⑦直至过量,溶液的导电能力[电流(Ⅰ)]随⑦的滴入量[质量(m)]的变化趋势正确的是 A (填标号)。
(6)H3PO4是三元酸,能与NaOH反应生成NaH2PO4、Na2HPO4两种酸式盐和Na3PO4一种正盐。磷还有一种含氧酸叫亚磷酸(H3PO3),是二元弱酸,那么Na2HPO3为 正盐 (填“正盐”或“酸式盐”)。
【解析】解:(1)属于酸式盐的是⑩小苏打粉末(NaHCO3),属于胶体的是⑧有色玻璃、⑪Fe(OH)3胶体,
故答案为:⑩;⑧⑪;
(2)能导电的物质有:①Ca、②熔融CaO、⑥稀硫酸、⑦稀氨水、⑨稀醋酸、⑪Fe(OH)3胶体,不能导电的电解质有:③Ca(OH)2固体、⑩小苏打粉末(NaHCO3),非电解质为:④干冰(CO2)、⑤酒精(C2H5OH),
故答案为:①②⑥⑦⑨⑪;③⑩;④⑤;
(3)将⑥的水溶液逐滴加入到⑪中,胶体先聚沉,后溶解,发生的现象为:先生成红褐色沉淀,随着硫酸的不断加入,沉淀溶解,溶液变黄色,
故答案为:先生成红褐色沉淀,随着硫酸的不断加入,沉淀溶解,溶液变黄色;
(4)Ⅰ.⑥稀硫酸和⑦稀氨水反应生成硫酸铵和水,反应的离子方程式为:H++NH3•H2O=+H2O,
故答案为:H++NH3•H2O=+H2O;
Ⅱ.向③Ca(OH)2的溶液中加入过量⑩小苏打粉末(NaHCO3)的溶液,Ca(OH)2完全反应,反应的离子方程式为:Ca2++2+2OH﹣=CaCO3↓+2H2O+,
故答案为:Ca2++2+2OH﹣=CaCO3↓+2H2O+;
(5)CH3COOH溶液中滴入氨水至过量,发生反应的离子方程式为:CH3COOH+NH3•H2O=CH3COO﹣++H2O,随着反应的进行,溶液中离子浓度逐渐增大,溶液的导电性逐渐增强,当CH3COOH和+NH3•H2O恰好完全反应时,再滴加氨水,离子的数量没有明显的增加,但溶液的体积增大,则离子浓度减小,溶液的导电能力减弱,故与A图变化趋势一致,
故答案为:A;
(6)H3PO4是三元酸,能与NaOH反应生成NaH2PO4、Na2HPO4两种酸式盐和Na3PO4一种正盐,磷还有一种含氧酸叫亚磷酸(H3PO3),是二元弱酸,那么Na2HPO3为正盐,
故答案为:正盐。
选项
描述Ⅰ
描述Ⅱ
A
CO2和NH3的水溶液能够导电
CO2、NH3均为电解质
B
Na2O的水溶液能导电
Na2O为电解质
C
H2SO4在水溶液中能电离出自由移动的离子
H2SO4为电解质
D
Cu单质能够导电
Cu为电解质
选 项
A
B
C
D
物 质
MgCl2
CO2
HCl
NaOH
所含化学键类型
离子键、共价键
共价键
离子键
离子键、共价键
所属化合物类型
离子化合物
共价化合物
离子化合物
共价化合物
选项
描述Ⅰ
描述Ⅱ
A
CO2和NH3的水溶液能够导电
CO2、NH3均为电解质
B
Na2O的水溶液能导电
Na2O为电解质
C
H2SO4在水溶液中能电离出自由移动的离子
H2SO4为电解质
D
Cu单质能够导电
Cu为电解质
选 项
A
B
C
D
物 质
MgCl2
CO2
HCl
NaOH
所含化学键类型
离子键、共价键
共价键
离子键
离子键、共价键
所属化合物类型
离子化合物
共价化合物
离子化合物
共价化合物
相关试卷
这是一份河北省2024-2025学年高一下学期开学适应性模拟测试化学试题(解析版),共32页。试卷主要包含了下列说法正确的是,用氯金酸钠,下列说法不正确的是等内容,欢迎下载使用。
这是一份广东省广州市2024-2025学年高一下学期开学适应性模拟测试化学试题(解析版),共23页。试卷主要包含了下列物质分类的选项正确组合是,唐诗中往往蕴含丰富的化学知识等内容,欢迎下载使用。
这是一份福建省2024-2025学年高一下学期开学适应性模拟测试化学试题(解析版),共27页。试卷主要包含了下列物质分类正确的是,我国稀土资源丰富,某化学小组用“84消毒液”,下列说法正确的是等内容,欢迎下载使用。









