












所属成套资源:人教版高中化学同步选择性必修第一册课件PPT+讲义+专练(新教材)
- 第一章 体系构建 高考体验--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第一节 第1课时 化学反应速率--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第一节 第3课时 活化能--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第一节 第4课时 反应机理、变量控制与图像分析--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第二节 第1课时 化学平衡状态--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
人教版 (2019)选择性必修1第一节 化学反应速率优秀ppt课件
展开
这是一份人教版 (2019)选择性必修1第一节 化学反应速率优秀ppt课件,文件包含第二章第一节第2课时影响化学反应速率的因素pptx、第二章第一节第2课时影响化学反应速率的因素专练docx、第二章第一节第2课时影响化学反应速率的因素教师版docx、第二章第一节第2课时影响化学反应速率的因素学习笔记docx、催化剂对化学反应速率的影响实验mp4、测量锌与硫酸反应速率实验mp4、温度对反应速率的影响mp4等7份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第2课时 影响化学反应速率的因素
1.通过实验,从宏观上认识外界因素影响化学反应速率的规律。2.建立分析探究外界因素影响化学反应速率的思维模型。3.通过定性与定量研究影响化学反应速率的因素,提高学生设计探究方案、进 行实验探究的能力。
核心素养 发展目标
一、实验探究影响化学反应速率的外界因素
二、外界因素对化学反应速率的影响
实验探究影响化学反应速率的外界因素
Ⅰ、定性研究影响化学反应速率的因素1.科学研究的基本步骤提出问题→收集化学事实与信息→提出假设→设计实验方案→实验探究→得出结论
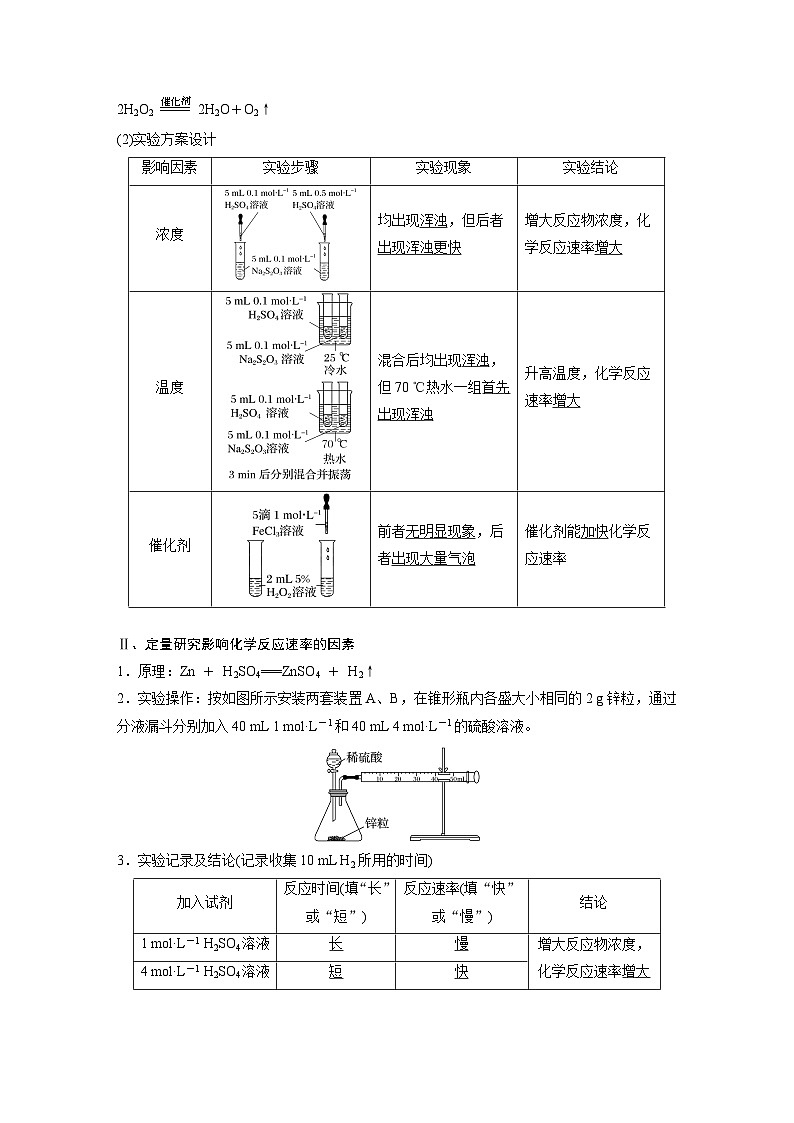
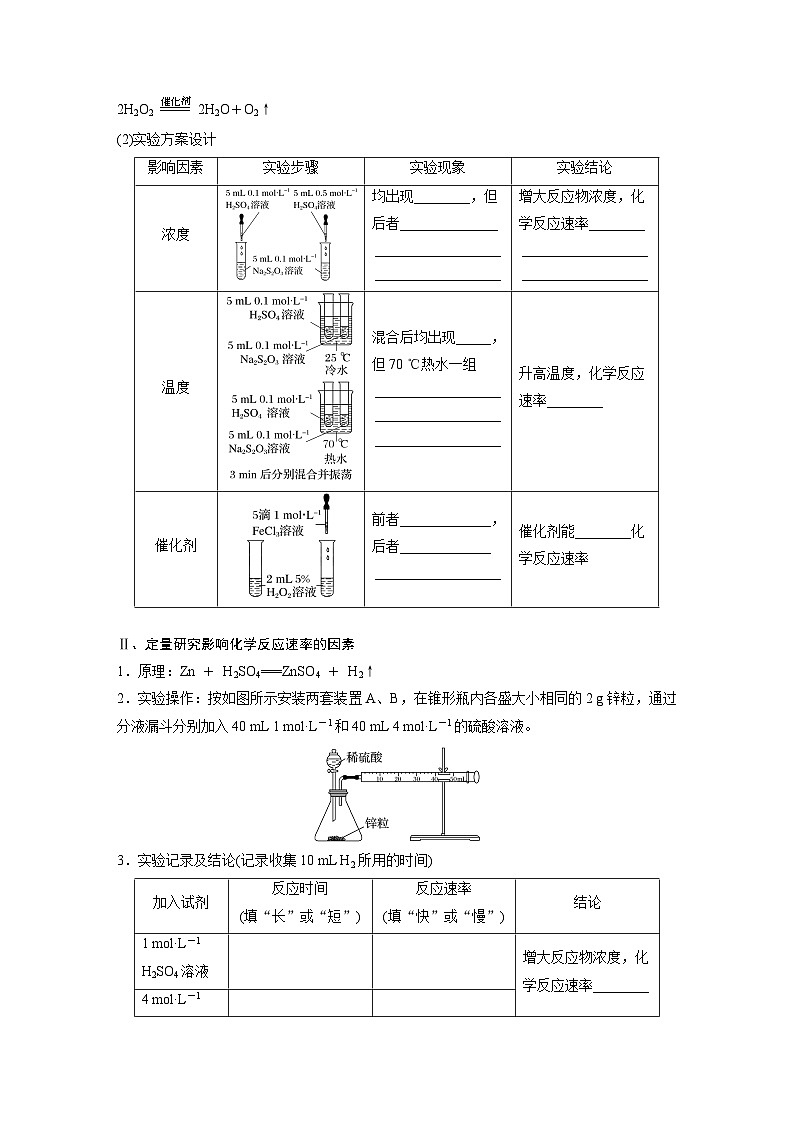
2.化学反应速率的定性描述能体现化学反应速率的反应现象有:颜色 快慢,产生气泡 ,产生浑浊快慢,固体减少快慢等。3.定性研究影响化学反应速率的因素(1)实验原理Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
Ⅱ、定量研究影响化学反应速率的因素1.原理:Zn + H2SO4===ZnSO4 + H2↑2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 ml·L-1和40 mL 4 ml·L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
4.实验拓展探究在用上述实验测定锌与硫酸反应的速率时:(1)为确保测定的准确性,应注意哪些事项?______________________________________________________________________________________ 。(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________ 。
锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?________________________________________________________________________________________________________________
在恒容反应装置中,测定一段时间内压强的变化;测定一段时间内H+的浓度变化;测定一段时间内锌粒的质量变化等。
(1)任何化学反应都可以通过反应现象判断化学反应的快慢(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较
(3)可用装置 测定过氧化氢分解的化学反应速率
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为________________________。
溶液中的Cl- 起催化作用
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 ml·L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃;若加入1 mL 0.1 ml·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果___________________。
MnO2>Fe3+>Cu2+
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
回答下列问题:(1)V1=____,V2=____。
(2)设计实验方案①和②的目的是:________________________________________。
探究Na2S2O3的浓度对化学反应速
(3)设计实验方案②和④的目的是:______________________________。
探究温度对化学反应速率的影响
(4)各实验方案中均需加入一定体积的水的原因:________________________________。
1.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
A.5 mL 2% H2O2溶液B.10 mL 2% H2O2溶液C.10 mL 5% H2O2溶液D.5 mL 10% H2O2溶液
2.草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是____(填字母)。A.可能明显加快B.可能明显减慢C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
①该反应的离子方程式为__________________________________________________。
6H+===2Mn2++10CO2↑+8H2O
②该实验探究的是__________对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________(用实验序号填空)。
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min 末c( )=_______ ml·L-1(假设混合液体积为50 mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①___________________;②___________________________________。
产物Mn2+(或MnSO4)是反应的催化剂
1.实验探究的科学方法及思路变量控制→对照实验→定性观察或定量测定→科学归纳2.控制变量探究实验题的思维流程
外界因素对化学反应速率的影响
1.浓度增大反应物的浓度,化学反应速率 ;减小反应物的浓度,化学反应速率 。注意事项 ①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
2.压强增大压强,引起气体反应物浓度 ,化学反应速率 ;减小压强,引起气体反应物浓度 ,化学反应速率 。注意事项 压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
3.温度升高温度,化学反应速率 ;降低温度,化学反应速率 。注意事项 温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
4.催化剂催化剂同等程度的影响正、逆反应速率,正催化剂 化学反应速率,逆催化剂 化学反应速率。5.其他因素接触面积、溶剂的性质、光、超声波、磁场、形成原电池等均能影响化学反应速率。注意 实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
(1)增加少量固体反应物的质量,化学反应速率增大(2)100 mL 2 ml·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变(3)升高温度,吸热反应速率会加快而放热反应速率会减慢
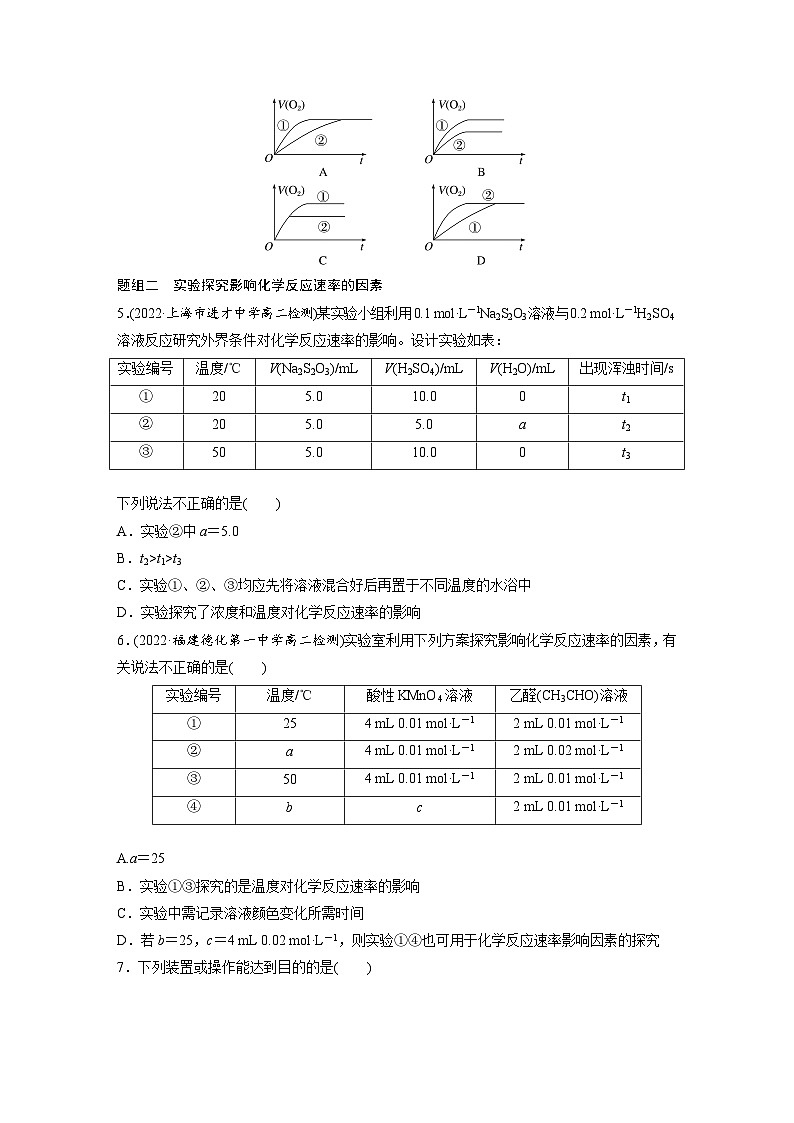
(4)恒容体系发生反应:2SO2+O2 2SO3 ΔHt1>t3C.实验①、②、③均应先将溶液混合好后再置于不同温度的水浴中D.实验探究了浓度和温度对化学反应速率的影响
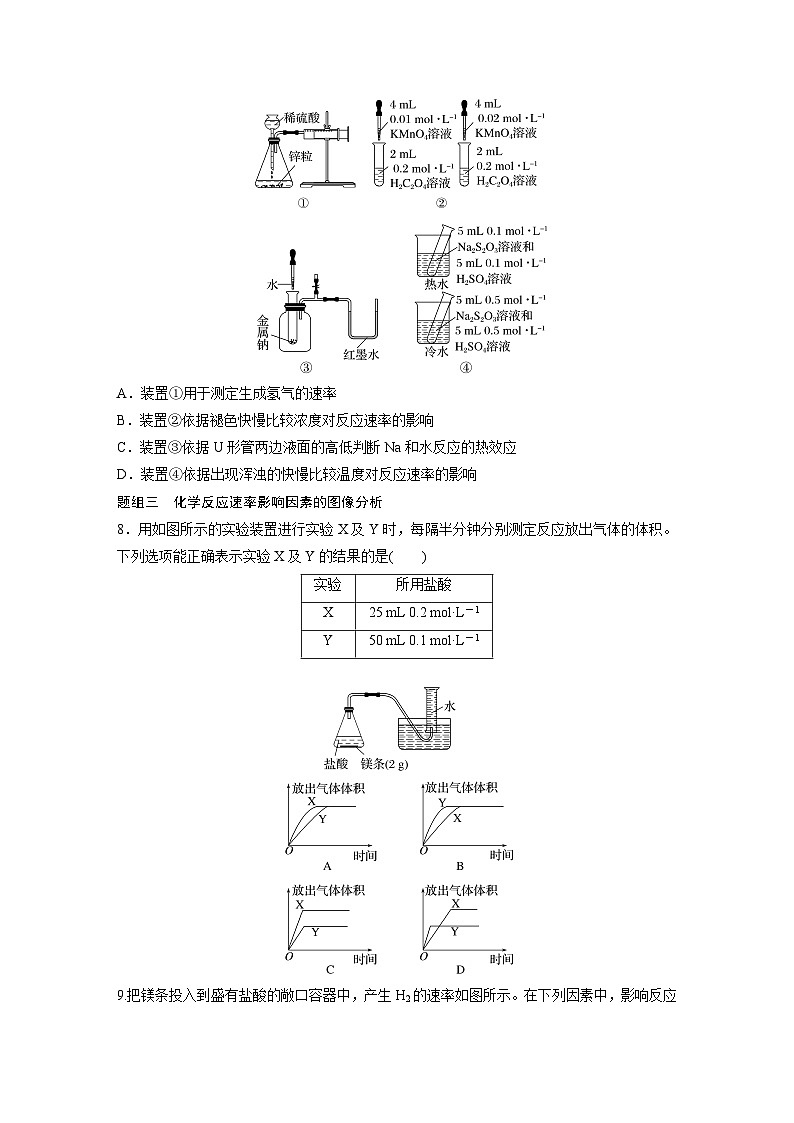
6.(2022·福建德化第一中学高二检测)实验室利用下列方案探究影响化学反应速率的因素,
有关说法不正确的是A.a=25B.实验①③探究的是温度对化学反应速率的影响C.实验中需记录溶液颜色变化所需时间D.若b=25,c=4 mL 0.02 ml·L-1,则实验①④也可用于化学反应速率 影响因素的探究
7.下列装置或操作能达到目的的是
A.装置①用于测定生成氢气的速率B.装置②依据褪色快慢比较浓度对反应速率的影响C.装置③依据U形管两边液面的高低判断Na和水反应的热效应D.装置④依据出现浑浊的快慢比较温度对反应速率的影响
题组三 化学反应速率影响因素的图像分析8.用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定反应放出气体的体积。下列选项能正确表示实验X及Y的结果的是
9.把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示。在下列因素中,影响反应速率的因素是①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度A.①④ B.③④C.①②③ D.②③
10.用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,
下列说法错误的是A.实验②在前15 min内,M的降解速率最快B.实验①②说明升高温度,M的降解速率增大C.实验①③说明pH越高,越不利于M的降解D.实验②④说明M的浓度越小,降解的速率越慢
11.对于溶液中的反应:2KMnO4+10FeSO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,下列措施一定能使反应速率提高的是A.加水B.加入同浓度的FeSO4溶液C.向溶液中滴加稀硫酸D.加入少量的高锰酸钾固体
12.某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响。实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是: ,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
下列判断不正确的是A.最先出现蓝色的一组是实验③B.实验①③中V1=40,V2=10C.探究温度对化学反应速率的影响应该选择实验①②D.出现蓝色的时间:t3>t2>t1
13.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:(1)该反应的离子方程式为____________________________。
4H++4I-+O2===2I2+2H2O
(2)该实验的目的是________________________________。
(3)实验试剂除了1 ml·L-1 KI溶液、0.1 ml·L-1 H2SO4溶液外,还需要的试剂是___________,实验现象为_______________。
(4)实验操作中除了需要上述条件外,还必须控制______(填字母)不变。A.温度 B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是_____________________________________。
温度每升高10 ℃,反应速率约增大
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的措施是____________________________________________________________。
保证其他实验条件不变,采用不同浓度的H2SO4溶液进行对比实验
14.甲、乙两个实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4酸化):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。某同学进行实验,实验装置如图。
其中A、B的成分见下表:
(1)该反应的离子方程式为_________________________________________________。
+6H+===2Mn2++10CO2↑+8H2O
实验结束后读数前需要移动量气管,使两个量气管的液面相平。
乙组:通过测定KMnO4溶液褪色所需的时间来比较化学反应速率的大小。为了探究KMnO4溶液与H2C2O4溶液浓度对反应速率的影响,某同学在室温下完成以下实验:
(2)x=____,4号实验中始终没有观察到溶液褪色,你认为可能的原因是_________________。
(3)2号实验中,用H2C2O4表示的反应速率为____________________(反应后溶液的总体积变化忽略不计)。
0.006 25 ml·L-1·s-1
(4)在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是反应放热导致溶液温度升高,再次进行3号实验,测定反应过程中不同时间溶液的温度,结果如下表:
①结合实验目的与表中数据,你得出的结论是________________________________。
温度不是反应速率突然加
②从影响化学反应速率的因素看,你认为还可能是________的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是____(填字母)。a.硫酸钾 b.水c.二氧化锰 d.硫酸锰
15.(2022·北京市顺义区第一中学高二检测)某小组研究了铜片与5.6 ml·L-1 HNO3反应的速率,实现现象记录如下表。
为探究影响该反应速率的主要因素,小组进行如下实验。实验Ⅰ:监测上述反应过程中溶液温度变化,得曲线如图。
实验Ⅱ:②~④试管中加入大小、形状相同的铜片和相同体积5.6 ml·L-1 HNO3。结果显示:Cu(NO3)2、NO对Cu和HNO3反应速率的影响均不明显,NO2能明显加快该反应的速率。
实验Ⅲ:在试管中加入铜片和5.6 ml·L-1 HNO3,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有 。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:______________________。
(2)实验Ⅰ的结论:温度升高________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验Ⅱ的目的是___________________________________________________。
检验Cu(NO3)2、NO、
NO2能否加快铜和硝酸反应的速率
相关课件
这是一份化学选择性必修1第一节 化学反应速率精品ppt课件,文件包含第二章第一节第1课时化学反应速率pptx、第二章第一节第1课时化学反应速率专练docx、第二章第一节第1课时化学反应速率教师版docx、第二章第一节第1课时化学反应速率学习笔记docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三节 化学反应的方向完美版ppt课件,文件包含第二章第三节化学反应的方向pptx、第二章第三节化学反应的方向专练docx、第二章第三节化学反应的方向教师版docx、第二章第三节化学反应的方向学习笔记docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 化学反应速率优秀ppt课件,文件包含第二章第二节第6课时化学反应速率与平衡图像1pptx、第二章第二节第6课时化学反应速率与平衡图像1专练docx、第二章第二节第6课时化学反应速率与平衡图像1教师版docx、第二章第二节第6课时化学反应速率与平衡图像1学习笔记docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。










