














所属成套资源:人教版高中化学同步选择性必修第一册课件PPT+讲义+专练(新教材)
- 第一章 第一节 第2课时 热化学方程式 燃烧热--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第一章 第二节 第1课时 反应热的计算--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第一章 第二节 第2课时 ΔH的大小比较及热化学方程式的再书写--人教版高中化学选择性必修第一册同步讲练测(新教材) 试卷 0 次下载
- 第一章 章末检测试卷(一)--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第一章 体系构建 高考体验--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
化学选择性必修1第一节 反应热精品ppt课件
展开
这是一份化学选择性必修1第一节 反应热精品ppt课件,文件包含第一章第一节第1课时反应热焓变pptx、第一章第一节第1课时反应热焓变专练docx、第一章第一节第1课时反应热焓变教师版docx、第一章第一节第1课时反应热焓变学习笔记docx、中和反应反应热测定实验mp4等5份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第1课时 反应热 焓变
1.理解反应热测定的原理和方法,会分析产生误差的原因,不断完善和改进测 定方法。2.能从宏观和微观的角度理解化学反应中能量变化的本质,正确认识和判断放 热反应和吸热反应。3.能辨识化学反应中的能量转化形式,形成能量可以相互转化的观念,正确理 解反应热和焓变的概念。
核心素养 发展目标
1.体系(系统)与环境被研究的物质及发生的反应称为_____;与体系相互影响的其他部分称为_____。2.反应热(1)因温度不同而在体系与环境之间交换或传递的能量是_____。(2)在_____条件下,化学反应体系向环境_____或从环境_____的热量,称为化学反应的热效应,简称_______。(3)许多反应热可以通过_______直接测定,即根据测得的体系的________和有关物质的_______等来计算。
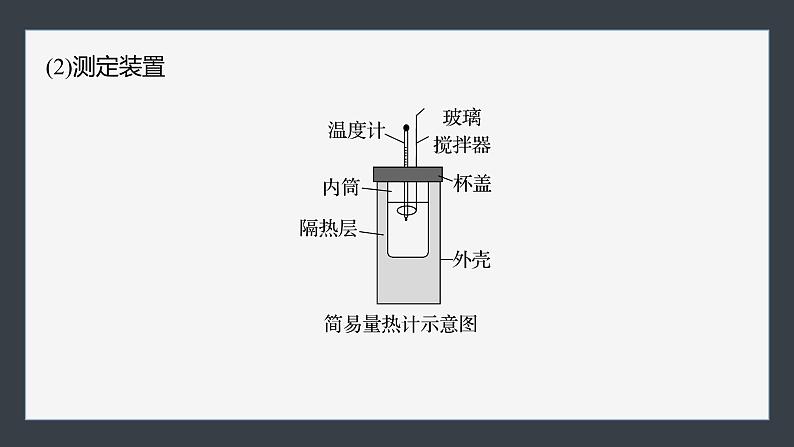
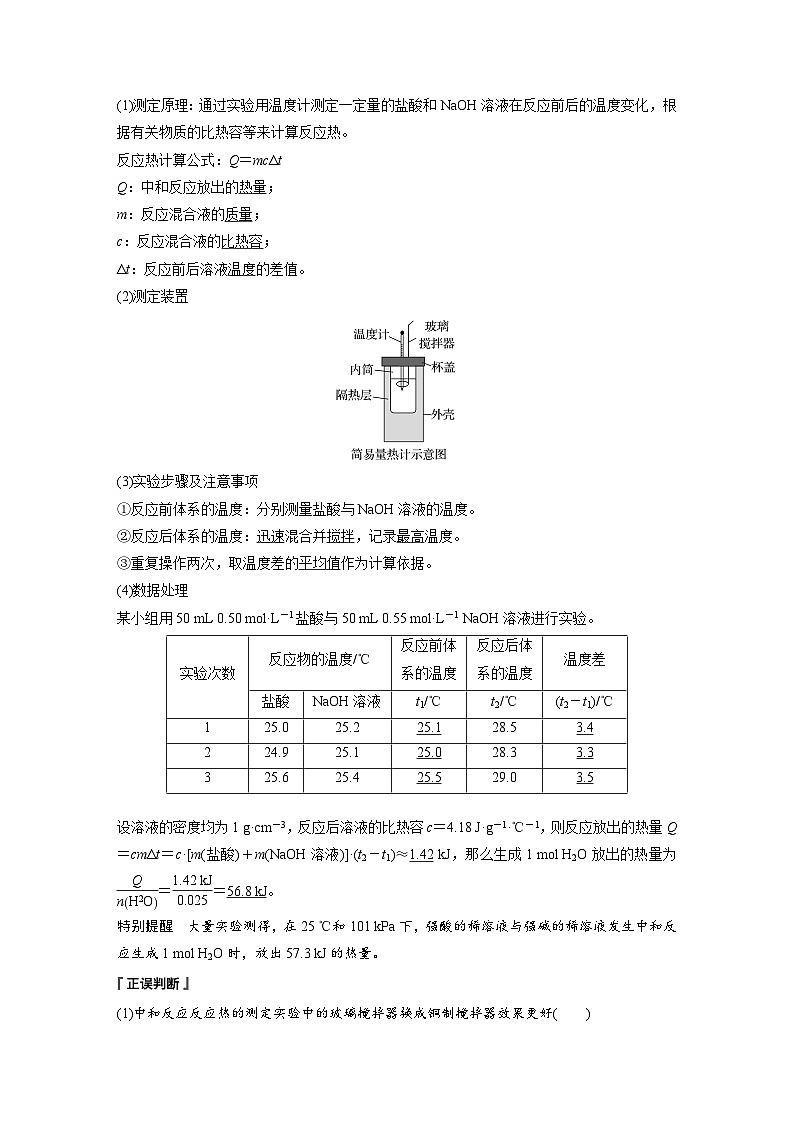
3.实验探究——中和反应反应热的测定(1)测定原理:通过实验用温度计测定一定量的盐酸和NaOH溶液在反应前后的温度变化,根据有关物质的比热容等来计算反应热。反应热计算公式:Q=mcΔtQ:中和反应放出的_____;m:反应混合液的_____;c:反应混合液的_______;Δt:反应前后溶液_____的差值。
(3)实验步骤及注意事项①反应前体系的温度:分别测量盐酸与NaOH溶液的温度。②反应后体系的温度:_____混合并_____,记录_____温度。③重复操作两次,取温度差的_______作为计算依据。
(4)数据处理某小组用50 mL 0.50 ml·L-1盐酸与50 mL 0.55 ml·L-1 NaOH溶液进行实验。
设溶液的密度均为1 g·cm-3,反应后溶液的比热容c=4.18 J·g-1·℃-1,则反应放出的热量Q=cmΔt=c·[m(盐酸)+m(NaOH溶液)]·(t2-t1)≈_____kJ,那么生成1 ml H2O放出的热量为 =_______=______。特别提醒 大量实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 ml H2O时,放出57.3 kJ的热量。
(1)中和反应反应热的测定实验中的玻璃搅拌器换成铜制搅拌器效果更好(2)实验中测定反应前后温度变化的温度计可以更换(3)中和反应反应热的测定实验中,测定盐酸后的温度计没有冲洗干净,立即测NaOH溶液的温度(4)中和反应反应热的测定实验中,应将50 mL 0.55 ml·L-1 NaOH溶液分多次倒入小烧杯
(1)为了保证盐酸完全被中和,采用稍过量的NaOH溶液。(2)测量完盐酸的温度后,温度计应冲洗干净并擦干。(3)酸碱溶液一次迅速混合。
1.大量的实验测得,25 ℃和101 kPa下,强酸和强碱稀溶液发生中和反应生成1 ml水时,放出57.3 kJ的热量。测得的数据小于57.3,分析产生误差的可能原因是什么?
2.若改用100 mL 0.50 ml·L-1的盐酸与100 mL 0.55 ml·L-1 NaOH溶液混合,所测中和反应反应热的数值是否为本实验结果的2倍?
提示 否;中和反应反应热是指在稀溶液中强酸与强碱发生中和反应生成1 ml H2O时的反应热,其数值与反应物的量的多少无关,故所测结果应与本次实验结果基本相同。
3.若用NaOH固体代替NaOH溶液,对结果会产生什么影响?
提示 NaOH固体溶于水时放热,使测得的反应热的数值偏大。
4.用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,对结果会产生什么影响?
提示 浓硫酸溶于水时放热,使所测反应热的数值偏大;弱酸、弱碱电离时吸热,使所测反应热的数值偏小;若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,生成BaSO4沉淀时还会放出一部分热量,使所测反应热的数值偏大。
1.下列有关中和反应反应热测定实验的说法正确的是A.温度计能代替玻璃搅拌器,用于搅拌反应物B.强酸与强碱反应生成1 ml H2O(l)释放的热量都约为57.3 kJC.测定中和反应反应热的实验中,读取混合溶液不再变化的温度为终 止温度D.某同学通过实验测得盐酸和NaOH溶液反应生成1 ml H2O(l)时,放 出的热量为52.3 kJ,造成这一结果的原因不可能是所用酸、碱溶液 浓度过大
2.50 mL 0.50 ml·L-1的盐酸与50 mL 0.55 ml·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是__________。(2)隔热层的作用是___________________________。(3)倒入NaOH溶液的正确操作是____(填字母)。a.沿玻璃棒缓慢倒入 b.分三次少量倒入 c.一次迅速倒入
减少实验过程中的热量损失
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成的溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生的实验记录数据如下:
完成表格并依据该学生的实验数据,计算该实验中生成1 ml水时放出的热量为______ kJ(结果保留一位小数)。
1.宏观角度认识反应热(1)内能:体系内物质的各种____的总和,受温度、压强和物质的聚集状态等影响。(2)焓与焓变
注意 等压条件下进行的化学反应,其反应热等于反应的焓变。
(3)ΔH与吸热反应和放热反应
ΔH=________总能量-_______总能量。
2.微观角度理解反应热(1)化学反应的实质和特征
(2)以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明,如图所示:
(键能:在25 ℃和101 kPa下,气态分子中1 ml化学键解离成气态原子所吸收的能量。)ΔH=_________________________________________________________,ΔH=________总键能-_______总键能。
(436+243) kJ·ml-1-(431+431) kJ·ml-1=-183 kJ·ml-1
特别提醒 化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
(1)化学变化中的能量变化都是化学能与热能间的相互转化(2)所有的化学反应都伴有能量的变化(3)伴有能量变化的一定是化学反应(4)加热条件下发生的反应均为吸热反应(5)在一个化学反应中,当反应物总焓大于生成物的总焓时,反应放热,ΔH为负值(6)浓硫酸溶于水时,体系的温度升高,该过程属于放热反应(7)石墨转化为金刚石需要吸收能量,所以石墨更稳定
(1)吸热反应和放热反应均为化学变化。(2)吸热反应和放热反应与反应条件没有必然联系,需要加热的反应也可能是放热反应。(3)一般来说,物质具有的能量越低,物质越稳定;物质内的总键能越大,物质越稳定。
1.已知:H2(g)+ O2(g)===H2O(g),反应过程中的能量变化如图所示,回答下列问题。
(1)a、b、c分别代表什么意义?a:___________________;b:___________________;c:_______。
(2)该反应是_____(填“放热”或“吸热”)反应,ΔH___(填“>”或“
相关课件
这是一份人教版 (2019)选择性必修1第一节 反应热示范课ppt课件,共58页。PPT课件主要包含了一反应热及其测定,温度变化,比热容,盐酸完全被中和,二反应热与焓变,物质的聚集状态,kJmol,kJ·mol-1,E1-E2,搅拌使溶液充分混合等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 反应热教课课件ppt,共60页。
这是一份高中化学人教版 (2019)选择性必修1第一节 反应热评优课ppt课件,文件包含高中化学新教材同步选择性必修第1册第01讲反应热焓变PPT课件pptx、高中化学新教材同步选择性必修第1册第01讲反应热焓变教师版docx、高中化学新教材同步选择性必修第1册第01讲反应热焓变学生版docx等3份课件配套教学资源,其中PPT共47页, 欢迎下载使用。










