












所属成套资源:人教版高中化学同步选择性必修第二册课件PPT+讲义+专练(新教材)
- 第二章 第二节 第2课时 杂化轨道理论--人教版高中化学选择性必修第二册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第二节 微专题3 分子(或离子)空间结构与杂化轨道理论--人教版高中化学选择性必修第二册同步讲练测(新教材) 试卷 0 次下载
- 第二章 第三节 第2课时 分子间的作用力 分子的手性--人教版高中化学选择性必修第二册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第三节 第3课时 分子结构对物质性质的影响--人教版高中化学选择性必修第二册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 体系构建 体验高考--人教版高中化学选择性必修第二册同步课件+讲义+专练(新教材) 课件 0 次下载
高中化学人教版 (2019)选择性必修2第一节 共价键获奖ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键获奖ppt课件,文件包含第三节第1课时共价键的极性pptx、第二章第三节第1课时共价键的极性专练docx、第二章第三节第1课时共价键的极性教师版docx、第二章第三节第1课时共价键的极性学习笔记docx、极性分子swf、非极性分子swf等6份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
键的极性和分子的极性 / 键的极性对化学性质的影响 / 随堂演练 知识落实 / 课时对点练
核心素养 发展目标
1.能从微观角度理解共价键的极性和分子极性的关系。
2.通过键的极性对物质性质的影响的探析,形成“结构决定性质”的认知模型。
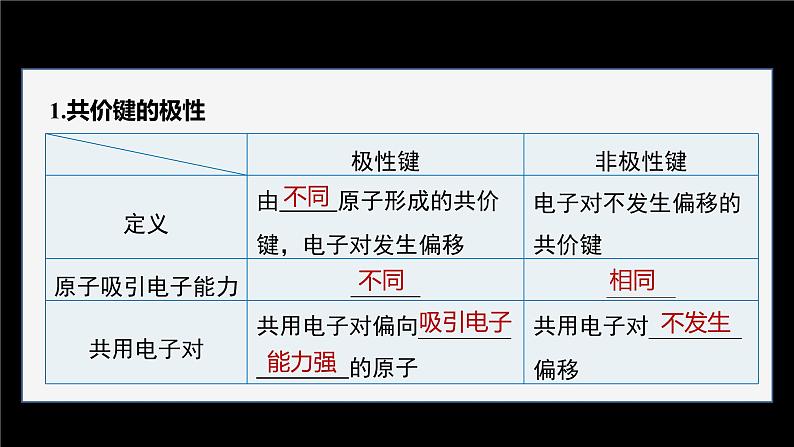
一、键的极性和分子的极性
二、键的极性对化学性质的影响
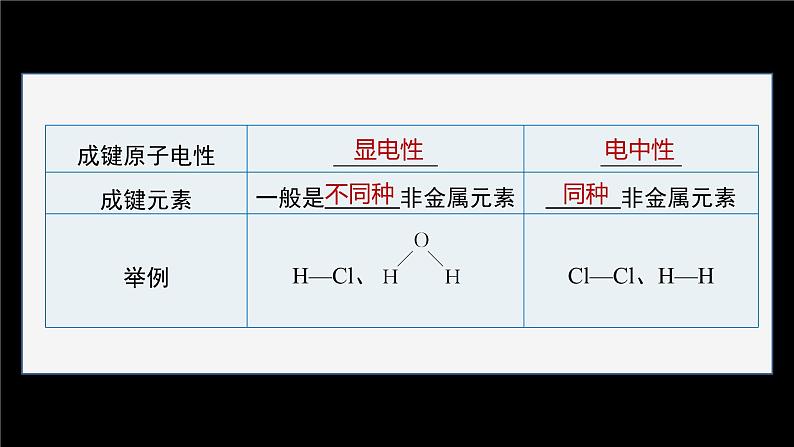
说明:(1)根据元素电负性的大小判断共价键中键合原子的电性。形成共价键的两个原子,电负性大的原子呈负电性(用δ-表示),电负性小的原子呈正电性(用δ+表示)。(2)电负性差值越大的两原子形成的共价键的极性越强。
2.分子的极性(1)极性分子与非极性分子
(2)含 键的双原子分子是极性分子,含 键的双原子分子是非极性分子。
(3)判断ABn型分子的极性①完成下表:
②认真研究①中各分子中心原子的化合价,寻找中心原子的化合价与分子极性的关系。
提示 中心原子的化合价呈最高价的ABn型分子为非极性分子,否则为极性分子。
(4)探究判断下列分子是极性分子还是非极性分子。①P4(白磷) ②CH2==CH2 ③CH≡CH④C2H5OH ⑤极性分子:_____(填序号,下同);非极性分子:__________。
(1)以非极性键结合的双原子分子一定是非极性分子( )(2)以极性键结合的分子一定是极性分子( )(3)非极性分子只能是双原子单质分子( )(4)非极性分子中,一定含有非极性共价键( )(5)极性分子中不可能含有极性键( )
1.键的极性与分子极性有何关系?
提示 ①只含有非极性键的分子一定是非极性分子,如P4。②含极性键的分子,如果分子结构是空间对称的,则为非极性分子,否则为极性分子。③注意:含有非极性键的分子不一定是非极性分子(如H2O2);极性分子中不一定只含有极性键(如CH3CH2OH)。
2.臭氧是极性分子还是非极性分子?从结构上如何理解?
提示 O3是极性分子;臭氧分子的空间结构与水分子的相似,由于中心氧原子有1个孤电子对,孤电子对对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
键的极性和分子极性的关系
1.下列跟氢原子形成的极性键最强的原子是A.F B.Cl C.Br D.P
成键的两原子的电负性差值越大,极性越强,F的电负性最大,则跟氢原子形成的极性键最强。
2.已知N、P均属于元素周期表的第ⅤA族元素。N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H间的夹角是107°。(1)N4分子的空间结构为 ,它是一种______(填“极性”或“非极性”)分子。
N4分子是正四面体形结构,是一种非极性分子。
(2)PH3分子中P—H____(填“有”或“无”,下同)极性,PH3分子_____极性。
P—H为不同元素原子之间形成的共价键,为极性键,PH3分子的空间结构为三角锥形,正、负电中心不重合,PH3为极性分子。
(3)NCl3是一种淡黄色油状液体,下列对NCl3的有关描述不正确的是____(填字母)。a.该分子呈平面三角形b.该分子中的化学键为极性键c.该分子为极性分子d.因N—Cl的键能大,故NCl3稳定
NCl3中N原子的价层电子对数为3+ =4,孤电子对数为1,该分子为三角锥形,a错误;N、Cl之间形成的键为极性键,b正确;NCl3分子中正、负电中心不重合,故该分子为极性分子,c正确;共价键的键能越大,含有该键的物质越稳定,d正确。
键的极性对化学性质的影响
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用pKa(pKa=-lg Ka)的大小来衡量,pKa越小,酸性越强。根据下表,回答有关问题:
1.三氟乙酸和三氯乙酸哪个酸性强?原因是什么?
提示 酸性:三氟乙酸>三氯乙酸,原因是氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
2.甲酸和乙酸哪个酸性强?原因是什么?
提示 酸性:甲酸>乙酸,原因是烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
1.CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?解释原因。
提示 水与钠反应更剧烈,是由于C的电负性略大于H的电负性,烷基是推电子基团,使醇分子中的氢氧键的极性小于水分子中的氢氧键的极性。
2.三氟乙酸(CF3COOH)的酸性远强于乙酸(CH3COOH)的原因是什么?
提示 由于F的电负性较大,—CF3是吸电子基团,使羧基中羟基的极性更大,更易电离出H+。
1.下列物质中,酸性最强的是A.HCOOH D.C6H13COOH
推电子效应:—C6H13>—CH3>—H,HOCOOH是碳酸,故酸性:HCOOH>CH3COOH>HOCOOH>C6H13COOH。
2.下列几种有机羧酸中,按酸性由强到弱的顺序排列正确的是①乙酸(CH3COOH) ②氯乙酸(CH2ClCOOH) ③三氯乙酸(CCl3COOH) ④三氟乙酸(CF3COOH)A.②①④③ B.①②③④C.④③②① D.③②④①
由于电负性:F>Cl>H,则键的极性:C—F>C—Cl>C—H,故三氟乙酸中羧基中的羟基的极性最大,最易电离出氢离子,酸性最强;乙酸中羧基中的羟基的极性最小,酸性最弱。酸性强弱顺序:CF3COOH>CCl3COOH>CH2ClCOOH>CH3COOH,C正确。
1.键的极性对物质的化学性质有重要影响由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。2.羧基的酸性大小与分子组成和结构的关系(1)含卤素原子的一元羧酸的酸性①含相同个数的不同卤素原子的羧酸,卤素原子的电负性数值越大,羧酸的酸性越强。
②含不同数目的同种卤素原子的羧酸,卤素原子的数目越多,羧酸的酸性越强。(2)只含烷基的一元羧酸的酸性随着烷基加长,酸性的差异越来越小。(3)只含烷基的多元羧酸的酸性烷基所含碳原子数越少,羧基个数越多,酸性越强。
1.下列叙述正确的是A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,热稳定 性也越强B.只含非极性键的分子不一定是非极性分子C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极 性键D.非极性分子中,各原子间都应以非极性键结合
卤素的非金属性越强,键的极性越强,A项正确;如CO2、CS2为直线形,分子的空间结构对称,含有极性键,为非极性分子,C、D项错误。
2.用一带静电的玻璃棒分别靠近A、B两种纯液体流,现象如图所示,下列关于A、B两种液体分子的极性判断正确的是A.A是极性分子,B是非极性分子B.A是非极性分子,B是极性分子C.A、B都是极性分子D.A、B都是非极性分子
带静电的玻璃棒靠近纯液体流后,B液体流发生偏离,说明B液体的分子有极性,故A是非极性分子,B是极性分子。
3.下列叙述正确的是A.NO、N2O、NO2、NH3都是非极性分子B.CO2、SO3、BCl3都是非极性分子C.H2O、NH3都是极性分子,分子中的O—H比N—H的极性弱D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子
根据ABn型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,若不相等则为极性分子。中心原子N原子价电子数为5,四种化合物中没有一种氮元素的化合价为+5,故A项错误;中心原子C、S、B的化合价的绝对值等于其价电子数,CO2、SO3、BCl3均为非极性分子,故B项正确;O的电负性比N的电负性强,对成键电子对的吸引力也强,分子中O—H比N—H的极性强,故C项错误;NCl3分子中N原子化合价的绝对值与其价电子数不等,故D项错误。
4.(2022·山西柳林县鑫飞中学高二期中)下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是
A.SF6是由极性键构成的非极性分子B.32 g S8分子中含有0.125 ml σ键C.C2H2是既有极性键又有非极性键的非极性分子D.S8中S原子的杂化方式为sp3杂化
SF6分子中含有硫氟极性键,分子的空间结构为对称的正八面体结构,属于非极性分子,故A正确;
C2H2分子中含有碳氢极性键和碳碳非极性键,分子的空间结构为对称的直线形,属于非极性分子,故C正确;S8分子中硫原子的价层电子对数为4,杂化方式为sp3杂化,故D正确。
5.在HF、H2O、NH3、CS2、CH4、N2分子中:(1)以非极性键相结合的非极性分子是_____。(2)以极性键相结合,具有直线形结构的非极性分子是____。(3)以极性键相结合,具有三角锥形结构的极性分子是_____。(4)以极性键相结合,具有正四面体结构的非极性分子是____。(5)以极性键相结合,具有V形结构的极性分子是_____。(6)以极性键相结合,而且分子极性最大的是____。
不同元素间形成的共价键均为极性键,以极性键形成的分子,正、负电中心重合的为非极性分子,不重合的为极性分子。
题组一 键的极性与分子的极性1.下列各组分子中,按共价键极性由强到弱排序正确的是A.HF H2O NH3 CH4B.CH4 NH3 H2O HFC.H2O HF CH4 NH3D.HF H2O CH4 NH3
共价键极性的强弱取决于形成共价键的两原子的电负性,其电负性相差越大,形成的共价键极性越强。
2.X、Y为两种不同元素,由它们组成的下列物质的分子中,肯定有极性的是A.XY4 B.XY3 C.XY2 D.XY
不同种元素对电子对的吸引能力不同,所形成的双原子分子必有极性。
3.下列各组物质中,都是由极性键构成的极性分子的一组是A.CH4和Br2 B.NH3和H2OC.H2S和CCl4 D.CO2和HCl
CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S、HCl都是由极性键形成的极性分子。
4.下列物质:①MgCl2、②H2S、③白磷、④BF3、⑤NH3、⑥四氯化碳,其中含极性键的非极性分子是A.①②③④⑥ B.①④⑤⑥C.③④⑥ D.④⑥
①MgCl2只有离子键,不存在共价键,故错误;②H2S中含有极性键,空间结构为V形,正负电中心不重合,为极性分子,故错误;③白磷为单质,分子中只含有非极性键,属于非极性分子,故错误;④BF3中含有极性键,为平面三角形分子,正负电中心重合,为非极性分子,故正确;⑤NH3中含有极性键,空间结构为三角锥形,正负电的中心不重合,为极性分子,故错误;
⑥四氯化碳中含有极性键,空间结构为正四面体形,正负电中心重合,为非极性分子,故正确。
题组二 极性分子、非极性分子的判断5.使用微波炉加热,具有使物质受热均匀、表里一致、速度快、热效率高等优点。其工作原理是微波炉内的微波场以几亿的高频改变电场的方向,水分子因而能迅速摆动,产生热效应。这是因为A.水分子具有极性共价键B.水分子中有共用电子对C.水由氢、氧两元素组成D.水分子是极性分子
只有极性分子才能在电场中定向移动,非极性分子几乎不发生定向移动。水分子是由极性键构成的极性分子,故选D。
6.下列叙述正确的是A.NH3是极性分子,分子中氮原子是在3个氢原子所组成的三角形的中心B.CCl4是非极性分子,分子中碳原子处在4个氯原子所组成的正方形的 中心C.H2O是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中央D.CO2是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的 中央
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子空间结构是三角锥形。以下关于PH3的叙述正确的是A.PH3分子中有未成键的孤电子对B.PH3是非极性分子C.PH3是一种强氧化剂D.PH3分子的P—H是非极性键
A项正确,P原子最外层有5个电子,只有3个电子参与成键,另有2个电子形成一个孤电子对;B项错误,与NH3类似,PH3是极性分子;C项错误,PH3中P处于最低价态,+1价氢的氧化性极弱,不可能具有强氧化性;D项错误,由于P和H的电负性明显不同,故P—H是极性键。
8.下列说法正确的是A.含有非极性键的分子一定是非极性分子B.非极性分子中一定含有非极性键C.由极性键形成的双原子分子一定是极性分子D.两个原子之间共用两个电子对,形成的化学键一定有极性
H2O2分子中含非极性键,但空间结构不对称,正负电中心不重合,是极性分子,故A错误;CO2是非极性分子,但含有的是极性键,故B错误;由极性键形成的双原子分子,分子中正负电中心不重合,所以是极性分子,故C正确;两个原子之间共用两个电子对可能是相同原子形成,如C==C,为非极性键,也可能是不同原子形成,如C==O,为极性键,故D错误。
题组三 键的极性对化学性质的影响9.下列物质中,酸性最强的是A.CH2ClCOOH D.CHBr2COOH
电负性:F>Cl>Br,则酸性最强的是CHF2COOH。
10.从深海鱼油中提取的被称作“脑黄金”的DHA(C21H31COOH)就是一种不饱和度很高的脂肪酸。下列说法正确的是CH3CH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH2COOHDHA的结构简式A.酸性:C21H31COOH<CH3COOHB.DHA中含有的元素中电负性最大的是碳元素C.DHA中碳原子存在三种杂化方式D.DHA中所有原子共面
推电子效应:—C21H31>—CH3,故酸性:C21H31COOH<CH3COOH,A项正确;C、H、O三种元素中,O元素的电负性最大,B项错误;DHA中,碳原子存在sp2和sp3两种杂化方式,C项错误;DHA中存在—CH3结构,故所有原子不可能共面,D项错误。
11.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法正确的是A.假设为平面四边形,则该分子一定为非极性分子B.假设为四面体形,则该分子一定为非极性分子C.假设为平面四边形,则该分子可能为非极性分子D.假设为四面体形,则该分子可能为非极性分子
12.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是
A.H2O2中存在非极性共价键, 是非极性分子B.反应Ⅰ中涉及极性键的断裂 和非极性键的形成C.H2O分子的VSEPR模型为V形D.H2O是非极性分子
H2O2是极性分子,A错误;反应Ⅰ是H2O生成H2和H2O2,涉及极性键H—O的断裂和非极性键H—H、O—O的形成,B正确;H2O是极性分子,故D错误。
13.近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。如图是以Cu作为催化剂时CO2转化为甲酸的反应过程,下列有关说法不正确的是
A.过程①说明在催化剂作用下,O—C—O之间形成了一种特殊的化学键B.过程②和③吸收了能量并形成了O—H和C—HC.CO2和HCOOH中均只含有极性共价键D.1 ml CO2完全转化为甲酸需得到2 ml e-
过程①中碳氧双键断裂,O—C—O之间形成了一种特殊的化学键,故A正确;化学键的形成要放出能量,故过程②和③放出了能量并形成了O—H和C—H,故B错误;不同种原子之间形成的共价键为极性共价键,故CO2和HCOOH中均只含有极性共价键,故C正确;二氧化碳转化为甲酸时,碳元素化合价由+4价变为+2价,故1 ml CO2完全转化为甲酸需得到2 ml e-,故D正确。
14.硫-氮化合物是现代无机化学研究的热点之一。如图是已经合成的某硫-氮化合物(S4N4)的分子结构。下列有关该物质的说法正确的是A.其分子中各原子最外层都达到了8电子稳定结构B.其分子中只含极性键C.其分子是非极性分子D.其与化合物S2N2互为同素异形体
硫原子最外层有6个电子,若形成两个共价单键,则达到8电子稳定结构,氮原子最外层有5个电子,若形成3个共价单键,则达到8电子稳定结构,据图可知,A项正确;该物质的分子中既含S—N极性键,也含N—N非极性键,B项错误;该分子正、负电中心不重合,属于极性分子,C项错误;同素异形体描述的对象是单质,而不是化合物,D项错误。
15.已知,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大。请回答下列问题:(1)PtCl2(NH3)2的结构是____________(填“平面四边形”或“四面体形”)。
由于PtCl2(NH3)2存在两种同分异构体,所以是平面四边形结构。
(2)淡黄色固体物质由___________(填“极性分子”或“非极性分子”,下同)组成,黄绿色固体物质由_________组成。(3)请在以下横线上画出这两种固体分子的空间结构图:淡黄色固体:______________,黄绿色固体:____________。
因为水是极性分子,所以淡黄色固体是非极性分子,黄绿色固体是极性分子,因此空间结构图分别是 、 。
16.CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。试依据上述规律填空:(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在_____(填“吸”或“推”)电子基团,这种基团是________。
HCOOH显酸性,H2O呈中性,说明HCOOH分子中存在强吸电子基团,能使—OH上的H原子活泼性增强而使该物质的酸性大于水,HCOOH中含有—CHO,属于强吸电子基团。
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“推”)电子基团,这种基团是________。
CH3COOH的酸性弱于HCOOH,说明CH3COOH分子中存在推电子基团,能减弱—OH上H原子的活泼性而使该物质的酸性减弱,CH3COOH中含有—CH3,—CH3属于推电子基团。
(3)—C6H5也属于吸电子基团,故C6H5COOH的酸性比CH3COOH的酸性____(填“强”或“弱”)。
—C6H5属于吸电子基团,—CH3属于推电子基团,故C6H5COOH的酸性比CH3COOH的酸性强。
相关课件
这是一份人教版 (2019)选择性必修2第一节 共价键精品课件ppt,文件包含第一节第1课时共价键pptx、第二章第一节第1课时共价键专练docx、第二章第一节第1课时共价键教师版docx、第二章第一节第1课时共价键学习笔记docx、成键类型swf等5份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份高中化学第一节 共价键完整版ppt课件,文件包含第二章第三节第1课时共价键的极性pptx、极性分子swf、非极性分子swf等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键授课ppt课件,共27页。










