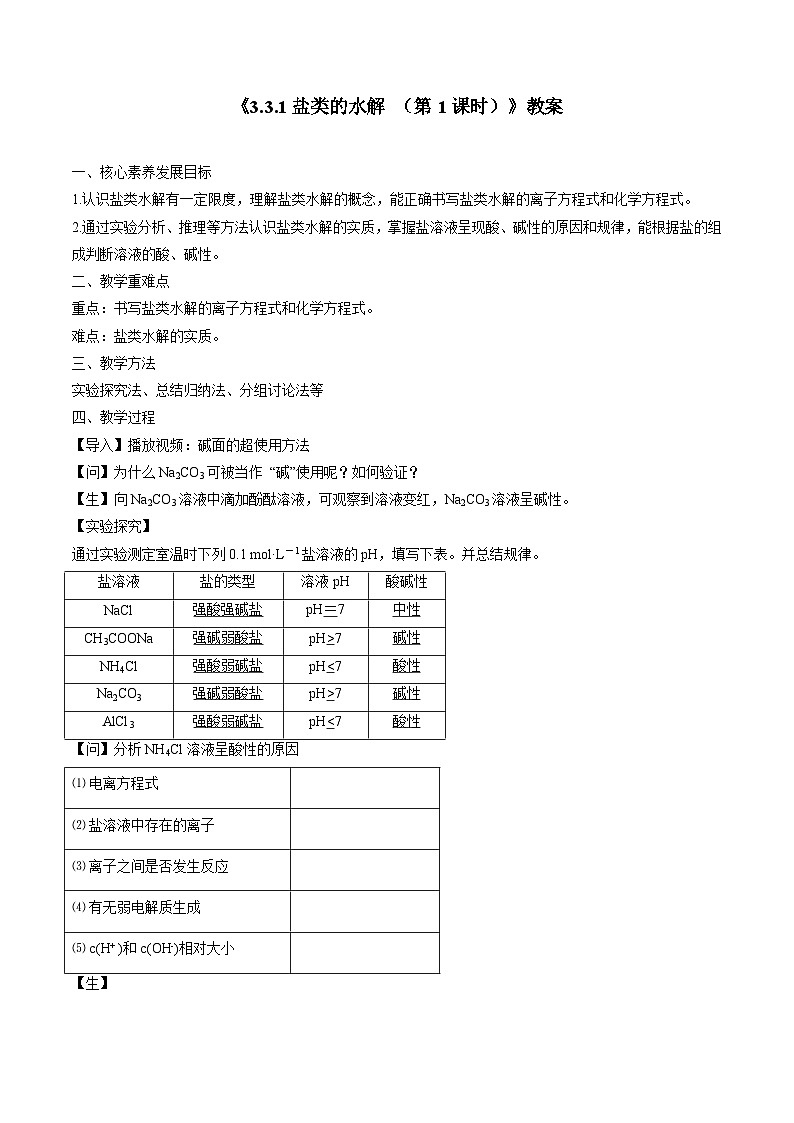

高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解第1课时教学设计及反思
展开
这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解第1课时教学设计及反思,共5页。教案主要包含了核心素养发展目标,教学重难点,教学方法,教学过程等内容,欢迎下载使用。
一、核心素养发展目标
1.认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式和化学方程式。
2.通过实验分析、推理等方法认识盐类水解的实质,掌握盐溶液呈现酸、碱性的原因和规律,能根据盐的组成判断溶液的酸、碱性。
二、教学重难点
重点:书写盐类水解的离子方程式和化学方程式。
难点:盐类水解的实质。
三、教学方法
实验探究法、总结归纳法、分组讨论法等
四、教学过程
【导入】播放视频:碱面的超使用方法
【问】为什么Na2CO3可被当作 “碱”使用呢?如何验证?
【生】向Na2CO3溶液中滴加酚酞溶液,可观察到溶液变红,Na2CO3溶液呈碱性。
【实验探究】
通过实验测定室温时下列0.1 ml·L-1盐溶液的pH,填写下表。并总结规律。
【问】分析NH4Cl溶液呈酸性的原因
【生】
NH4Cl电离出的NHeq \\al(+,4)和H2O电离出的OH-结合生成弱电解质NH3·H2O,使水的电离平衡向电离方向移动,导致溶液中c(H+)>c(OH-),因而氯化铵溶液呈酸性。
【问】分析CH3COONa溶液呈酸性的原因
【生】
CH3COONa电离出的CH3COO-和H2O电离出的H+结合生成弱电解质CH3COOH,使水的电离平衡向电离方向移动,导致溶液中c(OH-)>c(H+),因而CH3COONa溶液呈碱性。
【问】分析NaCl溶液呈中性的原因
【生】NaCl溶于水后电离出的Na+和Cl-均不能与水电离出的OH-或H+结合,水的电离平衡不发生移动,溶液中c(H+)=c(OH-),因而NaCl溶液呈中性。
【讲解】
盐类的水解
(1)概念:盐在水溶液中电离出的离子与水电离出的H+或OH-结合生成弱电解质的反应。
(2)实质
实质:生成弱电解质,破坏、促进水的电离。
盐类水解的特点
盐类水解的规律
【生】
(2)常见的“弱”离子
【问】①弱碱阳离子:
【生】NHeq \\al(+,4)、金属活动性顺序表Na之后的金属阳离子,如Mg2+、Al3+、Fe3+等。
【问】②弱酸阴离子:
【生】COeq \\al(2-,3)、HCOeq \\al(-,3)、SOeq \\al(2-,3)、HSOeq \\al(-,3)、S2-、HS-、ClO-、SiOeq \\al(2-,3)、CH3COO-、F-、AlOeq \\al(-,2)等。
【讲解】二、盐类水解方程式的书写
1.盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一般用“”连接,产物不标“↑”或“↓”。如:
NaClO、(NH4)2SO4
【生】ClO-+H2O⇌HClO+OH-;
【生】NHeq \\al(+,4)+H2O⇌NH3·H2O+H+。
【讲解】2.多元弱酸根离子的水解分步进行,水解以第一步为主。如:
Na2CO3:
【生】COeq \\al(2-,3)+H2O⇌HCOeq \\al(-,3)+OH-、
HCOeq \\al(-,3)+H2O⇌H2CO3+OH-。
【讲解】3.多元弱碱阳离子水解反应过程复杂,要求一步写到底。如AlCl3:
【生】Al3++3H2O⇌Al(OH)3+3H+。
【讲解】4.弱酸弱碱盐中阴、阳离子水解相互促进。
(1)NHeq \\al(+,4)与S2-、HCOeq \\al(-,3)、COeq \\al(2-,3)、CH3COO-等组成的盐虽然水解相互促进,但水解程度较小,书写时仍用“⇌”表示。如:NHeq \\al(+,4)+CH3COO-+H2O⇌CH3COOH+NH3·H2O。
(2)Al3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-、HS-、AlOeq \\al(-,2),Fe3+与COeq \\al(2-,3)、HCOeq \\al(-,3)等组成的盐水解相互促进且非常彻底,生成气体和沉淀,书写时用“===”表示。如Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑。(一般要有弱碱沉淀生成)
【讲解】盐类水解离子方程式与其电离方程式辨别的关键:去除干扰物质,如H3O+―→H2O+H+。
HS-电离:HS-+H2O⇌S2-+H3O+⇒HS-⇌S2-+H+
HS-水解:HS-+H2O⇌H2S+OH-
【讲解】弱酸的酸式酸根离子在水溶液中存在电离平衡和水解平衡,弱酸酸式盐溶液的酸碱性取决于其电离程度和水解程度的相对大小。
1水解程度大于电离程度:如呈碱性的NaHCO3、NaHS、Na2HPO4溶液。
2电离程度大于水解程度:如呈酸性的NaHSO3、KHC2O4、NaH2PO4溶液。
【讲解】水解常数及应用
1.表达式
例如,强碱弱酸盐MA的水解过程可理解为:
Kh=eq \f(cHA·cOH-,cA-)。
2.与对应弱酸电离常数的关系
Ka=eq \f(cH+·cA-,cHA),
所以,Kh·Ka=Kw或Kh=eq \f(Kw,Ka)。
3.水解常数的意义
Kh定量的表示水解反应趋势的大小,Kh越大,水解趋势越大。
4.外因对水解常数的影响
Kh是化学平衡常数的一种,只与温度有关,与盐溶液的浓度无关,一般温度升高,Kh增大。
【课堂小结】师生共同完成。
物质水解的原理
水解方程式的书写
水解常数及应用
【课堂练习】
1、1.A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中:AC和BD盐溶液的pH=7,BC盐溶液的pH>7,则下列说法不正确的是( )
A.AD盐溶液的pH<7
B.在AC盐溶液中:c(A+)+c(AOH)=c(C-)+c(HC)
C.碱的电离程度一定是:AOH>BOH
D.酸的电离程度一定是:HD>HC
答案:C
2.现有S2-、SOeq \\al(2-,3)、NHeq \\al(+,4)、Al3+、HPOeq \\al(2-,4)、Na+、SOeq \\al(2-,4)、AlOeq \\al(-,2)、Fe3+、HCOeq \\al(-,3)、Cl-等离子,请按要求填空:
(1)在水溶液中,离子水解呈碱性的是___________________________。
(2)在水溶液中,离子水解呈酸性的是________________。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有_______________。
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有______________。
答案:(1)S2-、SOeq \\al(2-,3)、HPOeq \\al(2-,4)、AlOeq \\al(-,2)、HCOeq \\al(-,3)
(2)NHeq \\al(+,4)、Al3+、Fe3+
(3)Na+、Cl-、SOeq \\al(2-,4)
(4)HPOeq \\al(2-,4)、HCOeq \\al(-,3)盐溶液
盐的类型
溶液pH
酸碱性
NaCl
强酸强碱盐
pH=7
中性
CH3COONa
强碱弱酸盐
pH>7
碱性
NH4Cl
强酸弱碱盐
pH7
碱性
AlCl3
强酸弱碱盐
pH
相关教案
这是一份苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解第2课时教案设计,共4页。教案主要包含了核心素养发展目标,教学重难点,教学方法,教学过程等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解教学设计,共5页。教案主要包含了教学设想,教学目标,评价目标,教学重、难点,教学方法,教学手段,教学准备,教学过程等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解第1课时教案,共2页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。










