
2019年四川省百校高三模拟冲刺卷理科综合能力测试试题(化学部分)
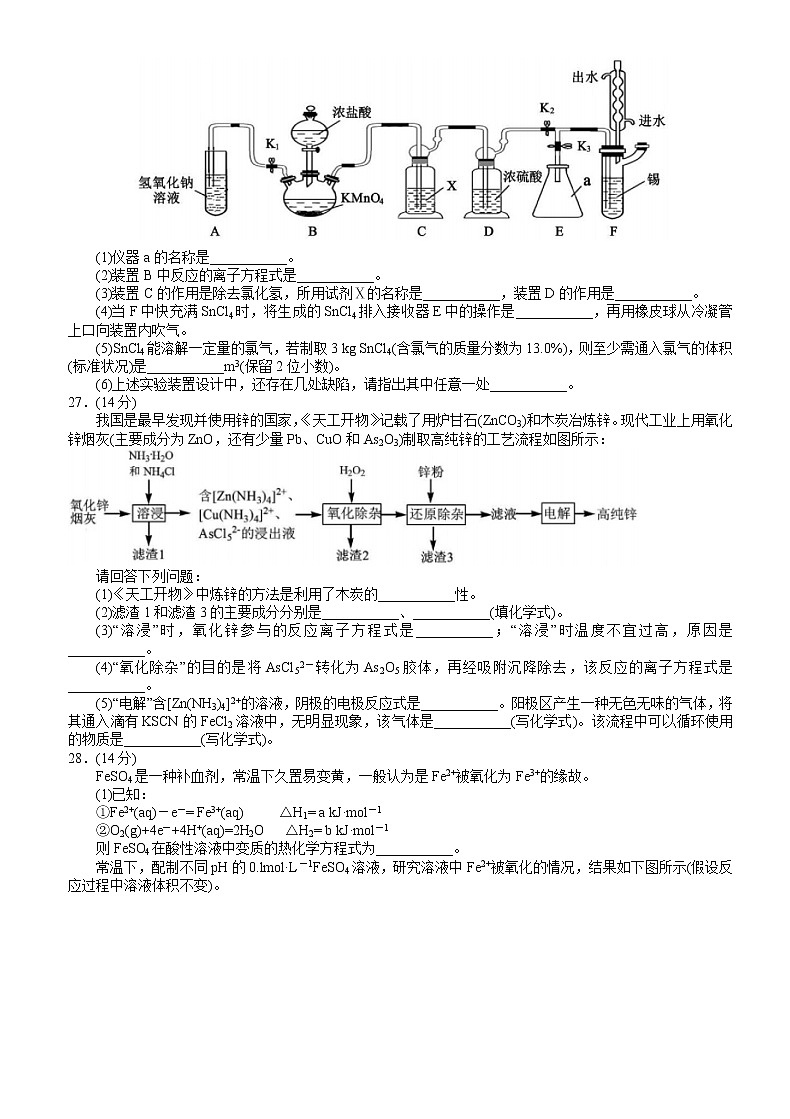
展开2019年四川省百校高三模拟冲刺卷理科综合能力测试(化学部分)可能用到的相对原子质量:Cl-35.5 Fe-56 Cu-64 Sn-119一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选择中,只有一项是符合题目要求的7.二氧化碳气体能引起温室效应,“碳捕捉技术”可实现二氧化碳的分离、储存和利用,其工艺流程如下图。下列叙述中正确的是A.CO2是引起酸雨的主要物质之一 B.捕捉CO2可使用小苏打溶液C.捕捉到的CO2可用作化工原料 D.能量消耗低是该技术的一大优点8.三氯生(常作抗菌剂)的一种衍生物结构如下图所示。关于该衍生物的说法错误的是A.分子式为C12H6C14OB.其一溴代物有三种C.是二氯苯的同系物D.能发生加成反应9.NA代表阿伏加德罗常数的值。下列说法正确的是A.标准状况下,22.4L己烯含有碳氢键数目为12NAB.5.6gFe与足量盐酸完全反应,失去电子数目为0.2NAC.0.1molN2与0.3molH2充分反应,生成NH3的数目为0.2NAD.电解精炼铜时阳极减轻32g,电路中转移电子数目一定为NA10.下列实验中,为达到实验目的所采取的实验操作和原理解释均正确的是11.X、Y、Z、W是第三周期元素,它们的最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol·L-1的溶液,其pH与对应元素原子半径的关系如下图所示。下列说法正确的是A.简单离子的半径:X>Z>WB.简单气态氢化物的稳定性:Z>W>YC.Y单质可用于制作半导体材料D.n=2-lg212.用Li、石墨复合材料与Fe2O3纳米材料作电极的锂离子电池,在循环充放电过程中实现对磁性的可逆调控。下列有关说法错误的是A.该电池的电解质溶液可以是硫酸溶液B.放电时,总反应是6Li+Fe2O3=3Li2O+2FeC.充电时,阳极反应是2Fe+ 3Li2O-6e-=Fe2O3+ 6Li+D.充放电过程中,电池可在被磁铁吸引和不吸引之间循环调控13.常温下向10mL0.1 mol·L-1的HR溶液中逐滴加入0.1 mol·L-1的氨水,溶液的pH及导电能力变化趋势如右图。下列分析正确的是A.各点溶液中的阳离子浓度总和关系是:d>c>b>aB.常温下,R-的水解平衡常数数量级是10-9C.a、d两点溶液中,水的电离程度相等D.d点溶液中,微粒浓度关系是:c(R-)+ 2c(HR)=C(NH3·H2O)三、非选择题:共174分。第2~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。(一)必考题:共129分26.(15分)常温下,无水四氯化锡是一种无色、易挥发、易流动的液体,遇水极易发生水解。某学习小组设计了下图所示的装置制备无水四氯化锡。其原理是Sn(s)+2Cl2(g)=SnC14(l) △H=-511 kJ·mol-1。请回答下列问题:(1)仪器a的名称是___________。(2)装置B中反应的离子方程式是___________。(3)装置C的作用是除去氯化氢,所用试剂Ⅹ的名称是___________,装置D的作用是___________。(4)当F中快充满SnCl4时,将生成的SnCl4排入接收器E中的操作是___________,再用橡皮球从冷凝管上口向装置内吹气。(5)SnCl4能溶解一定量的氯气,若制取3 kg SnCl4(含氯气的质量分数为13.0%),则至少需通入氯气的体积(标准状况)是___________m3(保留2位小数)。(6)上述实验装置设计中,还存在几处缺陷,请指出其中任意一处___________。27.(14分)我国是最早发现并使用锌的国家,《天工开物》记载了用炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO,还有少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示:请回答下列问题:(1)《天工开物》中炼锌的方法是利用了木炭的___________性。(2)滤渣1和滤渣3的主要成分分别是___________、___________(填化学式)。(3)“溶浸”时,氧化锌参与的反应离子方程式是___________;“溶浸”时温度不宜过高,原因是___________。(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附沉降除去,该反应的离子方程式是___________。(5)“电解”含[Zn(NH3)4]2+的溶液,阴极的电极反应式是___________。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________(写化学式)。该流程中可以循环使用的物质是___________(写化学式)。28.(14分)FeSO4是一种补血剂,常温下久置易变黄,一般认为是Fe2+被氧化为Fe3+的缘故。(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1= a kJ·mol-1②O2(g)+4e-+4H+(aq)=2H2O △H2= b kJ·mol-1则FeSO4在酸性溶液中变质的热化学方程式为___________。常温下,配制不同pH的0.lmol·L-1FeSO4溶液,研究溶液中Fe2+被氧化的情况,结果如下图所示(假设反应过程中溶液体积不变)。(2)pH=5.5的环境下,反应在0~15min的平均速率v(Fe2+)=___________;增大溶液pH,Fe2+被氧化速率___________(填“增大”、“减小”或“无影响”)。(3)平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下被氧化的平衡常数K的计算表达式是___________;常温下该反应的平衡常数为2.5×1032L4·( atm·mol4)-1,相对较大,下列说法正确的是___________。(填正确答案标号)a.Fe2+转化为Fe3+的趋势大 b.Fe2+转化为Fe3+的速率大c.反应进行得较为彻底 d.酸性条件下Fe2+不会被氧化(4)pH=13的环境下,Fe2+被氧化变质可以理解为:第一步:Fe2++2OH-=Fe(OH)2↓第二步:___________(写化学方程式);当该氧化反应达到平衡时,c(Fe2+)/c(Fe3+)___________4.0×1022(填“>”、“<”或“=”)。已知的 Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和___________(填试剂)(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一道题计分。35.[化学——选修3:物质结构与性质](15分)大型客机燃油用四乙基铅[Pb(CH2CH3)4]做抗震添加剂,长期接触四乙基铅对身体健康有害,可用巯基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。(1)锰元素在周期表中的位置是___________,基态锰原子的外围电子排布式为___________,该基态原子占据最高能级的电子云轮廓图形状为___________。(2)N、C和Mn三种元素的电负性由大到小的顺序为___________。(3)HSCH2CH2NH2中C的杂化轨道类型为___________,其中-NH2空间构型名称为___________;N和P的价电子数相同,磷酸的化学式为“H3PO4”,而硝酸的化学式不是:“H3NO4”,原因是___________。(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于___________晶体。已知Pb(CH2CH3)4晶体的堆积方式如下:Pb(CH2CH3)4在xy平面上的二维堆积中的配位数是___________。设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4的摩尔质量为 M g·mol-1,则Pb(CH2CH3)4晶体的密度是___________g·cm-3(列出计算式即可)。36.[化学——选修5:有机化学基础](15分)硝苯地平()是治疗高血压的常用药物。其合成线路如下图所示:已知:乙烯酮和聚二乙烯酮都能与含活泼氢原子的物质发生反应,例如乙烯酮可发生反应:CH2=C=O+H-X→CH3COX(其中X=-OH、-OR、-OOCR、卤原子等)请回答下列问题:(1)硝苯地平分子中含氧官能团的名称是___________,其分子的核磁共振氢谱有___________种类型的吸收峰。(2)反应①的条件是___________,反应②的反应类型是___________。(3) 的名称是___________,反应③的化学方程式是___________。(4)A的结构简式是___________,A有多种同分异构体,其中属于苯的二取代产物且含有氨基(-NH2)的有机化合物共有___________种。(5)结合相关信息及所学知识,请设计由乙醇制备乙酰氯(CH3COC1)的合成路线___________。(其它无机试剂任选)





