




高中化学第二节 化学反应的速率与限度教课内容ppt课件
展开①2H2 + O2 2H2O
思考:我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
已知:2ml 1ml
② 2SO2 + O2 2SO3
已知:2ml 1ml
由上可知可逆反应进行得不完全,正、逆向反应同时同条件进行。化学反应物不可能全部转化为生成物,存在一定的化学反应限度。其实任何化学反应的进程都有一定的限度(可逆性),反应物不可能完全参加了反应,有些能进行地较彻底(非可逆反应),有些反应是不彻底的,甚至是可逆的(可逆反应)。
水的生成与电解,二次电池的放电与充电,CO2和H2O在植物体中通过光合作用合成糖与糖在人体内氧化生成CO2和H2O,它们是否属于“可逆反应”?
在同一条件下正反应方向和逆反应方向均能进行的化学反应。
【例1】对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2足够长时间后,18O原子( )A、只存在于O2中B、只存在于O2和SO3中C、只存在于SO2和O2中D、存在于SO2、O2和SO3
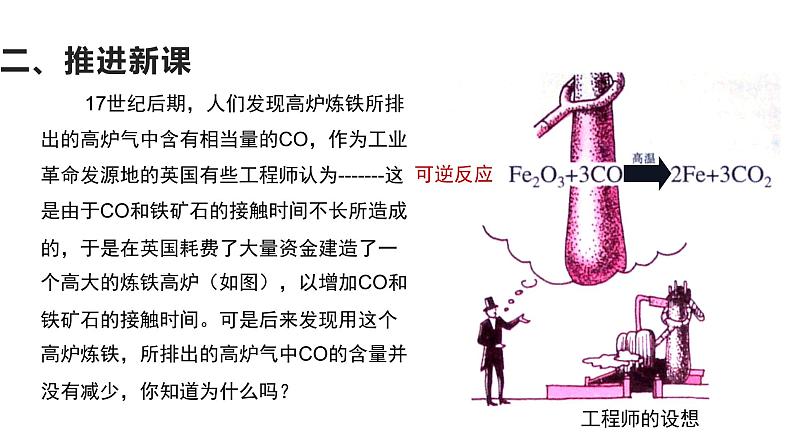
17世纪后期,人们发现高炉炼铁所排出的高炉气中含有相当量的CO,作为工业革命发源地的英国有些工程师认为-------这是由于CO和铁矿石的接触时间不长所造成的,于是在英国耗费了大量资金建造了一个高大的炼铁高炉(如图),以增加CO和铁矿石的接触时间。可是后来发现用这个高炉炼铁,所排出的高炉气中CO的含量并没有减少,你知道为什么吗?
原料利用率的高低问题就涉及到化学反应进行的程度问题——化学平衡。
【思考】 在硫酸工业、硝酸工业都涉及到可逆反应,从效益的角度应考虑:(1)反应速率大(2)原料的利用率要高
v(溶解)= v(结晶)蔗糖的溶解达最大程度,即形成饱和溶液。 达到溶解平衡。
(1) 溶解平衡是如何建立的?(2) 溶解平衡平衡是否是不再溶解蔗糖了?
v(溶解)= v(结晶)≠0
晶体质量不发生变化,溶液浓度不发生变化即得饱和溶液。
溶解平衡是动态平衡 。
将0.1 mlCO和0.1ml H2O(g)通入容积为1L的密闭容器中,在催化剂存在的条件下加热到800℃,发生如下反应:
CO + H2O(g) CO2 + H2
实验发现上述反应无论反应进行多长时间,各物质的浓度都不再发生变化。
二、化学反应的限度(化学平衡)
【思考】体系中CO、H2O、CO2、H2的浓度保持不变与正逆反应速率有什么关系?这时可逆反应达到了什么状态?
N2 + H2 NH3
在一固定容积的密闭容器里,加1mlN2和3ml H2 (合适催化剂) ,能发生什么反应?
(1) 开始时c(N2) 、c(H2)大, c(NH3) =0
只有正反应,v(逆)=0
N2 + 3H2 2NH3
(2) 瞬间后c(N2) 、c(H2 )变小,c(NH3)≠0
正逆反应都进行,v(逆) ≠0,v(正)> v(逆)
(3) c(N2) 、c(H2)逐渐变小,c(NH3)逐渐增大,三种物质的浓度达到一个特定值。
一定时间段内有什么特征?
v(正)= v(逆) ≠0
由于v(正)=v(逆)≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。
平衡建立:速率——时间图象
1.化学平衡状态:在一定条件下,一个可逆反应进行到一定程度时,正向反应速率与逆向反应速率相等时,反应物浓度和生成物浓度不再改变,达到一种表面静止的状态。特征:宏观——反应物和生成物的浓度不再改变。微观——v(正反应)=v(逆反应)≠0。
1.一定条件:恒温恒容下或恒温恒压。2.研究的对象:可逆反应。3.本质特征(实质): 对同一物质 正反应速率 = 逆反应速率≠04.标志:反应混合物中各组分的浓度(或百分含量)保持不变的状态
2.改变条件可以改变一个化学反应的限度,即改变化学平衡状态——化学平衡的移动。3.化学平衡的建立(1)反应开始时①反应物的浓度______,正反应速率______。②生成物的浓度为____,逆反应速率为 。(2)反应进行中①反应物的浓度逐渐________,正反应速率逐渐________。
②生成物的浓度逐渐________,逆反应速率逐渐________。(3)一段时间(t1)正反应速率与逆反应速率相等,此时,反应物的浓度不再变化,生成物的浓度也不再变化。此时的状态就是
【例2】高炉炼铁中Fe2O3+ 3CO 2Fe + 3CO2 反应开始高炉内有1ml Fe2O3、3ml CO下列说法正确的是( )Fe2O3与CO 充分反应后生成2mlFe、3mlCO2。B.随着反应进行,正反应速率逐渐减小,最后为0。C.当生成的铁的质量不随时间改变时,化学反应停止。D.当化学反应达平衡时,Fe2O3转化率最大
【例3】在2升的密闭容器中2mlSO2和一定量的氧气,发生反应,当反应进行到4min时,测得此时SO2为0.4ml,问在反应进行到2min时,密闭容器中SO2的物质的量是( )A 1.6ml B1.2ml C 大于1.6ml D小于1.2ml
v(正)=v(逆) 达到平衡, 即同一物质的消耗速率与生成速率相等。
化学平衡是一种动态平衡:
即正反应和逆反应在不断的进行且速率相等。
条件不变时,各组分浓度保持不变。即反应进行到最大限度。
平衡是短暂的、相对的,一定条件下的平衡,如果条件改变时,原平衡就被破坏,在新条件下,达到新的平衡。
【例4】在密闭容器中充入SO2和由18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( ) A、只存在于氧气中 B、只存在于O2和SO3中 C、只存在于SO2和SO3中 D、SO2、SO3、O2中都有可能存在。
【例5】在一定条件下,某容器内充入N2和H2合成氨,以下叙述中错误的是( )A.开始反应时,正反应速率最大,逆反应速率为零。B.随着反应的进行,正反应速率减小,最后降为零。C.随着反应的进行,正反应速率减小,逆反应速率增大,最后相等。D.在达到平衡时,N2正反应速率等于逆反应速率。
三、化学平衡状态的标志(判断依据)
(1)υ正 = υ逆(根本标志)
①同一物质:该物质生成速率等于它的消耗速率。
V(SO2)正:V(O2)逆 == 2:1V(SO2)正:V(SO2) 逆 == 1:1
V(SO2)正:V(O2)正 == 2:1 ?
【例6】可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( ) A 3正N2= 正H2 B 正N2=逆NH3 C 2 正H2=3逆NH3 D 正N2=3逆H2
【例7】可逆反应2A+3B 4C在一定条件下达到化学平衡的标志是( ) A.一定时间内有2ml的A生成,同时有3ml的B生成 B.一定时间内有2ml的A消耗,同时有4ml 的C生成 C.一定时间内有4ml的C分解,同时有3ml的B消耗 D.一定时间内有2ml的A消耗,同时有3ml的B生成
正逆反应速率的关系(1) 在单位时间内消耗了 m ml A,同时生成了m ml A;(2) 在单位时间内消耗了 n ml B,同时消耗了p ml C;(3) v (A)∶v (B) ∶ v (C) ∶ v (D) = m ∶ n ∶ p ∶ q ;(4) 在单位时间内生成了 n ml B,同时消耗了q ml D。
未达到平衡时也符合此关系
同一种物质:V断裂化学键 = V形成化学键
不同物质:考虑系数、分子内化学键数、正逆速率。
【例8】下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )A.1个N≡N键断裂的同时,有3个H-H键形成B.1个N≡N键断裂的同时,有3个H-H键断裂C.1个N≡N键断裂的同时,有6个N-H键断裂D.1个N≡N键断裂的同时,有6个N-H键形成E. N2与H2 反应速率之比为1:3F.外界条件不变,正反应速率大小不随时间改变
以速率判断平衡时必须是不同方向
不同物质速率之比等于系数之比
(2)混合物中各组分的浓度保持不变:
①各组分的物质的量浓度、质量分数、物质的量分数、气体的体积分数保持不变。
②各组分的质量、物质的量、分子数、气体的体积保持不变。
③反应物的转化率、产物的产率保持不变。
④体系的温度、颜色等保持不变。
如:恒压恒容容器中:H2 + I2 2HI, 若体系的温度或气体的颜色不再发生变化。 则反应一定达到平衡。
⑤ aA(g) + bB(g) cC(g) + dD(g) 若a+b ≠ c+d即非等体积反应时:若总物质的量、总压强(恒容)、平均摩尔质量保持不变,则反应一定达平衡。
⑥ aA(g) + bB(g) cC(g) + dD(g) 若a+b=c+d即等体积反应时:若总物质的量、总压强(恒容)、平均摩尔质量保持不变,则不能说明达到平衡。
【例9】可逆反应2NO2 2NO+O2在密闭容器中反应(恒容),达到平衡状态的标志是( )A.单位时间内生成n ml O2的同时生成2n ml NO2;B.NO2、NO、O2的物质的量之比为2:2:1的状态。C.用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;D.混合气体的颜色不再改变的状态;E.混合气体的密度不再改变的状态;F.混合气体的平均相对分子质量不再改变的状态
【例10】对一固定容积的密闭容器中进行的可逆反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)下列说法中能确认反应已达到平衡状态的是( )A.反应混合物中各组分浓度相等B.单位时间内每有4ml NH3被氧化,同时有5ml O2被还原C.单位时间内4ml NH3被消耗同时有5mlO2生成D.NH3的转化率保持不变
解题方法:1.反应速率是看一正一逆 2.反应浓度不随时间变化
【例11】 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是( )A.C的生成速率与C分解的速率相等B.单位时间内生成n mlA,同时生成3nmlBC. A、B、C的浓度不再变化 D.A、B、C的分子数比为1:3:2E.单位时间内生成n mlA,同时生成2nmlC
【例12】在恒温恒容的密闭容器中,可逆反应:2SO2(g)+O2(g) 2SO3(g) 达到平衡后,下列不是平衡的标志的是( ) A.混合气体的密度不再发生变化 B.容器中三种物质的质量分数相等 C.密闭容器中的压强不再发生变化 D.气体的总的物质的量不再发生变化 E.混合气体的平均分子量不再发生变化
【例13】一定温度下的定容密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g) C(g)+D(g) 已达到平衡的是( )A.混合气体的压强 B.混合气体的密度C.B物质的物质的量浓度 D.气体的总物质的量
(1)混合气体的颜色不再改变 ( )
(2)混合气体的平均相对分子质量不变 ( )
(3)混合气体的密度不变 ( )
(4)混合气体的压强不变 ( )
(5)单位时间内消耗2n mlNO2的同时生成2n mlO2 ( )
(6) O2气体的物质的量浓度不变 ( )
【例14】在固定体积的的密闭容器中发生反应: 2NO2 2NO + O2 该反应达到平衡的标志是:
三、化学反应的条件控制
1.建筑物定向爆破问题
(1) 煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
煤被研得越细,粉末越小,与空气中O2的接触面积越大,燃烧越充分,反应速率越快。
2.如何提高煤的燃烧效率
(2) 空气用量对煤的充分燃烧有什么影响?为什么?
空气充足,煤燃烧得充分,产物主要为CO2,放热量大;空气不足,则煤燃烧不充分,部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减小。
(3) 应选择什么样的炉(灶)膛材料?理由是什么?
应选择保温隔热且耐热的炉(灶)膛材料。尽管煤燃烧是放热反应,但反应过程中煤燃烧需要提供部分能量才能进行,而利用煤燃烧放出的部分热量就可维持反应的持续进行。选用保温隔热材料的目的,是为防止热量散失。
(4) 燃料不充分燃烧有何危害?
产生热量少,浪费资源。产生污染物,危害人体健康。
(5) 燃料充分燃烧的条件是什么?
燃料燃烧必须与空气接触,且温度要达到燃料的着火点。燃料充分燃烧要考虑到两点:一是燃烧时要有足够多的空气;二是燃料与空气要有足够大的接触面积。
化学必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度精品ppt课件: 这是一份化学必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度精品ppt课件,共36页。PPT课件主要包含了新课讲授,情景导入,化学反应快慢不同,千分之一秒即完成,百分之一秒即完成,救心丹,几分钟见效,钢铁腐蚀,若干年,几千万年以上等内容,欢迎下载使用。
人教版 (2019)必修 第二册第二节 化学反应的速率与限度优质课件ppt: 这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度优质课件ppt,共30页。PPT课件主要包含了学习目标,思考讨论,新课讲授,减少量,增加量,常用单位min或s,典例分析,无法确定,三段式解题法,方法三段法等内容,欢迎下载使用。
化学必修 第二册第三节 环境保护与绿色化学完美版课件ppt: 这是一份化学必修 第二册第三节 环境保护与绿色化学完美版课件ppt,共60页。PPT课件主要包含了化学反应有快有慢,千分之一秒即完成,百分之一秒即完成,救心丹,几分钟见效,钢铁腐蚀,若干年,几千万年以上,化学反应速率,vNH3等内容,欢迎下载使用。









