
江苏高考化学复习考点突破--氮及其化合物(二) 学案
展开知识点三 氨和铵盐
1.氨(1)物理性质:无色有刺激性气味的气体,密度比空气小,易液化。极易溶于水(1∶700),可由喷泉实验证明。(2)化学性质:
①与水反应:NH3+H2ONH3·H2ONH+OH-。氨气溶于水得氨水,氨水中含有的粒子有:NH3·H2O、H2O、NH3、NH、OH-、H+。NH3·H2O为可溶性一元弱碱,不稳定,易分解,化学方程式为:NH3·H2O△,NH3↑+H2O。②还原性:与氧气发生催化氧化反应的化学方程式:4NH3+5O2催化剂4NO+6H2O。③与酸反应:与氯化氢反应的化学方程式:NH3+HCl===NH4Cl,产生白烟。(3)制法(书写化学方程式):①工业制法:N2+3H2高温、高压2NH3。②实验室制法:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O。(4)用途:制硝酸、铵盐、纯碱、尿素、制冷剂等。2.铵盐(1)不稳定性:NH4ClNH3↑+HCl↑,NH4HCO3NH3↑+H2O↑+CO2↑。(2)与强碱反应:NH4Cl+NaOHNH3↑+NaCl+H2O。应用于NH的检验:
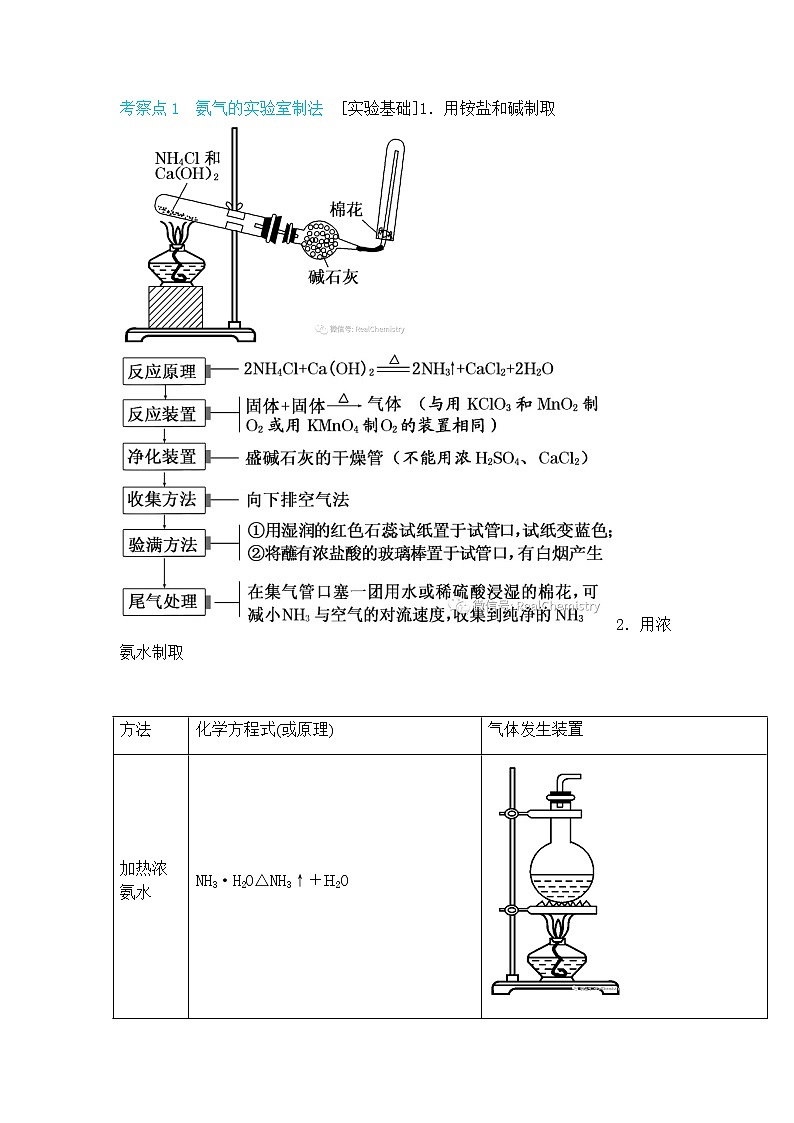
考察点1 氨气的实验室制法 [实验基础]1.用铵盐和碱制取2.用浓氨水制取
方法 | 化学方程式(或原理) | 气体发生装置 |
加热浓氨水 | NH3·H2O△NH3↑+H2O | |
浓氨水+固体(CaO) | CaO与水反应使水量减少,且反应放热,促使NH3·H2O分解,NH3逸出。化学方程式:NH3·H2O+CaO===Ca(OH)2+NH3↑ |
[流程分析]氨的制取及氨的催化氧化实验探究考察点2 喷泉实验的原理及其应用1.喷泉实验的原理由于容器内外产生压强差而形成喷泉。气体迅速溶于水或某种溶液中,容器内压强小于容器外压强,从而产生喷泉,依据这一原理,只要能够造成容器内气体大量溶于液体,就可以形成喷泉。2.形成喷泉的类型(1)只要气体易溶于吸收剂,均可做喷泉实验,吸收剂可以是水,也可以是酸液、碱液等。下面是几种常见的能形成喷泉的气体和液体。
气体 | HCl | NH3 | CO2、Cl2、SO2、H2S | NO2 | NO、O2(4∶3) |
吸收剂 | 水、NaOH溶液 | 水 | NaOH溶液 | 水 | 水 |
(2)容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)或由于发生化学反应产生气体,容器内产生大量气体,压强迅速增大,促使容器内液体迅速向外流动,也能形成喷泉。如喷雾器、人造喷泉、火山喷发等均是利用此原理。3.引发喷泉的几种方法(1)使烧瓶内的气体迅速溶于水或某种液体中。(2)使烧瓶内气体温度降低,从而使气压减小。(3)使烧瓶外待喷液面上的气压增大。4.喷泉实验的几种常见装置
说明:装置②中最好采用顶部有孔的烧瓶。装置③引发喷泉的方法是打开止水夹,用热毛巾或双手捂热烧瓶,松开后片刻即形成喷泉现象。








