

2017-2018学年江西省抚州市临川一中高二下学期期中考试化学试题(Word版)
展开临川一中2017-2018学年度下学期期中考试
高二 年级化学试卷
卷面满分:100 分 考试时间:100 分钟
相对原子质量:H -1 O -16 S -32 Fe -56 Cu -64 Ba -137
第一卷 选择题
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.现代中药纳米粉碎 B.明矾作净水剂
C.二氧化硫作纸浆的漂白剂 D.肥皂水作蚊虫叮咬处的淸洗剂
2.古诗词或谚语中包含了丰富的化学知识,下列解释正确的是
选项 | 古诗或谚语 | 含有的化学反应类型 |
A | 熬胆矾铁釜,久之亦化为铜 | 复分解反应 |
B | 千锤万凿出深山,烈火焚烧若等闲 | 分解反应 |
C | 春蚕到死丝方尽,蜡炬成灰泪始干 | 化合反应 |
D | 爆竹声中除旧岁,春风送暖人屠苏 | 置换、分解反应 |
3.常温下,下列各组离子在酸性溶液中一定能大量共存的是
A.K+、Na+、Cu2+、SO42- B.K+、CO32-、NO3-、Cl-
C.Na+、C1-、NO3-、OH- D.Na+、NH4+、NO3-、A1O2-
4.下列关于有机物的说法正确的是
A.乙烯、聚乙烯能使酸性高锰酸钾溶液褪色
B.分子式为C4H8的有机物结构中可能有2个甲基
C.乙烷室温下能与浓盐酸发生取代反应
D.乙醇室温下在水中的溶解度小于溴乙烷
5.分类法是一种行之有效、简单易行的科学方法。某同学用如下表所示的形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系,下列选项不正确的是
| 甲 | 乙、丙、丁 |
A | 常见合金 | 不锈钢、青铜、生铁 |
B | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
C | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
D | 弱电解质 | 醋酸、一水合氨、水 |
6.下列有关实验操作正确的是•
| 实验 | 操作 |
A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D | CC14萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
7.下列反应的离子方程式表达正确的是
A.向AgNO3溶液中加人过量的氨水:Ag+ +NH3• H2O=AgOH↓+NH4+
B.过量的铁和稀硝酸反应:3Fe+2NO3- +8H+=3Fe2++2NO↑+4H2O
C.用碳酸氢钠溶液检验水杨酸中的羧基:
D.向双氧水中加入酸性高锰酸钾溶液:5H2O2 +2MnO4-=2Mn2++5O2↑+6OH- +2H2O
8.饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶:
关于上述过程涉及的实验方法、实验操作和物质作用中说法错误的是
A.维生素C可作抗氧化剂 B.①是萃取 C.③是分液 D.②是过滤
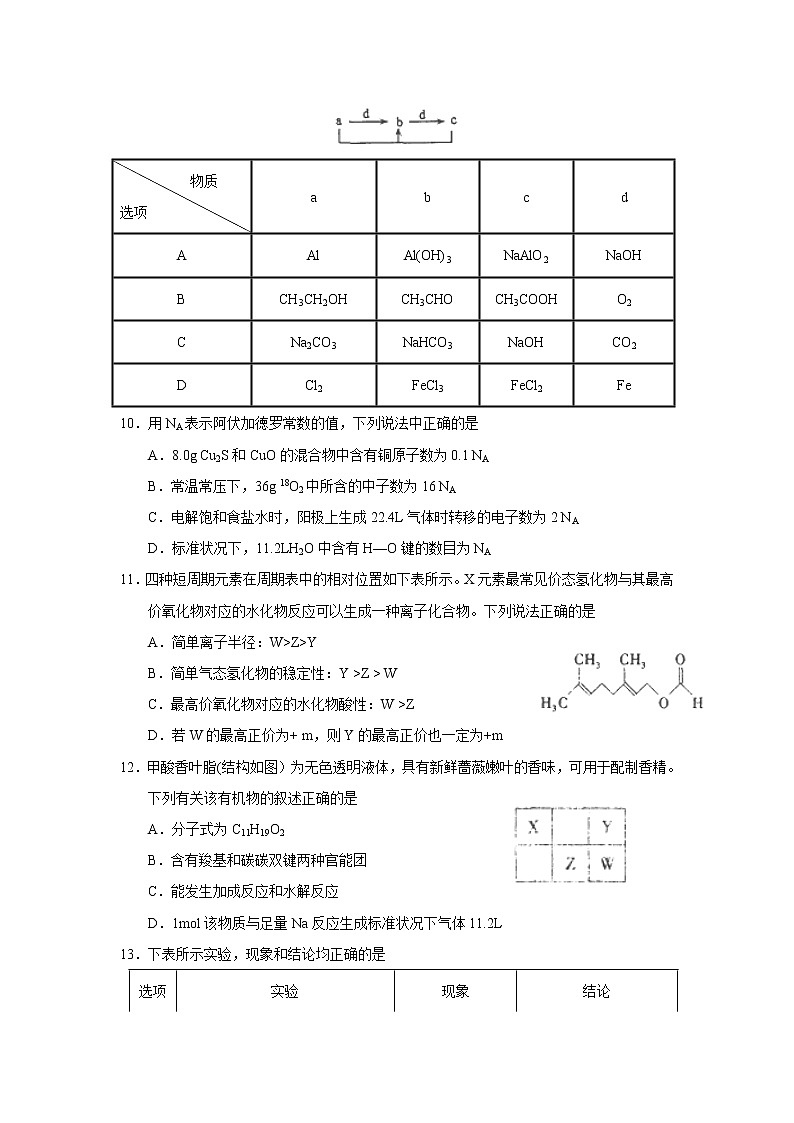
9.下表各组物质中,物质之间通过一步反应就能实现如右图所示转化的是
物质 选项 | a | b | c | d |
A | Al | Al(OH)3 | NaAlO2 | NaOH |
B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
C | Na2CO3 | NaHCO3 | NaOH | CO2 |
D | Cl2 | FeCl3 | FeCl2 | Fe |
10.用NA表示阿伏加徳罗常数的值,下列说法中正确的是
A.8.0g Cu2S和CuO的混合物中含有铜原子数为0.1 NA
B.常温常压下,36g 18O2中所含的中子数为16 NA
C.电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2 NA
D.标准状况下,11.2LH2O中含有H—O键的数目为NA
11.四种短周期元素在周期表中的相对位置如下表所示。X元素最常见价态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物。下列说法正确的是
A.简单离子半径:W>Z>Y
B.简单气态氢化物的稳定性:Y >Z > W
C.最高价氧化物对应的水化物酸性:W >Z
D.若W的最高正价为+ m,则Y的最高正价也一定为+m
12.甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精。下列有关该有机物的叙述正确的是
A.分子式为C11H19O2
B.含有羧基和碳碳双键两种官能团
C.能发生加成反应和水解反应
D.1mol该物质与足量Na反应生成标准状况下气体11.2L
13.下表所示实验,现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀生成 | 该溶液中含有SO42- |
D | 向FeCl3和KSCN混合溶液中,加入少量KC1固体 | 溶液颜色变浅 | FeCl3+3KSCN Fe(SCN)3+3KC1平衡向逆反应方向移动 |
14.利用I2O5消除CO污染的反应为5CO(g) +I2O5(s) 5CO2(g) +I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图。下列说法正确的是
A.该反应的△H>0
B.T1时CO的平衡转化率为80%
C.反应处于c点时,一定有v正= v逆
D.d点时,向恒容容器中充入2mol CO,再次平衡后,CO2的体积分数增大
15.肼一双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。下列有关说法中正确的是
A.惰性电极A作正极
B.正极电极反应式为H2O2 +2e-==2OH-
C.电解质溶液中的Na+从B极区迁移到A极区
D.电池工作过程中,A极区溶液的pH增大
16.向20mL0.5mol • L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是
A.由水电离出的c(H+):C点>B点
B.醋酸的电离平衡常数:B点> A点
C.从A点到B点,混合溶液中可能存在:c( CH3COO-) = c(Na+)
D.C 点混合溶液中一定存在:c(Na+) =2c(CH3COO-) +2c(CH3COOH)
第二卷 非选择题
二、填空题(本题包括6道小题,共52分)
17.(6分)已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A 为红棕色气体,B为强酸,X为常见金属单质。
(1) C的化学式为____________。
(2) A与水反应的化学方程式为____________。
(3)某温度下(>100℃)若mgX与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式___________。
18.(8分)有A、B、C三种常见的短周期元素,它们的取子序数逐渐增大。A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数等于其电子层数,且为C元素原子最外层电子数的一半。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。 甲、乙、丙、丁四种物质之间的相互反应关系如下图:
请回答:
(1)写出A的最高价的氧化物的电子式___________;C在周期表中的位置____________。
(2)用有关化学用语解释丙溶液呈碱性的原因____________。
(3)写出甲溶液与足量乙溶液反应的离子方程式: ____________。
19.(12分)丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如下:
已知:
(1)D生成E的反应类型为________;
(2)F的官能团名称为________;
(3)E的含苯环同分异构体共有________ 种(含E);
(4)J是一种酯,分子中除苯环外还含有一个五元环,J的结构简式为________ ,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为________。
(5) 利用題中信总写出以乙醛和苯为原料,合成的路线流程图(其它试剂自选)。
_______________________
20.(9分)亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)—定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g) +NaCl(s) NaNO3(s) +ClNO(g) △H1 | K1 |
② | 4NO2(g) +2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) △H2 | k2 |
③ | 2NO(g)+Cl2(g) 2ClNO(g) △H3 | K3 |
K3=_______(用K1、K2表示)。
(2)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2 (g) 2ClNO(g) △H3。
① 下列描述能说明该反应已达到平衡状态的是_____(填序号)
A.v正(Cl2)=2v逆(NO) B.容器内混合气体的密度保持不变
C.容器内气体压强保持不变 D.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(P)随时间(t)的变化如图I曲线a所示,则△H3______0(填“ >”、“ < ”或“不确定");若其他条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I曲线b所示,則改变的条件是_________。
③图II是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______。
21.(10分)锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:
已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1)“浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________(任写一种)。请写出其中发生的氧化还原反应离子方程式: _________。滤渣的成分为S单质和_________。
(2)水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2OSb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
(3)简述检验沉淀是否洗净的实验方法: _________,若未出现浑浊则证明沉淀己洗干净,反之则没有。
22.(7分)古代硫酸的制法是隔绝空气锻烧绿矾(FeSO4•7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。已知SO3的熔点是16.8°C,沸点是44.8°C,在加热条件下SO3具有比较强的氧化性。完成下列各空:
(1)绿矾油中溶质的化学式为_________。
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U型管出现无色粘稠的液体,B中品红溶液褪色。
①上述装置正确的连接顺序是A→(_______________________)(用大写字母表示)。
② 写出煅烧绿矾的化学方程式_________。
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加人足量的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为_________。
临川一中2017—2018学年度下学期期中考试
高二化学试卷答案
一、选择题 1-16 ABAB CDBC DACC ABBA
17、Fe (NO3)3 3NO2+H2O=2HNO3+NO 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H=-168Q/m kJ/mol
18、 或 第三周期 ⅥA族 CO32-+H2OHCO3-+OH-
4H++AlO2―= Al3++2H2O
19、取代反应 醛基、溴原子 4
20、K12/K2 cd < 加催化剂 乙 2
21、粉碎(或加热或搅拌或增大FeCl3浓度) Sb2S3+ 6Fe3+=3S+ 6Fe2++ 2Sb3+ SiO2 加大量的水,加热或加氨水(不能加氢氧化钠) 取最后一次洗涤液少量于试管中,加硝酸酸化的硝酸银溶液
22、H2SO4 D→(E)→B→C 2FeSO4·7H2O △ Fe2O3+SO3↑+SO2↑+14H2O↑((或 2FeSO4·7H 2O △ Fe2 O3 + H2SO4 +SO2 ↑+13H2O↑ ) 2∶1








